- Home /
- Publicaciones de patentes /
- PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR)
Patente nacional por "PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR)"
Este registro ha sido solicitado por
Persona física
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 17/09/2021
- Número solicitud:
-
P202130869
- Número publicación:
-
ES2936558
- Fecha de concesión:
-
11/09/2023
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
- Clasificación Internacional de Patentes:
- A61F 2/38
- Clasificación Internacional de Patentes de la publicación:
- A61F 2/38
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
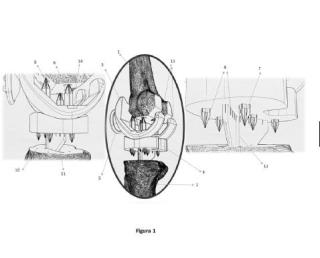
+ ES-2936558_A11. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , caracterizada por que se compone fundamentalmente de dos piezas, una pieza femoral (3) y una pieza tibial (4) , a las que se añade un botón rotuliano (5) cuya función es meramente estética, todas ellas diseñadas y fabricadas mediante técnicas de impresión 3D y fabricadas íntegramente en polieterimida (PEI) , en las que: - la pieza femoral (3) cuenta con: - unos pinchos (6) en su parte superior, para su introducción en las perforaciones cilíndricas (9) que habrán de ser realizadas en las paredes planas adaptadas del fémur (1) , - unos cóndilos (13) que se adaptan a la parte superior de la pieza tibial (4) , los cuales presentan unos cajeados (14) en sus extremos, que permiten su correcta fijación al útil con el cual se realice la inserción de la pieza femoral (3) en el fémur (1) . - una pieza tibial (4) cuenta en su parte inferior con: - unos pinchos (7) , para su introducción en las perforaciones cilíndricas (10) , que habrán de ser realizadas en las paredes planas adaptadas de la tibia (2) , - unos refuerzos antirretorno (8) en forma de triángulos, que garantizan una correcta fijación de la pieza tibial (4) en todo su volumen, - una quilla tibial (12) en forma de ala delta, que se inserta en la tibia (2) por medio de una perforación (11) practicada en la tibia (2) , 2. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, donde el PEI es ULTEM™ 1010. 3. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, caracterizada por que se fabrica mediante impresión 3D por medio de la técnica de FDM. 4. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicaciones anteriores, en cualquier individuo humano o animal. 5. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicaciones anteriores, para individuos sensibles a metales.
+ ES-2936558_B21. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , caracterizada por que se compone fundamentalmente de dos piezas, una pieza femoral (3) y una pieza tibial (4) , a las que se añade un botón rotuliano (5) cuya función es meramente estética, todas ellas diseñadas y fabricadas mediante técnicas de impresión 3D y fabricadas íntegramente en polieterimida (PEI) , en las que: - la pieza femoral (3) cuenta con: - unos pinchos (6) en su parte superior, para su introducción en las perforaciones cilíndricas (9) que habrán de ser realizadas en las paredes planas adaptadas del fémur (1) , - unos cóndilos (13) que se adaptan a la parte superior de la pieza tibial (4) , los cuales presentan unos cajeados (14) en sus extremos, que permiten su correcta fijación al útil con el cual se realice la inserción de la pieza femoral (3) en el fémur (1) . - una pieza tibial (4) cuenta en su parte inferior con: - unos pinchos (7) , para su introducción en las perforaciones cilíndricas (10) , que habrán de ser realizadas en las paredes planas adaptadas de la tibia (2) , - unos refuerzos antirretorno (8) en forma de triángulos, que garantizan una correcta fijación de la pieza tibial (4) en todo su volumen, - una quilla tibial (12) en forma de ala delta, que se inserta en la tibia (2) por medio de una perforación en forma de ala delta (11) practicada en la tibia (2) para la inserción de la quilla tibial. 2. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, caracterizada por que se fabrica mediante impresión 3D por medio de la técnica de modelado de deposición fundida (FDM) . 3. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, en cualquier individuo humano o animal. 4. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, para individuos sensibles a metales.
Los productos y servicios protegidos por este registro son:
A61F 2/38
Descripciones:
+ ES-2936558_A1 PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) CAMPO TÉCNICO La presente invención pertenece al campo de la biomecánica. El objeto técnico consiste en un conjunto protésico formado por, fundamentalmente, dos piezas (una pieza femoral y una pieza tibial) , y un botón rotuliano, para Artroplastia Total de Rodilla (ATR) , fabricadas íntegramente en polieterimida (PEI) . ANTECEDENTES DE LA INVENCIÓN Cualquier cuerpo extraño en el organismo favorece el desarrollo de infecciones y, por consiguiente, un rechazo del mismo (Wood et al., 2015) . Particularmente, este fenómeno es frecuente en los implantes dentales, que se recubren por la saliva cuyas glucoproteínas favorecen la colonización por microorganismos (sobre todo, estreptococos) , los cuales proliferan en la cavidad oral (Siqueira et al., 2012) ; (Subramani et al., 2009) . De manera similar ocurre con las prótesis en traumatología (por ejemplo: en la artroplastia total de rodilla ATR, o cadera ATC) , cuyos materiales usados han sido a base de aceros inoxidables, aleaciones de titanio, aleaciones de Cr-Co-Ni y otros metales peligrosos para el ser humano (Keegan et al., 2007) . En este caso, el problema surge por falta de biocompatibidad demostrada a medio o largo plazo. En estas piezas se busca un aumento de su vida útil, facilitar su integración en el hueso mediante la incorporación de un material cementado a las superficies implantables, que sirva de barrera osteoinductiva real y proteja de infecciones. A pesar de conseguir un alto índice de éxito en estas intervenciones aún existe un 19% de pacientes que muestran disconformidades con las intervenciones a las que se han visto sometidas y han provocado una revisión (Bourne et al., 2010) . Según Khosravipur 2017, para reducir la revisión de estas intervenciones y dotarlas de más longevidad, habría que influir principalmente en la cinemática articular, el cual depende a su vez del diseño del implante y la biomecánica. (Fitzpatrick et al., 2012) , añade la combinación ntre el diseño y la técnica quirúrgica que exija el diseño del implante como factor decisorio. Los diseños más recientes van encaminados a personalizar las prótesis al paciente y, para ello, la fabricación aditiva (FA) brinda una oportunidad de mejora para diseñar prótesis a medida muy útil para superar este hito. Algunos materiales con los que es posible obtener prototipos en FA son biocompatibles y ofrecen unas prestaciones mecánicas idóneas para sustituir a los actuales materiales basados en aleaciones metálicas de Cr-Co-Mo (Vitalium) o titanio. Las piezas personalizadas obtenidas mediante FA resultan más baratas que ninguna otra técnica de fabricación actualmente aplicable. No obstante, para una producción seriada cubriendo las diferentes tallas anatómicas existentes en las piezas protésicas disponibles comercialmente, la FA no sería la solución más adecuada. Para este fin, es más aconsejable probar la tecnología de inyección en moldes, la cual permite fabricar piezas seriadas con máxima calidad y sin generar ningún residuo. Sin embargo, no es solo suficiente que un material sea biocompatible, adicionalmente, se deben superar ensayos bioquímicos de citotoxicidad y osteoinducción. Por último, con carácter previo a su fabricación, los modelos geométricos diseñados deben superar como mínimo, simulaciones numéricas basadas en análisis estructurales para confirmar un rendimiento similar a las actuales basadas en materiales metálicos. En la actualidad, la tipología de prótesis de deslizamiento es la que está siendo usada con mayor profusión en el mundo frente a las de bisagra, como la registrada en la patente [ES2429390B1], más adecuada para casos más severos de reemplazos (Zhang et al., 2020) . Las prótesis de deslizamiento se componen de 4 partes aunque son únicamente 3 las que influyen en la estabilidad y comportamiento biomecánico del conjunto, la cuarta pieza es el botón rotuliano que se integra para cumplir un efecto más estético que funcional. El Polietileno (PE) y más concretamente el Polietileno de peso molecular ultra alto (UHMWPE) se ha utilizado en artroplastia total de rodilla durante más de 50 años, debido a las buenas propiedades mecánicas y comportamiento bien tolerado, especialmente fricción y desgaste. Precisamente el desgaste, el aflojamiento, la inestabilidad y la infección del PE son las principales razones para revisiones de la artroplastia total de rodilla (ATR) según (Sharkey; et al., 2002) aunque la referencia (Schroer et al., 2013) demuestra lo contrario y concluye que el 50% de las revisiones vienen provocadas por una inestabilidad o por una infección. El desgaste de PE está directamente relacionado con tamaño de las áreas de contacto y la magnitud del contacto (Brien et al., 2015) . El desgaste de PE produce partículas de desgaste alrededor el implante de rodilla, que puede provocar osteólisis y el largo plazo puede rovocar el aflojamiento del implante (Khosravipour et al., 2018) . Las claves que se persiguen en cualquier nueva propuesta de prótesis deben ser: integración en el hueso sin incompatibilidad bioquímica y, longevidad que evite posteriores revisiones. El proceso de fabricación de las actuales prótesis metálicas se realiza por procesos de mecanizado por arranque de viruta y, es durante el tratamiento de la superficie donde mayor probabilidad se den alteraciones. Son varios los estudios que han analizado la superficie de las prótesis en busca de contaminantes químicos y/o físicos. Lo más habitual es encontrar residuos del granallado en la superficie, como son partículas de aluminio. Esta contaminación puede afectar gravemente a los procesos biológicos desencadenando reacciones contrarias o de cuerpo extraño que conllevarían a la inflamación de los tejidos e incluso la pérdida de la prótesis. De hecho, no sólo afecta que exista una partícula de un determinado tamaño en el comportamiento celular, si no su composición química. En la patente [US 2010/0161067A1], se contempla la introducción de cámara posterior en la pieza femoral, que proporciona control sobre el movimiento de la pieza femoral, lo que evita movimiento innecesario que llevaría al desgaste. Esta posee ciertas desventajas como incluir impacto entre la cámara y el poste de la pieza tibial, lo que produce un aumento en el desgaste y posibles deformaciones. Este efecto es incrementado en los casos en los que ocurre rotación interna o externa. Además, las traslaciones anteriores-posteriores se oponen a la tendencia natural del fémur de situarse en la zona más profunda del plato tibial. En la patente [WO 00/23011], el concepto novedoso introducido es el cambio gradual del perfil frontal del cóndilo femoral en las superficies de contacto con el plato tibial, cuya superficie cambiaría de manera similar. El resultado alcanzado será encontrar las posiciones con menor energía potencial, en cada ángulo de flexión. Estos puntos de contacto en ambos cóndilos son simétricos. Las patentes [EP2774582A1], [WO2004012633A1], [US2011184525A1], [US2012083894A1] [US2016242917A1] [WO2016046654A1] [WO2016071938A1], son similares modelos geométricos de 3 o más piezas fijadas entre ellas con limitada capacidad de giro y cuyo rozamiento agresivo provocan desprendimientos continuos de partículas metálicas y dispuestas para rellenar con cemento óseo. Las patentes [WO2013156743A1], [WO2015048273A1], sólo aportan soluciones para prótesis de sustitución temporal o de reemplazo. La patente [EP0294298A], difiere con respecto a la presente propuesta en que, no se incluyen unos pinchos adicionales a la quilla en el omponente tibial, el tipo de perforación en el fémur no es cilindrico, y no se emplea una resina termoplástica como el PEI para la fabricación de la prótesis. Las patentes [US2020138584A1], [WO2012018567A1] únicamente aportan una pieza tibial con dudosa capacidad de fijación al hueso y de implantación según técnica quirúrgica. De manera similar, la patente [WO2008054389A1] sólo aporta una pieza femoral que no se especifica la forma quirúrgica de su implantación. La patente [GB2067412A] también divulga una prótesis mecánica para ATR, que incluye una pieza femoral y una pieza tibial. Las diferencias con la presente propuesta son que el material de fabricación no es PEI, las piezas no se obtienen mediante impresión 3D, y la prótesis no incluye unos pinchos para su fijación en la tibia y fémur. La patente [US5116375A] hace referencia a una prótesis de rodilla que incluye una pieza femoral que se incrusta en la zona baja del fémur, y una pieza tibial que se incrusta en la parte superior de la tibia. Ambas piezas están formadas por un material biocompatible. Las principales diferencias con respecto a la presente propuesta se basan en que, pese a indicar que el material de la prótesis es biocompatible, se utilizan materiales metálicos y, en ningún caso, una resina termoplástica como el PEI o el polieteretercetona (PEEK) . Además, no se hace referencia a que el sistema de fabricación sea mediante impresión 3D Más recientemente, la patente [EP2744452A1] hace referencia a una componente tibial de prueba, fabricada en una única pieza de un material plástico, entre los que se nombra el PEI. No se trata, por tanto, de una prótesis completa para la rodilla, ni de larga duración, no se divulga la forma de la pieza femoral. Tampoco se especifica cómo se va a fabricar la pieza mediante impresión 3D con PEI. La patente [CN107822746A], trata de una prótesis de articulación de rodilla con estructura de hueso trabecular que incluye un soporte para la tibia y una almohadilla para la espinilla. Dispone de más de 2 componentes y parece que su fabricación es íntegramente en material PEEK, mediante la técnica de modelado de deposición fundida (FDM) , sin embargo, en otro párrafo se expresa el uso de este material en polvo, imposible de usar en las actuales técnicas FDM. No se han encontrado filamentos para impresión 3D de este tipo de material en ese año 2017, ni siquiera en la actualidad existe filamento de PEEK puro, sí es posible encontrarlos, con aditivo de fibra de carbono. Tampoco se especifica qué tipo de material PEEK se usa y con qué características bioquímicas. Se desconoce el origen del PEEK, si es de fabricación propia o de alguna marca o fabricante conocido. Con todo lo anterior, resulta difícil exponer diferencias claras sobre la presente propuesta, ni siquiera, basándose en el único gráfico incluido en el documento. La patente [CN112190757A], trata de una prótesis de rodilla tumoral, orientada específicamente a a sustitución funcional del tumor, ese aspecto ya la aleja de la presente propuesta, orientada a ese tipo de defecto óseo (oncología ósea) , cuya geometría es notablemente diferente. La prótesis consta también de dos componentes: uno tibial y otro femoral fabricadas con material PEEK-CRF (Fibra de carbono) , aunque, se destaca la presencia de juntas fabricadas en PE y, la meseta tibial, en aleación de Cr-Co-Mo. No se especifica claramente el modo de fabricación de las piezas que forman la prótesis tumoral que, en ningún caso, usa la fabricación aditiva. La patente [CN105748176A] describe una prótesis para ATR, que incluye una pieza femoral y una pieza tibial fabricadas con PEEK, con buena biocompatibilidad. Las principales diferencias con respecto a la presente propuesta consisten en que no se utiliza PEI sino PEEK para la fabricación de la prótesis y no se menciona que la fabricación sea mediante impresión 3D. Tampoco se incluyen unos pinchos en el componente tibial, solamente una quilla. La patente [US2015335449A1] divulga un sistema de prueba para el remplazo de la rodilla que, aunque está compuesto por tres piezas, el inserto tibial está hecho de materiales biocompatibles, entre los que se incluye el PEI. Sin embargo, no se indica el método de fabricación, ni que las demás piezas puedan realizarse también en PEI. La patente [WO2021094382A1] hace referencia a una prótesis de rodilla, que incluye un componente tibial y otro femoral, que incluye una capa articulada de PEI, también se indica que el proceso puede llevarse a cabo por moldeo por inyección. Dicho documento también se centra en realizar un estudio de los diferentes polímeros adecuados para constituir la capa articulada y la combinación entre ellos. Sin embargo, existen varias diferencias con respecto a la presente propuesta como, por ejemplo, que el componente tibial está formado a su vez, por dos piezas, y que el PEI no se emplea en la fabricación del núcleo de estas. La patente [GB2547907A] describe una prótesis de rodilla, en particular, una pieza femoral y el método de fabricación de dicha pieza femoral. Dicha pieza incluye unos pinchos para su fijación al fémur, un botón rotuliano, y está fabricada íntegramente por moldeo por inyección, con PEEK de materia, y se indica el ejemplo de la marca PEEK-OPTIMA de la empresa Invibio Limited. Las diferencias con la presente propuesta son que el componente tibial, que no es el objetivo principal del documento [GB2547907A], se fabricaría con UHMWPE por ser más blando que el PEEK. No se utiliza, por tanto, para ninguna de las dos piezas el PEI, y no incluyen los pinchos para fijar a la tibia en la pieza tibial. Sin embargo, la bibliografía consultada no reporta casos de prótesis no metálicas en los cuales se demuestre que la inserción de la pieza tibial al hueso trabecular se realizará sin ayuda de cemento óseo ni sin riesgo de sufrir aflojamientos posteriores. Tampoco, e han encontrado piezas cuyo desgaste continuo no genere contaminación de partículas de dudosa respuesta inmunitaria. Por último, tampoco se han encontrado registros donde se determine el nivel de citotoxicidad del material implantado ni el nivel de penetración y fijación al hueso de piezas no metálicas que favorezca la integración implante-hueso. El único material no metálico usado en anteriores patentes es el PEEK o compuestos de PEEK-CRF, los cuales, no han sido probados de manera concluyente su bioactividad o sus buenas prestaciones osteoinductivas o de reacción inmunológica. La referencia (Hooper et al., 2019) , es el único registro que haya usado el material ULTEMTM1010 biocompatible en la fabricación aditiva de piezas protésicas, la diferencia principal con la presente propuesta consiste en que, el estudio referenciado solo hace referencia al uso de ULTEM 1010 para la fabricación de herramientas que intervienen en una ATR y no en la prótesis en sí. Además, se indica que dichos instrumentos son de un solo uso. No obstante, en las referencias (Miguel Suffo, 2020) , (M. Suffo et al., 2020) , ya se tienen antecedentes de sus buenas prestaciones en el campo biomédico. Como conclusión, se podría considerar como el estado de la técnica más cercano, la patente [US5116375A], aunque no divulga unos cajeados en cada cóndilo para su fijación al útil empleado en la inserción, ni un botón rotuliano, ni que las perforaciones que se realicen en el fémur y en la tibia sean cilíndricas o en ala delta. No obstante, que la prótesis esté fabricada en polieterimida (PEI) no está divulgado en la patente [US5116375A]. El efecto técnico que se produce por emplear PEI en vez de materiales metálicos para la fabricación de la prótesis es, evitar el desgaste que se produce con dichos materiales. El problema técnico objetivo que se resuelve es cómo reducir el rechazo y aumentar la biocompatibilidad de las prótesis en aquella población que es sensible a los metales. Otra patente que se considera igualmente cercano al estado de la técnica es [CN105748176A] pero, las principales diferencias se basan en que la pieza tibial no incluye pinchos (solo la quilla) y que el material empleado es PEEK. Esta última, se considera la diferencia esencial. El empleo del PEEK es más común en el estado de la técnica para prótesis no metálicas pero el PEI (ULTEM 1010) tiene mejores propiedades de bioactividad. Referencias bibliográficas empleadas. Bourne, R. B., Chesworth, B. M., Davis, A. M., Mahomed, N. N., Charron, K. D. J., & Met, D. (2010) . Patient Satisfaction after Total Knee Arthroplasty Who is Satisfied and Who is Not ? 57-63. https://doi.org/10.1007/s11999-009-1119-9 Brien, S. T. O., Luo, Y., & Brandt, J. (2015) . In-vitro andin-silico investigations on the in fl uence of contact pressure on cross-linked polyethylene wear in total knee replacements. 333, 687-693. https://doi.org/10.10167j.wear.2015.02.048 Fitzpatrick, C. K., Clar y , C. W., & Rullkoetter, P. J. (2012) . The role of patient, surgical, and implant design variation in total knee replacement performance. Journal of Biomechanics, 45 (12) , 2092-2102. https://doi.org/10.1016/jjbiomech.2012.05.035 Hooper, J., Schwarzkopf, R., Fernandez, E., Buckland, A., Werner, J., Einhorn, T., & Walker, P. S. (2019) . Feasibility of single-use 3D-printed instruments for total knee arthroplasty. The Bone & Joint Journal, 101-B (7_Supple_C) , 115-120. https://doi.org/10.1302/0301-620X.101B7.BJJ-2018-1506.R1 Keegan, G. M., Learmonth, I. D., & Case, C. P. (2007) . Orthopaedic metals and their potential toxicity in the arthroplasty patient. A review of current knowledge and future strategies. Journal of Bone and Joint Surger y - Series B, 89 (5) , 567-573. https://doi.org/10.1302/0301-620X.89B5.18903 Khosravipour, I., Pejhan, S., Luo, Y., & Wyss, U. P. (2018) . Customized surface-guided knee implant: Contact analysis and experimental test. 232 (1) , 90-100. https://doi.org/10.1177/0954411917744586 Schroer, W. C., Berend, K. R., Lombardi, A. V, Barnes, C. L., Bolognesi, M. P., Berend, M. E., Ritter, M. A., & Nunley, R. M. (2013) . Why Are Total Knees Failing Today? Etiology of Total Knee Revision in 2010 and 2011. Journal of Arthroplasty, 28 (8) , 116-119. https://doi.org/10.1016/j.arth.2013.04.056 Sharkey;, P. F., Shastri;, R. H. R. S., & and Sidney M. Jacoby, B. (2002) . Why Are Total Knee Arthroplasties Failing Today? CLINICAL ORTHOPAEDICS AND RELATED RESEARCH, 404, 7-13. https://doi.org/10.1097/01.blo.0000036002.13841.32 Siqueira, W. L., Custodio, W., & McDonald, E. E. (2012) . New insights into the composition and functions of the acquired enamel pellicle. Journal of Dental Research, 91 (12) , 1110-1118. https://doi.org/10.1177/0022034512462578 Subramani, K., Jung, R. E., Molenberg, A., & Hammerle, C. H. F. (2009) . Biofilm on dental implants: a review of the literature. The International Journal of Oral & Maxillofacial Implants, 24 (4) , 616-626. https://doi.org/10.5167/uzh-26110 Suffo, M., Vilches-Pérez, J. I., & Salido-Peracaula, M. (2020) . Comparative Analysis of the Adhesion of Metallic Inserts on Dental Implants-Prosthetic Assembly Generated by Polymeric Materials Used for Additive Manufacturing. In Lecture Notes in Mechanical Engineering (Vol. 1, pp. 245-253) . https://doi.org/10.1007/978-3-030-41200-5_27 Suffo, Miguel. (2020) . Determination of Adhesive to Be Applied in the Fabrication of Prototypes Using FDM Techniques of 3D Printing in Component Parts Using ULTEM TM 1010 (pp. 959-969) . Wood, N. J., Jenkinson, H. F., Davis, S. A., Mann, S., OSullivan, D. J., & Barbour, M. E. (2015) . Chlorhexidine hexametaphosphate nanoparticles as a novel antimicrobial coating for dental implants. Journal of Materials Science: Materials in Medicine, 26 (6) , 1-10. https://doi.org/10.1007/s10856-015-5532-1 Zhang, J. Y., Wang, J., Tian, D. M., Jiang, D. P., Li, J. J., & Hu, Y. C. (2020) . Spherical center and rotating platform hinged knee prosthesis: Finite-element model establishment, verification and contact analysis. Knee, 27 (3) , 731-739. https://doi.org/10.1016Zj.knee.2020.04.022 EXPLICACIÓN DE LA INVENCIÓN La invención consiste un conjunto protésico formado, fundamentalmente, por dos piezas no metálicas, una pieza femoral y una pieza tibial, ambas fabricadas en material biocompatible, y más concretamente en PEI. Se añade una tercera pieza, también en PEI, sin relevancia en la cinemática del conjunto pero que sí influye en la estética. La invención propone una reducción de piezas al conjunto protésico convencional. Su geometría está basada en un modelo comercial descrito por el fabricante Str y ker® Orthopaedics, en particular, su modelo Triathlon® Knee System. La pieza femoral apoya sus cóndilos sobre la pieza tibial y cuenta con unos pinchos en su parte superior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas del fémur del paciente. Estos cóndilos presentan unos cajeados en sus extremos, para permitir su correcta fijación al útil que se usará en la inserción de la pieza en el hueso. La pieza tibial que está diseñada en forma de silla de montar, con amplia superficie de contacto para permitir los ángulos de giro anatómicos en los tres planos principales. La ieza tibial cuenta con unos pinchos en su parte inferior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas de la tibia del paciente. La pieza tibial cuenta además con unos refuerzos antirretorno en forma de triángulos, capaces de conseguir una fijación completa al hueso sin necesidad de cementación. Adicionalmente, la pieza tibial cuenta con una quilla en forma de ala delta, que igualmente habrá de ser insertada en la tibia del paciente. Esta invención propone una alternativa no metálica, biocompatible, osteoinductora y de fijación asegurada sin problemas de desprendimientos contaminantes en toda su vida útil. El material propuesto para la construcción de los componentes de este conjunto protésico es una polieteramida (PEI) , mediante cuyo empleo se pretende cubrir la necesidad de este tipo de prótesis de un sector de la población que rechaza las prótesis metálicas, debido a su especial alergia a los metales. Concretamente, en la invención se propone el empleo de un tipo de PEI, comercialmente denominado ULTEM™ 1010, un termoplástico biocompatible certificado por el fabricante (Sabic) , al que se ha sometido a ensayos de citotoxicidad y lead/death, y que posee un módulo elástico de 2, 86GPa, muy próximo al del hueso cortical. Debido a la alta elasticidad del material PEI usado, el conjunto se adapta al movimiento anatómico sin lesiones para el paciente y, al ser de bajo peso, la movilidad de este no se resiente. Adicionalmente, las buenas propiedades térmicas del PEI, permiten que no se produzca la abrasión de las zonas en contacto y el acabado superficial de estas zonas en contacto admiten un pulido que garantiza el deslizamiento con un rozamiento admisible. En cualquier caso, dado que no se usa material contaminante, los posibles desprendimientos motivados por los giros en diferentes planos no contaminan los tejidos ni producen pérdida de hueso. Por estas razones, las piezas que forman el conjunto protésico objeto de la invención, evitan los principales problemas que surgen con las prótesis basadas en materiales metálicos como el acero inoxidable, aleaciones de titanio o de Cr-Co-Ni/Mo, las cuales, o garantizan la formación de hueso y provocan problemas en la proximidad de la cirugía y, sobre todo, los fenómenos de corrosión. Adicionalmente, las prótesis metálicas que actualmente son usadas en traumatología, tanto en humano como en animal, en general, lo único que usan como barrera protectora del material metálico es cemento óseo. Con la invención propuesta, se elimina la necesidad de emplear cemento óseo, ni como barrera protectora del material metálico, ni para la fijación de sus piezas. El método de fabricación preferente de las piezas protésicas dependerá de la solución que se requiera, para piezas personalizadas se usará la técnica Fused Deposition Modeling (FDM) en impresión 3D. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Muestra la configuración geométrica de las partes de la prótesis y su inserción en huesos. En ella se representan: 1.- Fémur. 2.- Tibia. 3.- Pieza femoral. 4.- Pieza tibial. 5.- Botón rotuliano. 6.- Pinchos de la pieza femoral. 7.- Pinchos de la pieza tibial. 8.- Refuerzos antirretorno de la pieza tibial. 9.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas del fémur. 10.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas de la tibia. 11.- Perforación en forma de ala delta practicada en la tibia. 12.- Quilla tibial. 13.- Cóndilos. 14.- Cajeados Figura 2. Muestra el aspecto final de las dos partes principales que forman en conjunto protésico, fabricadas en PEI. En ella se distingue: a) Pieza femoral. b) Pieza tibial. Figura 3. Muestra los resultados obtenidos en el ensayo de viabilidad celular. REALIZACIÓN PREFERENTE DE LA INVENCIÓN La realización preferente de la invención se describe en detalle a continuación con referencia a la figura 1. A partir de los modelos 3D obtenidos, tomando como referencias las 3 partes de la prótesis metálica Triathlon® Knee System, se propone una alternativa compuesta únicamente por dos partes no metálicas, una pieza femoral y una pieza tibial, formada por la fusión de la pieza tibial con el inserto de PE, siendo ambas piezas fabricadas en PE. Partiendo de modelos 3D de huesos femoral (1) y tibial (2) , se sitúan los modelos 3D correspondientes a las piezas protésicas femoral (3) y tibial (4) , diseñadas a partir de las piezas cedidas por el fabricante Str y ker. El botón rotuliano (5) , que también forma parte del objeto de la invención, sólo tiene una función estética en el conjunto, no tiene relevancia en la funcionalidad de la prótesis y se fabrica en el mismo material que las demás piezas. Para la fijación de las piezas femoral (3) y tibial (4) en los huesos, se modelan pinchos (6) en la pieza fermoral (3) , y (7) en la pieza tibial (4) . Adicionalmente, se disponen unos refuerzos antirretorno en forma de triángulos (8) , lo cuales, garantizarán una correcta fijación de la pieza (4) en todo su volumen y evitan la micromovilidad. Para comprobar la geometría y tamaño de los pinchos, se realizan perforaciones cilíndricas (9) y (10) , en las paredes planas de las piezas que representa el hueso femoral (1) y la tibia (2) . Por último, en la pieza que simula la tibia (2) , se practica una perforación en forma de ala delta (11) , la cual, permite la correcta inserción de la quilla tibial (12) . Las curvaturas dispuestas en los cóndilos (13) de la pieza femoral (3) , se adaptan a la parte superior (bandeja tibial) , de la pieza tibial (4) y su encaje es perfecto para permitir su rotación y deslizamiento, el cual, mantendrá siempre el contacto en todos los ángulos e flexión. Se disponen cajeados (14) en los extremos de cada cóndilo (13) para permitir su correcta fijación al útil con el cual se usará en la inserción de la pieza en el hueso. Las piezas femoral (3) y tibial (4) modeladas en 3D por la herramienta CAD, se exportaron para su fabricaron aditiva en FDM con filamento ULTEM™ 1010 biocompatible y adaptada a la impresora Fortus 450MC. Para este trabajo, se usó una boquilla tipo T14 (0.254 mm) ; para el material de soporte se usó un tipo de boquilla T16 (0.254 mm) . A la finalización de la impresión, se pulen las superficies hasta alcanzar la rugosidad requerida. El resultado final se observa en la imagen de la figura 2. El conjunto protésico modelado en 3D se exportó a la herramienta de simulación FEM (ANSYS/Academic Research de ANSYS Inc., Houston, PA, USA) , donde se analizaron en base a la norma ISO 14243-3:2009, la cual sugiere tener en cuenta las distribuciones de cargas para diferentes ángulos de flexión: 0°, 30°, 60°, 90° y, 120°. Para cada ángulo se llevó a cabo un análisis estático estructural considerando un contacto tipo rugoso entre las dos piezas aplicando un coeficiente de fricción de 0, 04. Se simuló una carga axial de 2000N, aplicada a la parte superior de la superficie de la pieza tibial, donde se encuentra el contacto entre los cóndilos femorales y la bandeja tibial. Para comprobar la bioactividad del material, se realizan varios ensayos sobre materiales no metálicos. En la tabla 1, se recogen las descripciones de los materiales usados en el ensayo. Tabla 1. Datos de materiales y fabricantes usados en el ensayo de viabilidad celular. Se aplican cultivos de células primarias osteoblasticas humanas (COPH, células adquiridas a la empresa PROMOCELL como HOB®) . Para dicho estudio de viabilidad elular, COPH se cultivaron en medios osteogénicos y se realizaron ensayos de viabilidad/citotoxicidad a 7 días. En este ensayo, denominado LIVE/DEAD, las células muertas se marcan con EthD-1 y las vivas con Cal-ceína AM. Como control negativo, antes del proceso de marcaje, se incubaron cultivos de COPH con metanol al 70% durante 30 minutos. Como control positivo se usaron cultivos de COPH sin ningún tratamiento. En primer lugar, se eliminó el medio de cultivo, posteriormente se lavaron con PBS y finalmente se añadió la solución de marcaje. Después de una incubación de 30 minutos a temperatura ambiente, se observaron bajo microscopía de fluorescencia. Para el análisis de la intensidad de las distintas fluorescencias se usó el software ImageJ, realizándose para su representación la relación entre ambos marcadores. Según los resultados obtenidos y presentados en la figura 3, todos los materiales estudiados no interfieren en el crecimiento y viabilidad celular de osteoblastos humanos, siendo materiales óptimos para futuros ensayos de bioactividad en cultivos con osteoblastos humanos. Esta conclusión se apoya en la comparación entre el control positivo y los distintos cultivos para cada material. En detalle, se observa que el material ULTEMTM1010 tiene un interesante efecto positivo en la viabilidad celular de las COPH cuando comparamos este tratamiento con los controles positivos, destacando con una ratio por encima de 6. APLICACIÓN INDUSTRIAL El conjunto protésico no metálicos objeto de la invención proporciona una alternativa válida a pacientes sensibles a metales. En particular, la prótesis completa de rodilla descrita ofrece una solución a los fabricantes de marcas comerciales de este tipo de productos, los cuales, no ofertan debido a su escasa producción y logística. El modelo descrito es compatible con el fabricante Str y ker con ligeras diferencias que la hacen más fácil de implantar ya que sólo presenta dos piezas: una femoral y otra tibial. Al basarse en un material certificado para su uso médico facilita su garantía de seguridad y, se ha complementado con un estudio de viabilidad celular para garantizar que no sólo exista pérdida ósea, sino que pueda generarse hueso a su alrededor.
+ ES-2936558_B2 PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) CAMPO TÉCNICO La presente invención pertenece al campo de la biomecánica. El objeto técnico consiste en un conjunto protésico formado por, fundamentalmente, dos piezas (una pieza femoral y una pieza tibial) , y un botón rotuliano, para Artroplastia Total de Rodilla (ATR) , fabricadas íntegramente en polieterimida (PEI) . ANTECEDENTES DE LA INVENCIÓN Cualquier cuerpo extraño en el organismo favorece el desarrollo de infecciones y, por consiguiente, un rechazo del mismo (Wood et al., 2015) . Particularmente, este fenómeno es frecuente en los implantes dentales, que se recubren por la saliva cuyas glucoproteínas favorecen la colonización por microorganismos (sobre todo, estreptococos) , los cuales proliferan en la cavidad oral (Siqueira et al., 2012) ; (Subramani et al., 2009) . De manera similar ocurre con las prótesis en traumatología (por ejemplo: en la artroplastia total de rodilla ATR, o cadera ATC) , cuyos materiales usados han sido a base de aceros inoxidables, aleaciones de titanio, aleaciones de Cr-Co-Ni y otros metales peligrosos para el ser humano (Keegan et al., 2007) . En este caso, el problema surge por falta de biocompatibidad demostrada a medio o largo plazo. En estas piezas se busca un aumento de su vida útil, facilitar su integración en el hueso mediante la incorporación de un material cementado a las superficies implantables, que sirva de barrera osteoinductiva real y proteja de infecciones. A pesar de conseguir un alto índice de éxito en estas intervenciones aún existe un 19% de pacientes que muestran disconformidades con las intervenciones a las que se han visto sometidas y han provocado una revisión (Bourne et al., 2010) . Según Khosravipur 2017, para reducir la revisión de estas intervenciones y dotarlas de más longevidad, habría que influir principalmente en la cinemática articular, el cual depende a su vez del diseño del implante y la biomecánica. (Fitzpatrick et al., 2012) , añade la combinación ntre el diseño y la técnica quirúrgica que exija el diseño del implante como factor decisorio. Los diseños más recientes van encaminados a personalizar las prótesis al paciente y, para ello, la fabricación aditiva (FA) brinda una oportunidad de mejora para diseñar prótesis a medida muy útil para superar este hito. Algunos materiales con los que es posible obtener prototipos en FA son biocompatibles y ofrecen unas prestaciones mecánicas idóneas para sustituir a los actuales materiales basados en aleaciones metálicas de Cr-Co-Mo (Vitalium) o titanio. Las piezas personalizadas obtenidas mediante FA resultan más baratas que ninguna otra técnica de fabricación actualmente aplicable. No obstante, para una producción seriada cubriendo las diferentes tallas anatómicas existentes en las piezas protésicas disponibles comercialmente, la FA no sería la solución más adecuada. Para este fin, es más aconsejable probar la tecnología de inyección en moldes, la cual permite fabricar piezas seriadas con máxima calidad y sin generar ningún residuo. Sin embargo, no es solo suficiente que un material sea biocompatible, adicionalmente, se deben superar ensayos bioquímicos de citotoxicidad y osteoinducción. Por último, con carácter previo a su fabricación, los modelos geométricos diseñados deben superar como mínimo, simulaciones numéricas basadas en análisis estructurales para confirmar un rendimiento similar a las actuales basadas en materiales metálicos. En la actualidad, la tipología de prótesis de deslizamiento es la que está siendo usada con mayor profusión en el mundo frente a las de bisagra, como la registrada en la patente [ES2429390B1], más adecuada para casos más severos de reemplazos (Zhang et al., 2020) . Las prótesis de deslizamiento se componen de 4 partes aunque son únicamente 3 las que influyen en la estabilidad y comportamiento biomecánico del conjunto, la cuarta pieza es el botón rotuliano que se integra para cumplir un efecto más estético que funcional. El Polietileno (PE) y más concretamente el Polietileno de peso molecular ultra alto (UHMWPE) se ha utilizado en artroplastia total de rodilla durante más de 50 años, debido a las buenas propiedades mecánicas y comportamiento bien tolerado, especialmente fricción y desgaste. Precisamente el desgaste, el aflojamiento, la inestabilidad y la infección del PE son las principales razones para revisiones de la artroplastia total de rodilla (ATR) según (Sharkey; et al., 2002) aunque la referencia (Schroer et al., 2013) demuestra lo contrario y concluye que el 50% de las revisiones vienen provocadas por una inestabilidad o por una infección. El desgaste de PE está directamente relacionado con tamaño de las áreas de contacto y la magnitud del contacto (Brien et al., 2015) . El desgaste de PE produce partículas de desgaste alrededor el implante de rodilla, que puede provocar osteólisis y el largo plazo puede rovocar el aflojamiento del implante (Khosravipour et al., 2018) . Las claves que se persiguen en cualquier nueva propuesta de prótesis deben ser: integración en el hueso sin incompatibilidad bioquímica y, longevidad que evite posteriores revisiones. El proceso de fabricación de las actuales prótesis metálicas se realiza por procesos de mecanizado por arranque de viruta y, es durante el tratamiento de la superficie donde mayor probabilidad se den alteraciones. Son varios los estudios que han analizado la superficie de las prótesis en busca de contaminantes químicos y/o físicos. Lo más habitual es encontrar residuos del granallado en la superficie, como son partículas de aluminio. Esta contaminación puede afectar gravemente a los procesos biológicos desencadenando reacciones contrarias o de cuerpo extraño que conllevarían a la inflamación de los tejidos e incluso la pérdida de la prótesis. De hecho, no sólo afecta que exista una partícula de un determinado tamaño en el comportamiento celular, si no su composición química. En la patente [US 2010/0161067A1], se contempla la introducción de cámara posterior en la pieza femoral, que proporciona control sobre el movimiento de la pieza femoral, lo que evita movimiento innecesario que llevaría al desgaste. Esta posee ciertas desventajas como incluir impacto entre la cámara y el poste de la pieza tibial, lo que produce un aumento en el desgaste y posibles deformaciones. Este efecto es incrementado en los casos en los que ocurre rotación interna o externa. Además, las traslaciones anteriores-posteriores se oponen a la tendencia natural del fémur de situarse en la zona más profunda del plato tibial. En la patente [WO 00/23011], el concepto novedoso introducido es el cambio gradual del perfil frontal del cóndilo femoral en las superficies de contacto con el plato tibial, cuya superficie cambiaría de manera similar. El resultado alcanzado será encontrar las posiciones con menor energía potencial, en cada ángulo de flexión. Estos puntos de contacto en ambos cóndilos son simétricos. Las patentes [EP2774582A1], [WO2004012633A1], [US2011184525A1], [US2012083894A1] [US2016242917A1] [WO2016046654A1] [WO2016071938A1], son similares modelos geométricos de 3 o más piezas fijadas entre ellas con limitada capacidad de giro y cuyo rozamiento agresivo provocan desprendimientos continuos de partículas metálicas y dispuestas para rellenar con cemento óseo. Las patentes [WO2013156743A1], [WO2015048273A1], sólo aportan soluciones para prótesis de sustitución temporal o de reemplazo. La patente [EP0294298A], difiere con respecto a la presente propuesta en que, no se incluyen unos pinchos adicionales a la quilla o ala delta en el componente tibial, el tipo de perforación practicado en el interior del fémur no s cilíndrico, y no se emplea una resina termoplástica como el PEI para la fabricación de la prótesis. Las patentes [US2020138584A1], [WO2012018567A1] únicamente aportan una pieza tibial con dudosa capacidad de fijación al hueso y de implantación según técnica quirúrgica. De manera similar, la patente [WO2008054389A1] sólo aporta una pieza femoral que no se especifica la forma quirúrgica de su implantación. La patente [GB2067412A] también divulga una prótesis mecánica para ATR, que incluye una pieza femoral y una pieza tibial. Las diferencias con la presente propuesta son que el material de fabricación no es PEI, las piezas no se obtienen mediante impresión 3D, y la prótesis no incluye unos pinchos para su fijación en la tibia y fémur. La patente [US5116375A] hace referencia a una prótesis de rodilla que incluye una pieza femoral que se incrusta en la zona baja del fémur, y una pieza tibial que se incrusta en la parte superior de la tibia. Ambas piezas están formadas por un material biocompatible. Las principales diferencias con respecto a la presente propuesta se basan en que, pese a indicar que el material de la prótesis es biocompatible, se utilizan materiales metálicos y, en ningún caso, una resina termoplástica como el PEI o el polieteretercetona (PEEK) . Además, no se hace referencia a que el sistema de fabricación sea mediante impresión 3D Más recientemente, la patente [EP2744452A1] hace referencia a una componente tibial de prueba, fabricada en una única pieza de un material plástico, entre los que se nombra el PEI. No se trata, por tanto, de una prótesis completa para la rodilla, ni de larga duración, no se divulga la forma de la pieza femoral. Tampoco se especifica cómo se va a fabricar la pieza mediante impresión 3D con PEI. La patente [CN107822746A], trata de una prótesis de articulación de rodilla con estructura de hueso trabecular que incluye un soporte para la tibia y una almohadilla para la espinilla. Dispone de más de 2 componentes y parece que su fabricación es íntegramente en material PEEK, mediante la técnica de modelado de deposición fundida (FDM) , sin embargo, en otro párrafo se expresa el uso de este material en polvo, imposible de usar en las actuales técnicas FDM. No se han encontrado filamentos para impresión 3D de este tipo de material en ese año 2017, ni siquiera en la actualidad existe filamento de PEEK puro, sí es posible encontrarlos, con aditivo de fibra de carbono. Tampoco se especifica qué tipo de material PEEK se usa y con qué características bioquímicas. Se desconoce el origen del PEEK, si es de fabricación propia o de alguna marca o fabricante conocido. Con todo lo anterior, resulta difícil exponer diferencias claras sobre la presente propuesta, ni siquiera, basándose en el único gráfico incluido en el documento. La patente [CN112190757A], trata de una prótesis de rodilla tumoral, orientada específicamente a la sustitución funcional del tumor, ese aspecto ya la aleja de la presente propuesta, orientada a ese tipo de defecto óseo (oncología ósea) , cuya geometría es notablemente diferente. La prótesis consta también de dos componentes: uno tibial y otro femoral fabricadas con material PEEK-CRF (Fibra de carbono) , aunque, se destaca la presencia de juntas fabricadas en PE y, la meseta tibial, en aleación de Cr-Co-Mo. No se especifica claramente el modo de fabricación de las piezas que forman la prótesis tumoral que, en ningún caso, usa la fabricación aditiva. La patente [CN105748176A] describe una prótesis para ATR, que incluye una pieza femoral y una pieza tibial fabricadas con PEEK, con buena biocompatibilidad. Las principales diferencias con respecto a la presente propuesta consisten en que no se utiliza PEI sino PEEK para la fabricación de la prótesis y no se menciona que la fabricación sea mediante impresión 3D. Tampoco se incluyen unos pinchos en el componente tibial, solamente una quilla. La patente [US2015335449A1] divulga un sistema de prueba para el remplazo de la rodilla que, aunque está compuesto por tres piezas, el inserto tibial está hecho de materiales biocompatibles, entre los que se incluye el PEI. Sin embargo, no se indica el método de fabricación, ni que las demás piezas puedan realizarse también en PEI. La patente [WO2021094382A1] hace referencia a una prótesis de rodilla, que incluye un componente tibial y otro femoral, que incluye una capa articulada de PEI, también se indica que el proceso puede llevarse a cabo por moldeo por inyección. Dicho documento también se centra en realizar un estudio de los diferentes polímeros adecuados para constituir la capa articulada y la combinación entre ellos. Sin embargo, existen varias diferencias con respecto a la presente propuesta como, por ejemplo, que el componente tibial está formado a su vez, por dos piezas, y que el PEI no se emplea en la fabricación del núcleo de estas. La patente [GB2547907A] describe una prótesis de rodilla, en particular, una pieza femoral y el método de fabricación de dicha pieza femoral. Dicha pieza incluye unos pinchos para su fijación al fémur, un botón rotuliano, y está fabricada íntegramente por moldeo por inyección, con PEEK de materia, y se indica el ejemplo de la marca PEEK-OPTIMA de la empresa Invibio Limited. Las diferencias con la presente propuesta son que el componente tibial, que no es el objetivo principal del documento [GB2547907A], se fabricaría con UHMWPE por ser más blando que el PEEK. No se utiliza, por tanto, para ninguna de las dos piezas el PEI, y no incluyen los pinchos para fijar a la tibia en la pieza tibial. Sin embargo, la bibliografía consultada no reporta casos de prótesis no metálicas en los cuales se demuestre que la inserción de la pieza tibial al hueso trabecular se realizará in ayuda de cemento óseo ni sin riesgo de sufrir aflojamientos posteriores. Tampoco, se han encontrado piezas cuyo desgaste continuo no genere contaminación de partículas de dudosa respuesta inmunitaria. Por último, tampoco se han encontrado registros donde se determine el nivel de citotoxicidad del material implantado ni el nivel de penetración y fijación al hueso de piezas no metálicas que favorezca la integración implante-hueso. El único material no metálico usado en anteriores patentes es el PEEK o compuestos de PEEK-CRF, los cuales, no han sido probados de manera concluyente su bioactividad o sus buenas prestaciones osteoinductivas o de reacción inmunológica. La referencia (Hooper et al., 2019) , es el único registro que haya usado el material ULTEMTM1010 biocompatible en la fabricación aditiva de piezas protésicas, la diferencia principal con la presente propuesta consiste en que, el estudio referenciado solo hace referencia al uso de ULTEM 1010 para la fabricación de herramientas que intervienen en una ATR y no en la prótesis en sí. Además, se indica que dichos instrumentos son de un solo uso. No obstante, en las referencias (Miguel Suffo, 2020) , (M. Suffo et al., 2020) , ya se tienen antecedentes de sus buenas prestaciones en el campo biomédico. Como conclusión, se podría considerar como el estado de la técnica más cercano, la patente [US5116375A], aunque no divulga unos cajeados en cada cóndilo para su fijación al útil empleado en la inserción, ni un botón rotuliano, ni que las perforaciones que se realicen en el fémur y en la tibia sean cilíndricas o en ala delta. No obstante, que la prótesis esté fabricada en polieterimida (PEI) no está divulgado en la patente [US5116375A]. El efecto técnico que se produce por emplear PEI en vez de materiales metálicos para la fabricación de la prótesis es, evitar el desgaste que se produce con dichos materiales. El problema técnico objetivo que se resuelve es cómo reducir el rechazo y aumentar la biocompatibilidad de las prótesis en aquella población que es sensible a los metales. Otra patente que se considera igualmente cercano al estado de la técnica es [CN105748176A] pero, las principales diferencias se basan en que la pieza tibial no incluye pinchos (solo la quilla) y que el material empleado es PEEK. Esta última, se considera la diferencia esencial. El empleo del PEEK es más común en el estado de la técnica para prótesis no metálicas pero el PEI (ULTEM 1010) tiene mejores propiedades de bioactividad. Referencias bibliográficas empleadas. Bourne, R. B., Chesworth, B. M., Davis, A. M., Mahomed, N. N., Charron, K. D. J., & Met, D. (2010) . Patient Satisfaction after Total Knee Arthroplasty Who is Satisfied and Who is Not ? 57-63. https://doi.org/10.1007/s11999-009-1119-9 Brien, S. T. O., Luo, Y., & Brandt, J. (2015) . In-vitro andin-silico investigations on the in fl uence of contact pressure on cross-linked polyethylene wear in total knee replacements. 333, 687-693. https://doi.org/10.1016Zj.wear.2015.02.048 Fitzpatrick, C. K., Clar y , C. W., & Rullkoetter, P. J. (2012) . The role of patient, surgical, and implant design variation in total knee replacement performance. Journal of Biomechanics, 45 (12) , 2092-2102. https://doi.org/10.1016/jjbiomech.2012.05.035 Hooper, J., Schwarzkopf, R., Fernandez, E., Buckland, A., Werner, J., Einhorn, T., & Walker, P. S. (2019) . Feasibility of single-use 3D-printed instruments for total knee arthroplasty. The Bone & Joint Journal, 101-B (7_Supple_C) , 115-120. https://doi.org/10.1302/0301-620X.101B7.BJJ-2018-1506.R1 Keegan, G. M., Learmonth, I. D., & Case, C. P. (2007) . Orthopaedic metals and their potential toxicity in the arthroplasty patient. A review of current knowledge and future strategies. Journal of Bone and Joint Surger y - Series B, 89 (5) , 567-573. https://doi.org/10.1302/0301-620X.89B5.18903 Khosravipour, I., Pejhan, S., Luo, Y., & Wyss, U. P. (2018) . Customized surface-guided knee implant: Contact analysis and experimental test. 232 (1) , 90-100. https://doi.org/10.1177/0954411917744586 Schroer, W. C., Berend, K. R., Lombardi, A. V, Barnes, C. L., Bolognesi, M. P., Berend, M. E., Ritter, M. A., & Nunley, R. M. (2013) . Why Are Total Knees Failing Today? Etiology of Total Knee Revision in 2010 and 2011. Journal of Arthroplasty, 28 (8) , 116-119. https://doi.org/10.1016/j.arth.2013.04.056 Sharkey;, P. F., Shastri;, R. H. R. S., & and Sidney M. Jacoby, B. (2002) . Why Are Total Knee Arthroplasties Failing Today? CLINICAL ORTHOPAEDICS AND RELATED RESEARCH, 404, 7-13. https://doi.org/10.1097/01.blo.0000036002.13841.32 Siqueira, W. L., Custodio, W., & McDonald, E. E. (2012) . New insights into the composition and functions of the acquired enamel pellicle. Journal of Dental Research, 91 (12) , 1110-1118. https://doi.org/10.1177/0022034512462578 Subramani, K., Jung, R. E., Molenberg, A., & Hammerle, C. H. F. (2009) . Biofilm on dental implants: a review of the literature. The International Journal of Oral & Maxillofacial Implants, 24 (4) , 616-626. https://doi.org/10.5167/uzh-26110 Suffo, M., Vilches-Pérez, J. I., & Salido-Peracaula, M. (2020) . Comparative Analysis of the Adhesion of Metallic Inserts on Dental Implants-Prosthetic Assembly Generated by Polymeric Materials Used for Additive Manufacturing. In Lecture Notes in Mechanical Engineering (Vol. 1, pp. 245-253) . https://doi.org/10.1007/978-3-030-41200-5_27 Suffo, Miguel. (2020) . Determination of Adhesive to Be Applied in the Fabrication of Prototypes Using FDM Techniques of 3D Printing in Component Parts Using ULTEM ™ 1010 (pp. 959-969) . Wood, N. J., Jenkinson, H. F., Davis, S. A., Mann, S., OSullivan, D. J., & Barbour, M. E. (2015) . Chlorhexidine hexametaphosphate nanoparticles as a novel antimicrobial coating for dental implants. Journal of Materials Science: Materials in Medicine, 26 (6) , 1-10. https://doi.org/10.1007/s10856-015-5532-1 Zhang, J. Y., Wang, J., Tian, D. M., Jiang, D. P., Li, J. J., & Hu, Y. C. (2020) . Spherical center and rotating platform hinged knee prosthesis: Finite-element model establishment, verification and contact analysis. Knee, 27 (3) , 731-739. https://doi.org/10.1016Zj.knee.2020.04.022 EXPLICACIÓN DE LA INVENCIÓN La invención consiste un conjunto protésico formado, fundamentalmente, por dos piezas no metálicas, una pieza femoral y una pieza tibial, ambas fabricadas en material biocompatible, y más concretamente en PEI. Se añade una tercera pieza, también en PEI, sin relevancia en la cinemática del conjunto pero que sí influye en la estética. La invención propone una reducción de piezas al conjunto protésico convencional. Su geometría está basada en un modelo comercial descrito por el fabricante Str y ker® Orthopaedics, en particular, su modelo Triathlon® Knee System. La pieza femoral apoya sus cóndilos sobre la pieza tibial y cuenta con unos pinchos en su parte superior, con objeto de que estos sean introducidos en unas perforaciones cilíndricas que habrán de ser realizadas en las paredes planas adaptadas del fémur del paciente. Estos cóndilos presentan unos cajeados en sus extremos, para permitir su correcta fijación al útil que se usará en la inserción de la pieza en el hueso. La pieza tibial que está diseñada en forma de silla de montar, con amplia superficie de contacto para permitir los ángulos de giro anatómicos en los tres planos principales. La ieza tibial cuenta con unos pinchos en su parte inferior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas de la tibia del paciente. La pieza tibial cuenta además con unos refuerzos antirretorno en forma de triángulos, capaces de conseguir una fijación completa al hueso sin necesidad de cementación. Adicionalmente, la pieza tibial cuenta con una quilla en forma de ala delta, que igualmente habrá de ser insertada en la tibia del paciente. Esta invención propone una alternativa no metálica, biocompatible, osteoinductora y de fijación asegurada sin problemas de desprendimientos contaminantes en toda su vida útil. El material propuesto para la construcción de los componentes de este conjunto protésico es una polieteramida (PEI) , mediante cuyo empleo se pretende cubrir la necesidad de este tipo de prótesis de un sector de la población que rechaza las prótesis metálicas, debido a su especial alergia a los metales. Concretamente, en la invención se propone el empleo de un tipo de PEI, comercialmente denominado ULTEM™ 1010, un termoplástico biocompatible certificado por el fabricante (Sabic) , al que se ha sometido a ensayos de citotoxicidad y lead/death, y que posee un módulo elástico de 2, 86GPa, muy próximo al del hueso cortical. Debido a la alta elasticidad del material PEI usado, el conjunto se adapta al movimiento anatómico sin lesiones para el paciente y, al ser de bajo peso, la movilidad de este no se resiente. Adicionalmente, las buenas propiedades térmicas del PEI, permiten que no se produzca la abrasión de las zonas en contacto y el acabado superficial de estas zonas en contacto admiten un pulido que garantiza el deslizamiento con un rozamiento admisible. En cualquier caso, dado que no se usa material contaminante, los posibles desprendimientos motivados por los giros en diferentes planos no contaminan los tejidos ni producen pérdida de hueso. Por estas razones, las piezas que forman el conjunto protésico objeto de la invención, evitan los principales problemas que surgen con las prótesis basadas en materiales metálicos como el acero inoxidable, aleaciones de titanio o de Cr-Co-Ni/Mo, las cuales, o garantizan la formación de hueso y provocan problemas en la proximidad de la cirugía y, sobre todo, los fenómenos de corrosión. Adicionalmente, las prótesis metálicas que actualmente son usadas en traumatología, tanto en humano como en animal, en general, lo único que usan como barrera protectora del material metálico es cemento óseo. Con la invención propuesta, se elimina la necesidad de emplear cemento óseo, ni como barrera protectora del material metálico, ni para la fijación de sus piezas. El método de fabricación preferente de las piezas protésicas dependerá de la solución que se requiera, para piezas personalizadas se usará la técnica Fused Deposition Modeling (FDM) en impresión 3D. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Muestra la configuración geométrica de las partes de la prótesis y su inserción en huesos. En ella se representan: 1.- Fémur. 2.- Tibia. 3.- Pieza femoral. 4.- Pieza tibial. 5.- Botón rotuliano. 6.- Pinchos de la pieza femoral. 7.- Pinchos de la pieza tibial. 8.- Refuerzos antirretorno de la pieza tibial. 9.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas del fémur. 10.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas de la tibia para la inserción de la quilla tibial de la prótesis. 11.- Perforación en forma de ala delta practicada en la tibia. 12.- Quilla tibial. 13.- Cóndilos. 14.- Cajeados Figura 2. Muestra los resultados obtenidos en el ensayo de viabilidad celular. REALIZACIÓN PREFERENTE DE LA INVENCIÓN La realización preferente de la invención se describe en detalle a continuación con referencia a la figura 1. A partir de los modelos 3D obtenidos, tomando como referencias las 3 partes de la prótesis metálica Triathlon® Knee System, se propone una alternativa compuesta únicamente por dos partes no metálicas, una pieza femoral y una pieza tibial, formada por la fusión de la pieza tibial con el inserto de PE, siendo ambas piezas fabricadas en PE. Partiendo de modelos 3D de huesos femoral (1) y tibial (2) , se sitúan los modelos 3D correspondientes a las piezas protésicas femoral (3) y tibial (4) , diseñadas a partir de las piezas cedidas por el fabricante Str y ker. El botón rotuliano (5) , que también forma parte del objeto de la invención, sólo tiene una función estética en el conjunto, no tiene relevancia en la funcionalidad de la prótesis y se fabrica en el mismo material que las demás piezas. Para la fijación de las piezas femoral (3) y tibial (4) en los huesos, se modelan pinchos (6) en la pieza femoral (3) , y (7) en la pieza tibial (4) . Adicionalmente, se disponen unos refuerzos antirretorno en forma de triángulos (8) , lo cuales, garantizarán una correcta fijación de la pieza (4) en todo su volumen y evitan la micromovilidad. Para comprobar la geometría y tamaño de los pinchos, se realizan perforaciones cilíndricas (9) y (10) , en las paredes planas de las piezas que representa el hueso femoral (1) y la tibia (2) . Por último, en la pieza que simula la tibia (2) , se practica una perforación en forma de ala delta (11) , la cual, permite la correcta inserción de la quilla tibial (12) . Las curvaturas dispuestas en los cóndilos (13) de la pieza femoral (3) , se adaptan a la parte superior (bandeja tibial) , de la pieza tibial (4) y su encaje es perfecto para permitir su rotación y deslizamiento, el cual, mantendrá siempre el contacto en todos los ángulos de flexión. Se disponen cajeados (14) en los extremos de cada cóndilo (13) para permitir su correcta fijación al útil con el cual se usará en la inserción de la pieza en el hueso. Las piezas femoral (3) y tibial (4) modeladas en 3D por la herramienta CAD, se exportaron para su fabricaron aditiva en FDM con filamento ULTEM™ 1010 biocompatible y adaptada a la impresora Fortus 450MC. Para este trabajo, se usó una boquilla tipo T 14 (0.254 mm) ; para el material de soporte se usó un tipo de boquilla T 16 (0.254 mm) . A la finalización de la impresión, se pulen las superficies hasta alcanzar la rugosidad requerida. El conjunto protésico modelado en 3D se exportó a la herramienta de simulación FEM (ANSYS/Academic Research de ANSYS Inc., Houston, PA, USA) , donde se analizaron en base a la norma ISO 14243-3:2009, la cual sugiere tener en cuenta las distribuciones de cargas para diferentes ángulos de flexión: 0°, 30°, 60°, 90° y, 120°. Para cada ángulo se llevó a cabo un análisis estático estructural considerando un contacto tipo rugoso entre las dos piezas aplicando un coeficiente de fricción de 0, 04. Se simuló una carga axial de 2000N, aplicada a la parte superior de la superficie de la pieza tibial, donde se encuentra el contacto entre los cóndilos femorales y la bandeja tibial. Para comprobar la bioactividad del material, se realizan varios ensayos sobre materiales no metálicos. En la tabla 1, se recogen las descripciones de los materiales usados en el ensayo. Tabla 1. Datos de materiales y fabricantes usados en el ensayo de viabilidad celular. Se aplican cultivos de células primarias osteoblasticas humanas (COPH, células adquiridas a la empresa PROMOCELL como HOB®) . Para dicho estudio de viabilidad celular, COPH se cultivaron en medios osteogénicos y se realizaron ensayos de viabilidad/citotoxicidad a 7 días. En este ensayo, denominado LIVE/DEAD, las células muertas se marcan con EthD-1 y las vivas con Cal-ceína AM. Como control negativo, ntes del proceso de mareaje, se incubaron cultivos de COPH con metanol al 70% durante 30 minutos. Como control positivo se usaron cultivos de COPH sin ningún tratamiento. En primer lugar, se eliminó el medio de cultivo, posteriormente se lavaron con PBS y finalmente se añadió la solución de marcaje. Después de una incubación de 30 minutos a temperatura ambiente, se observaron bajo microscopía de fluorescencia. Para el análisis de la intensidad de las distintas fluorescencias se usó el software ImageJ, realizándose para su representación la relación entre ambos marcadores. Según los resultados obtenidos y presentados en la figura 2, todos los materiales estudiados no interfieren en el crecimiento y viabilidad celular de osteoblastos humanos, siendo materiales óptimos para futuros ensayos de bioactividad en cultivos con osteoblastos humanos. Esta conclusión se apoya en la comparación entre el control positivo y los distintos cultivos para cada material. En detalle, se observa que el material ULTEMtm1010 tiene un interesante efecto positivo en la viabilidad celular de las COPH cuando comparamos este tratamiento con los controles positivos, destacando con una ratio por encima de 6. APLICACIÓN INDUSTRIAL El conjunto protésico no metálicos objeto de la invención proporciona una alternativa válida a pacientes sensibles a metales. En particular, la prótesis completa de rodilla descrita ofrece una solución a los fabricantes de marcas comerciales de este tipo de productos, los cuales, no ofertan debido a su escasa producción y logística. El modelo descrito es compatible con el fabricante Str y ker con ligeras diferencias que la hacen más fácil de implantar ya que sólo presenta dos piezas: una femoral y otra tibial. Al basarse en un material certificado para su uso médico facilita su garantía de seguridad y, se ha complementado con un estudio de viabilidad celular para garantizar que no sólo exista pérdida ósea, sino que pueda generarse hueso a su alrededor.
Publicaciones:
ES2936558 (17/03/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
ES2936558 (18/09/2023) - B2 Patente de invención con examen
Eventos:
En fecha 17/09/2021 se realizó Registro Instancia de Solicitud
En fecha 17/09/2021 se realizó Admisión a Trámite
En fecha 17/09/2021 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 20/09/2021 se realizó Superado examen de oficio
En fecha 14/07/2022 se realizó Realizado IET
En fecha 18/07/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 19/09/2022 se realizó PETEX_Petición de examen sustantivo
En fecha 17/03/2023 se realizó Publicación Solicitud
En fecha 17/03/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 03/07/2023 se realizó Validación petición y/o pago de examen sustantivo conforme
En fecha 04/09/2023 se realizó Designación de Comisión de Expertos
En fecha 04/09/2023 se realizó Finalización de Examen Sustantivo
En fecha 04/09/2023 se realizó 6121P_Comunicación finalización de examen sustantivo
En fecha 08/09/2023 se realizó Publicación finalización de examen sustantivo
En fecha 11/09/2023 se realizó Concesión con examen sustantivo
En fecha 11/09/2023 se realizó Entrega título
En fecha 11/09/2023 se realizó 6125P_Notificación de concesión con examen sustantivo
En fecha 18/09/2023 se realizó Publicación concesión Patente
En fecha 18/09/2023 se realizó Publicación Folleto Concesión
En fecha 18/03/2024 se realizó Plazo expirado presentación de oposiciones contra la concesión de la Patente
Pagos:
17/09/2021 - Pago Tasas IET
03/10/2023 - Pago 03 Anualidad
+ ES-2936558_A11. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , caracterizada por que se compone fundamentalmente de dos piezas, una pieza femoral (3) y una pieza tibial (4) , a las que se añade un botón rotuliano (5) cuya función es meramente estética, todas ellas diseñadas y fabricadas mediante técnicas de impresión 3D y fabricadas íntegramente en polieterimida (PEI) , en las que: - la pieza femoral (3) cuenta con: - unos pinchos (6) en su parte superior, para su introducción en las perforaciones cilíndricas (9) que habrán de ser realizadas en las paredes planas adaptadas del fémur (1) , - unos cóndilos (13) que se adaptan a la parte superior de la pieza tibial (4) , los cuales presentan unos cajeados (14) en sus extremos, que permiten su correcta fijación al útil con el cual se realice la inserción de la pieza femoral (3) en el fémur (1) . - una pieza tibial (4) cuenta en su parte inferior con: - unos pinchos (7) , para su introducción en las perforaciones cilíndricas (10) , que habrán de ser realizadas en las paredes planas adaptadas de la tibia (2) , - unos refuerzos antirretorno (8) en forma de triángulos, que garantizan una correcta fijación de la pieza tibial (4) en todo su volumen, - una quilla tibial (12) en forma de ala delta, que se inserta en la tibia (2) por medio de una perforación (11) practicada en la tibia (2) , 2. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, donde el PEI es ULTEM™ 1010. 3. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, caracterizada por que se fabrica mediante impresión 3D por medio de la técnica de FDM. 4. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicaciones anteriores, en cualquier individuo humano o animal. 5. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicaciones anteriores, para individuos sensibles a metales.
+ ES-2936558_B21. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , caracterizada por que se compone fundamentalmente de dos piezas, una pieza femoral (3) y una pieza tibial (4) , a las que se añade un botón rotuliano (5) cuya función es meramente estética, todas ellas diseñadas y fabricadas mediante técnicas de impresión 3D y fabricadas íntegramente en polieterimida (PEI) , en las que: - la pieza femoral (3) cuenta con: - unos pinchos (6) en su parte superior, para su introducción en las perforaciones cilíndricas (9) que habrán de ser realizadas en las paredes planas adaptadas del fémur (1) , - unos cóndilos (13) que se adaptan a la parte superior de la pieza tibial (4) , los cuales presentan unos cajeados (14) en sus extremos, que permiten su correcta fijación al útil con el cual se realice la inserción de la pieza femoral (3) en el fémur (1) . - una pieza tibial (4) cuenta en su parte inferior con: - unos pinchos (7) , para su introducción en las perforaciones cilíndricas (10) , que habrán de ser realizadas en las paredes planas adaptadas de la tibia (2) , - unos refuerzos antirretorno (8) en forma de triángulos, que garantizan una correcta fijación de la pieza tibial (4) en todo su volumen, - una quilla tibial (12) en forma de ala delta, que se inserta en la tibia (2) por medio de una perforación en forma de ala delta (11) practicada en la tibia (2) para la inserción de la quilla tibial. 2. Prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, caracterizada por que se fabrica mediante impresión 3D por medio de la técnica de modelado de deposición fundida (FDM) . 3. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, en cualquier individuo humano o animal. 4. Uso de la prótesis mecánica de rodilla biocompatible para artroplastia total de rodilla (ATR) , según reivindicación 1, para individuos sensibles a metales.
Los productos y servicios protegidos por este registro son:
A61F 2/38
Descripciones:
+ ES-2936558_A1 PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) CAMPO TÉCNICO La presente invención pertenece al campo de la biomecánica. El objeto técnico consiste en un conjunto protésico formado por, fundamentalmente, dos piezas (una pieza femoral y una pieza tibial) , y un botón rotuliano, para Artroplastia Total de Rodilla (ATR) , fabricadas íntegramente en polieterimida (PEI) . ANTECEDENTES DE LA INVENCIÓN Cualquier cuerpo extraño en el organismo favorece el desarrollo de infecciones y, por consiguiente, un rechazo del mismo (Wood et al., 2015) . Particularmente, este fenómeno es frecuente en los implantes dentales, que se recubren por la saliva cuyas glucoproteínas favorecen la colonización por microorganismos (sobre todo, estreptococos) , los cuales proliferan en la cavidad oral (Siqueira et al., 2012) ; (Subramani et al., 2009) . De manera similar ocurre con las prótesis en traumatología (por ejemplo: en la artroplastia total de rodilla ATR, o cadera ATC) , cuyos materiales usados han sido a base de aceros inoxidables, aleaciones de titanio, aleaciones de Cr-Co-Ni y otros metales peligrosos para el ser humano (Keegan et al., 2007) . En este caso, el problema surge por falta de biocompatibidad demostrada a medio o largo plazo. En estas piezas se busca un aumento de su vida útil, facilitar su integración en el hueso mediante la incorporación de un material cementado a las superficies implantables, que sirva de barrera osteoinductiva real y proteja de infecciones. A pesar de conseguir un alto índice de éxito en estas intervenciones aún existe un 19% de pacientes que muestran disconformidades con las intervenciones a las que se han visto sometidas y han provocado una revisión (Bourne et al., 2010) . Según Khosravipur 2017, para reducir la revisión de estas intervenciones y dotarlas de más longevidad, habría que influir principalmente en la cinemática articular, el cual depende a su vez del diseño del implante y la biomecánica. (Fitzpatrick et al., 2012) , añade la combinación ntre el diseño y la técnica quirúrgica que exija el diseño del implante como factor decisorio. Los diseños más recientes van encaminados a personalizar las prótesis al paciente y, para ello, la fabricación aditiva (FA) brinda una oportunidad de mejora para diseñar prótesis a medida muy útil para superar este hito. Algunos materiales con los que es posible obtener prototipos en FA son biocompatibles y ofrecen unas prestaciones mecánicas idóneas para sustituir a los actuales materiales basados en aleaciones metálicas de Cr-Co-Mo (Vitalium) o titanio. Las piezas personalizadas obtenidas mediante FA resultan más baratas que ninguna otra técnica de fabricación actualmente aplicable. No obstante, para una producción seriada cubriendo las diferentes tallas anatómicas existentes en las piezas protésicas disponibles comercialmente, la FA no sería la solución más adecuada. Para este fin, es más aconsejable probar la tecnología de inyección en moldes, la cual permite fabricar piezas seriadas con máxima calidad y sin generar ningún residuo. Sin embargo, no es solo suficiente que un material sea biocompatible, adicionalmente, se deben superar ensayos bioquímicos de citotoxicidad y osteoinducción. Por último, con carácter previo a su fabricación, los modelos geométricos diseñados deben superar como mínimo, simulaciones numéricas basadas en análisis estructurales para confirmar un rendimiento similar a las actuales basadas en materiales metálicos. En la actualidad, la tipología de prótesis de deslizamiento es la que está siendo usada con mayor profusión en el mundo frente a las de bisagra, como la registrada en la patente [ES2429390B1], más adecuada para casos más severos de reemplazos (Zhang et al., 2020) . Las prótesis de deslizamiento se componen de 4 partes aunque son únicamente 3 las que influyen en la estabilidad y comportamiento biomecánico del conjunto, la cuarta pieza es el botón rotuliano que se integra para cumplir un efecto más estético que funcional. El Polietileno (PE) y más concretamente el Polietileno de peso molecular ultra alto (UHMWPE) se ha utilizado en artroplastia total de rodilla durante más de 50 años, debido a las buenas propiedades mecánicas y comportamiento bien tolerado, especialmente fricción y desgaste. Precisamente el desgaste, el aflojamiento, la inestabilidad y la infección del PE son las principales razones para revisiones de la artroplastia total de rodilla (ATR) según (Sharkey; et al., 2002) aunque la referencia (Schroer et al., 2013) demuestra lo contrario y concluye que el 50% de las revisiones vienen provocadas por una inestabilidad o por una infección. El desgaste de PE está directamente relacionado con tamaño de las áreas de contacto y la magnitud del contacto (Brien et al., 2015) . El desgaste de PE produce partículas de desgaste alrededor el implante de rodilla, que puede provocar osteólisis y el largo plazo puede rovocar el aflojamiento del implante (Khosravipour et al., 2018) . Las claves que se persiguen en cualquier nueva propuesta de prótesis deben ser: integración en el hueso sin incompatibilidad bioquímica y, longevidad que evite posteriores revisiones. El proceso de fabricación de las actuales prótesis metálicas se realiza por procesos de mecanizado por arranque de viruta y, es durante el tratamiento de la superficie donde mayor probabilidad se den alteraciones. Son varios los estudios que han analizado la superficie de las prótesis en busca de contaminantes químicos y/o físicos. Lo más habitual es encontrar residuos del granallado en la superficie, como son partículas de aluminio. Esta contaminación puede afectar gravemente a los procesos biológicos desencadenando reacciones contrarias o de cuerpo extraño que conllevarían a la inflamación de los tejidos e incluso la pérdida de la prótesis. De hecho, no sólo afecta que exista una partícula de un determinado tamaño en el comportamiento celular, si no su composición química. En la patente [US 2010/0161067A1], se contempla la introducción de cámara posterior en la pieza femoral, que proporciona control sobre el movimiento de la pieza femoral, lo que evita movimiento innecesario que llevaría al desgaste. Esta posee ciertas desventajas como incluir impacto entre la cámara y el poste de la pieza tibial, lo que produce un aumento en el desgaste y posibles deformaciones. Este efecto es incrementado en los casos en los que ocurre rotación interna o externa. Además, las traslaciones anteriores-posteriores se oponen a la tendencia natural del fémur de situarse en la zona más profunda del plato tibial. En la patente [WO 00/23011], el concepto novedoso introducido es el cambio gradual del perfil frontal del cóndilo femoral en las superficies de contacto con el plato tibial, cuya superficie cambiaría de manera similar. El resultado alcanzado será encontrar las posiciones con menor energía potencial, en cada ángulo de flexión. Estos puntos de contacto en ambos cóndilos son simétricos. Las patentes [EP2774582A1], [WO2004012633A1], [US2011184525A1], [US2012083894A1] [US2016242917A1] [WO2016046654A1] [WO2016071938A1], son similares modelos geométricos de 3 o más piezas fijadas entre ellas con limitada capacidad de giro y cuyo rozamiento agresivo provocan desprendimientos continuos de partículas metálicas y dispuestas para rellenar con cemento óseo. Las patentes [WO2013156743A1], [WO2015048273A1], sólo aportan soluciones para prótesis de sustitución temporal o de reemplazo. La patente [EP0294298A], difiere con respecto a la presente propuesta en que, no se incluyen unos pinchos adicionales a la quilla en el omponente tibial, el tipo de perforación en el fémur no es cilindrico, y no se emplea una resina termoplástica como el PEI para la fabricación de la prótesis. Las patentes [US2020138584A1], [WO2012018567A1] únicamente aportan una pieza tibial con dudosa capacidad de fijación al hueso y de implantación según técnica quirúrgica. De manera similar, la patente [WO2008054389A1] sólo aporta una pieza femoral que no se especifica la forma quirúrgica de su implantación. La patente [GB2067412A] también divulga una prótesis mecánica para ATR, que incluye una pieza femoral y una pieza tibial. Las diferencias con la presente propuesta son que el material de fabricación no es PEI, las piezas no se obtienen mediante impresión 3D, y la prótesis no incluye unos pinchos para su fijación en la tibia y fémur. La patente [US5116375A] hace referencia a una prótesis de rodilla que incluye una pieza femoral que se incrusta en la zona baja del fémur, y una pieza tibial que se incrusta en la parte superior de la tibia. Ambas piezas están formadas por un material biocompatible. Las principales diferencias con respecto a la presente propuesta se basan en que, pese a indicar que el material de la prótesis es biocompatible, se utilizan materiales metálicos y, en ningún caso, una resina termoplástica como el PEI o el polieteretercetona (PEEK) . Además, no se hace referencia a que el sistema de fabricación sea mediante impresión 3D Más recientemente, la patente [EP2744452A1] hace referencia a una componente tibial de prueba, fabricada en una única pieza de un material plástico, entre los que se nombra el PEI. No se trata, por tanto, de una prótesis completa para la rodilla, ni de larga duración, no se divulga la forma de la pieza femoral. Tampoco se especifica cómo se va a fabricar la pieza mediante impresión 3D con PEI. La patente [CN107822746A], trata de una prótesis de articulación de rodilla con estructura de hueso trabecular que incluye un soporte para la tibia y una almohadilla para la espinilla. Dispone de más de 2 componentes y parece que su fabricación es íntegramente en material PEEK, mediante la técnica de modelado de deposición fundida (FDM) , sin embargo, en otro párrafo se expresa el uso de este material en polvo, imposible de usar en las actuales técnicas FDM. No se han encontrado filamentos para impresión 3D de este tipo de material en ese año 2017, ni siquiera en la actualidad existe filamento de PEEK puro, sí es posible encontrarlos, con aditivo de fibra de carbono. Tampoco se especifica qué tipo de material PEEK se usa y con qué características bioquímicas. Se desconoce el origen del PEEK, si es de fabricación propia o de alguna marca o fabricante conocido. Con todo lo anterior, resulta difícil exponer diferencias claras sobre la presente propuesta, ni siquiera, basándose en el único gráfico incluido en el documento. La patente [CN112190757A], trata de una prótesis de rodilla tumoral, orientada específicamente a a sustitución funcional del tumor, ese aspecto ya la aleja de la presente propuesta, orientada a ese tipo de defecto óseo (oncología ósea) , cuya geometría es notablemente diferente. La prótesis consta también de dos componentes: uno tibial y otro femoral fabricadas con material PEEK-CRF (Fibra de carbono) , aunque, se destaca la presencia de juntas fabricadas en PE y, la meseta tibial, en aleación de Cr-Co-Mo. No se especifica claramente el modo de fabricación de las piezas que forman la prótesis tumoral que, en ningún caso, usa la fabricación aditiva. La patente [CN105748176A] describe una prótesis para ATR, que incluye una pieza femoral y una pieza tibial fabricadas con PEEK, con buena biocompatibilidad. Las principales diferencias con respecto a la presente propuesta consisten en que no se utiliza PEI sino PEEK para la fabricación de la prótesis y no se menciona que la fabricación sea mediante impresión 3D. Tampoco se incluyen unos pinchos en el componente tibial, solamente una quilla. La patente [US2015335449A1] divulga un sistema de prueba para el remplazo de la rodilla que, aunque está compuesto por tres piezas, el inserto tibial está hecho de materiales biocompatibles, entre los que se incluye el PEI. Sin embargo, no se indica el método de fabricación, ni que las demás piezas puedan realizarse también en PEI. La patente [WO2021094382A1] hace referencia a una prótesis de rodilla, que incluye un componente tibial y otro femoral, que incluye una capa articulada de PEI, también se indica que el proceso puede llevarse a cabo por moldeo por inyección. Dicho documento también se centra en realizar un estudio de los diferentes polímeros adecuados para constituir la capa articulada y la combinación entre ellos. Sin embargo, existen varias diferencias con respecto a la presente propuesta como, por ejemplo, que el componente tibial está formado a su vez, por dos piezas, y que el PEI no se emplea en la fabricación del núcleo de estas. La patente [GB2547907A] describe una prótesis de rodilla, en particular, una pieza femoral y el método de fabricación de dicha pieza femoral. Dicha pieza incluye unos pinchos para su fijación al fémur, un botón rotuliano, y está fabricada íntegramente por moldeo por inyección, con PEEK de materia, y se indica el ejemplo de la marca PEEK-OPTIMA de la empresa Invibio Limited. Las diferencias con la presente propuesta son que el componente tibial, que no es el objetivo principal del documento [GB2547907A], se fabricaría con UHMWPE por ser más blando que el PEEK. No se utiliza, por tanto, para ninguna de las dos piezas el PEI, y no incluyen los pinchos para fijar a la tibia en la pieza tibial. Sin embargo, la bibliografía consultada no reporta casos de prótesis no metálicas en los cuales se demuestre que la inserción de la pieza tibial al hueso trabecular se realizará sin ayuda de cemento óseo ni sin riesgo de sufrir aflojamientos posteriores. Tampoco, e han encontrado piezas cuyo desgaste continuo no genere contaminación de partículas de dudosa respuesta inmunitaria. Por último, tampoco se han encontrado registros donde se determine el nivel de citotoxicidad del material implantado ni el nivel de penetración y fijación al hueso de piezas no metálicas que favorezca la integración implante-hueso. El único material no metálico usado en anteriores patentes es el PEEK o compuestos de PEEK-CRF, los cuales, no han sido probados de manera concluyente su bioactividad o sus buenas prestaciones osteoinductivas o de reacción inmunológica. La referencia (Hooper et al., 2019) , es el único registro que haya usado el material ULTEMTM1010 biocompatible en la fabricación aditiva de piezas protésicas, la diferencia principal con la presente propuesta consiste en que, el estudio referenciado solo hace referencia al uso de ULTEM 1010 para la fabricación de herramientas que intervienen en una ATR y no en la prótesis en sí. Además, se indica que dichos instrumentos son de un solo uso. No obstante, en las referencias (Miguel Suffo, 2020) , (M. Suffo et al., 2020) , ya se tienen antecedentes de sus buenas prestaciones en el campo biomédico. Como conclusión, se podría considerar como el estado de la técnica más cercano, la patente [US5116375A], aunque no divulga unos cajeados en cada cóndilo para su fijación al útil empleado en la inserción, ni un botón rotuliano, ni que las perforaciones que se realicen en el fémur y en la tibia sean cilíndricas o en ala delta. No obstante, que la prótesis esté fabricada en polieterimida (PEI) no está divulgado en la patente [US5116375A]. El efecto técnico que se produce por emplear PEI en vez de materiales metálicos para la fabricación de la prótesis es, evitar el desgaste que se produce con dichos materiales. El problema técnico objetivo que se resuelve es cómo reducir el rechazo y aumentar la biocompatibilidad de las prótesis en aquella población que es sensible a los metales. Otra patente que se considera igualmente cercano al estado de la técnica es [CN105748176A] pero, las principales diferencias se basan en que la pieza tibial no incluye pinchos (solo la quilla) y que el material empleado es PEEK. Esta última, se considera la diferencia esencial. El empleo del PEEK es más común en el estado de la técnica para prótesis no metálicas pero el PEI (ULTEM 1010) tiene mejores propiedades de bioactividad. Referencias bibliográficas empleadas. Bourne, R. B., Chesworth, B. M., Davis, A. M., Mahomed, N. N., Charron, K. D. J., & Met, D. (2010) . Patient Satisfaction after Total Knee Arthroplasty Who is Satisfied and Who is Not ? 57-63. https://doi.org/10.1007/s11999-009-1119-9 Brien, S. T. O., Luo, Y., & Brandt, J. (2015) . In-vitro andin-silico investigations on the in fl uence of contact pressure on cross-linked polyethylene wear in total knee replacements. 333, 687-693. https://doi.org/10.10167j.wear.2015.02.048 Fitzpatrick, C. K., Clar y , C. W., & Rullkoetter, P. J. (2012) . The role of patient, surgical, and implant design variation in total knee replacement performance. Journal of Biomechanics, 45 (12) , 2092-2102. https://doi.org/10.1016/jjbiomech.2012.05.035 Hooper, J., Schwarzkopf, R., Fernandez, E., Buckland, A., Werner, J., Einhorn, T., & Walker, P. S. (2019) . Feasibility of single-use 3D-printed instruments for total knee arthroplasty. The Bone & Joint Journal, 101-B (7_Supple_C) , 115-120. https://doi.org/10.1302/0301-620X.101B7.BJJ-2018-1506.R1 Keegan, G. M., Learmonth, I. D., & Case, C. P. (2007) . Orthopaedic metals and their potential toxicity in the arthroplasty patient. A review of current knowledge and future strategies. Journal of Bone and Joint Surger y - Series B, 89 (5) , 567-573. https://doi.org/10.1302/0301-620X.89B5.18903 Khosravipour, I., Pejhan, S., Luo, Y., & Wyss, U. P. (2018) . Customized surface-guided knee implant: Contact analysis and experimental test. 232 (1) , 90-100. https://doi.org/10.1177/0954411917744586 Schroer, W. C., Berend, K. R., Lombardi, A. V, Barnes, C. L., Bolognesi, M. P., Berend, M. E., Ritter, M. A., & Nunley, R. M. (2013) . Why Are Total Knees Failing Today? Etiology of Total Knee Revision in 2010 and 2011. Journal of Arthroplasty, 28 (8) , 116-119. https://doi.org/10.1016/j.arth.2013.04.056 Sharkey;, P. F., Shastri;, R. H. R. S., & and Sidney M. Jacoby, B. (2002) . Why Are Total Knee Arthroplasties Failing Today? CLINICAL ORTHOPAEDICS AND RELATED RESEARCH, 404, 7-13. https://doi.org/10.1097/01.blo.0000036002.13841.32 Siqueira, W. L., Custodio, W., & McDonald, E. E. (2012) . New insights into the composition and functions of the acquired enamel pellicle. Journal of Dental Research, 91 (12) , 1110-1118. https://doi.org/10.1177/0022034512462578 Subramani, K., Jung, R. E., Molenberg, A., & Hammerle, C. H. F. (2009) . Biofilm on dental implants: a review of the literature. The International Journal of Oral & Maxillofacial Implants, 24 (4) , 616-626. https://doi.org/10.5167/uzh-26110 Suffo, M., Vilches-Pérez, J. I., & Salido-Peracaula, M. (2020) . Comparative Analysis of the Adhesion of Metallic Inserts on Dental Implants-Prosthetic Assembly Generated by Polymeric Materials Used for Additive Manufacturing. In Lecture Notes in Mechanical Engineering (Vol. 1, pp. 245-253) . https://doi.org/10.1007/978-3-030-41200-5_27 Suffo, Miguel. (2020) . Determination of Adhesive to Be Applied in the Fabrication of Prototypes Using FDM Techniques of 3D Printing in Component Parts Using ULTEM TM 1010 (pp. 959-969) . Wood, N. J., Jenkinson, H. F., Davis, S. A., Mann, S., OSullivan, D. J., & Barbour, M. E. (2015) . Chlorhexidine hexametaphosphate nanoparticles as a novel antimicrobial coating for dental implants. Journal of Materials Science: Materials in Medicine, 26 (6) , 1-10. https://doi.org/10.1007/s10856-015-5532-1 Zhang, J. Y., Wang, J., Tian, D. M., Jiang, D. P., Li, J. J., & Hu, Y. C. (2020) . Spherical center and rotating platform hinged knee prosthesis: Finite-element model establishment, verification and contact analysis. Knee, 27 (3) , 731-739. https://doi.org/10.1016Zj.knee.2020.04.022 EXPLICACIÓN DE LA INVENCIÓN La invención consiste un conjunto protésico formado, fundamentalmente, por dos piezas no metálicas, una pieza femoral y una pieza tibial, ambas fabricadas en material biocompatible, y más concretamente en PEI. Se añade una tercera pieza, también en PEI, sin relevancia en la cinemática del conjunto pero que sí influye en la estética. La invención propone una reducción de piezas al conjunto protésico convencional. Su geometría está basada en un modelo comercial descrito por el fabricante Str y ker® Orthopaedics, en particular, su modelo Triathlon® Knee System. La pieza femoral apoya sus cóndilos sobre la pieza tibial y cuenta con unos pinchos en su parte superior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas del fémur del paciente. Estos cóndilos presentan unos cajeados en sus extremos, para permitir su correcta fijación al útil que se usará en la inserción de la pieza en el hueso. La pieza tibial que está diseñada en forma de silla de montar, con amplia superficie de contacto para permitir los ángulos de giro anatómicos en los tres planos principales. La ieza tibial cuenta con unos pinchos en su parte inferior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas de la tibia del paciente. La pieza tibial cuenta además con unos refuerzos antirretorno en forma de triángulos, capaces de conseguir una fijación completa al hueso sin necesidad de cementación. Adicionalmente, la pieza tibial cuenta con una quilla en forma de ala delta, que igualmente habrá de ser insertada en la tibia del paciente. Esta invención propone una alternativa no metálica, biocompatible, osteoinductora y de fijación asegurada sin problemas de desprendimientos contaminantes en toda su vida útil. El material propuesto para la construcción de los componentes de este conjunto protésico es una polieteramida (PEI) , mediante cuyo empleo se pretende cubrir la necesidad de este tipo de prótesis de un sector de la población que rechaza las prótesis metálicas, debido a su especial alergia a los metales. Concretamente, en la invención se propone el empleo de un tipo de PEI, comercialmente denominado ULTEM™ 1010, un termoplástico biocompatible certificado por el fabricante (Sabic) , al que se ha sometido a ensayos de citotoxicidad y lead/death, y que posee un módulo elástico de 2, 86GPa, muy próximo al del hueso cortical. Debido a la alta elasticidad del material PEI usado, el conjunto se adapta al movimiento anatómico sin lesiones para el paciente y, al ser de bajo peso, la movilidad de este no se resiente. Adicionalmente, las buenas propiedades térmicas del PEI, permiten que no se produzca la abrasión de las zonas en contacto y el acabado superficial de estas zonas en contacto admiten un pulido que garantiza el deslizamiento con un rozamiento admisible. En cualquier caso, dado que no se usa material contaminante, los posibles desprendimientos motivados por los giros en diferentes planos no contaminan los tejidos ni producen pérdida de hueso. Por estas razones, las piezas que forman el conjunto protésico objeto de la invención, evitan los principales problemas que surgen con las prótesis basadas en materiales metálicos como el acero inoxidable, aleaciones de titanio o de Cr-Co-Ni/Mo, las cuales, o garantizan la formación de hueso y provocan problemas en la proximidad de la cirugía y, sobre todo, los fenómenos de corrosión. Adicionalmente, las prótesis metálicas que actualmente son usadas en traumatología, tanto en humano como en animal, en general, lo único que usan como barrera protectora del material metálico es cemento óseo. Con la invención propuesta, se elimina la necesidad de emplear cemento óseo, ni como barrera protectora del material metálico, ni para la fijación de sus piezas. El método de fabricación preferente de las piezas protésicas dependerá de la solución que se requiera, para piezas personalizadas se usará la técnica Fused Deposition Modeling (FDM) en impresión 3D. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Muestra la configuración geométrica de las partes de la prótesis y su inserción en huesos. En ella se representan: 1.- Fémur. 2.- Tibia. 3.- Pieza femoral. 4.- Pieza tibial. 5.- Botón rotuliano. 6.- Pinchos de la pieza femoral. 7.- Pinchos de la pieza tibial. 8.- Refuerzos antirretorno de la pieza tibial. 9.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas del fémur. 10.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas de la tibia. 11.- Perforación en forma de ala delta practicada en la tibia. 12.- Quilla tibial. 13.- Cóndilos. 14.- Cajeados Figura 2. Muestra el aspecto final de las dos partes principales que forman en conjunto protésico, fabricadas en PEI. En ella se distingue: a) Pieza femoral. b) Pieza tibial. Figura 3. Muestra los resultados obtenidos en el ensayo de viabilidad celular. REALIZACIÓN PREFERENTE DE LA INVENCIÓN La realización preferente de la invención se describe en detalle a continuación con referencia a la figura 1. A partir de los modelos 3D obtenidos, tomando como referencias las 3 partes de la prótesis metálica Triathlon® Knee System, se propone una alternativa compuesta únicamente por dos partes no metálicas, una pieza femoral y una pieza tibial, formada por la fusión de la pieza tibial con el inserto de PE, siendo ambas piezas fabricadas en PE. Partiendo de modelos 3D de huesos femoral (1) y tibial (2) , se sitúan los modelos 3D correspondientes a las piezas protésicas femoral (3) y tibial (4) , diseñadas a partir de las piezas cedidas por el fabricante Str y ker. El botón rotuliano (5) , que también forma parte del objeto de la invención, sólo tiene una función estética en el conjunto, no tiene relevancia en la funcionalidad de la prótesis y se fabrica en el mismo material que las demás piezas. Para la fijación de las piezas femoral (3) y tibial (4) en los huesos, se modelan pinchos (6) en la pieza fermoral (3) , y (7) en la pieza tibial (4) . Adicionalmente, se disponen unos refuerzos antirretorno en forma de triángulos (8) , lo cuales, garantizarán una correcta fijación de la pieza (4) en todo su volumen y evitan la micromovilidad. Para comprobar la geometría y tamaño de los pinchos, se realizan perforaciones cilíndricas (9) y (10) , en las paredes planas de las piezas que representa el hueso femoral (1) y la tibia (2) . Por último, en la pieza que simula la tibia (2) , se practica una perforación en forma de ala delta (11) , la cual, permite la correcta inserción de la quilla tibial (12) . Las curvaturas dispuestas en los cóndilos (13) de la pieza femoral (3) , se adaptan a la parte superior (bandeja tibial) , de la pieza tibial (4) y su encaje es perfecto para permitir su rotación y deslizamiento, el cual, mantendrá siempre el contacto en todos los ángulos e flexión. Se disponen cajeados (14) en los extremos de cada cóndilo (13) para permitir su correcta fijación al útil con el cual se usará en la inserción de la pieza en el hueso. Las piezas femoral (3) y tibial (4) modeladas en 3D por la herramienta CAD, se exportaron para su fabricaron aditiva en FDM con filamento ULTEM™ 1010 biocompatible y adaptada a la impresora Fortus 450MC. Para este trabajo, se usó una boquilla tipo T14 (0.254 mm) ; para el material de soporte se usó un tipo de boquilla T16 (0.254 mm) . A la finalización de la impresión, se pulen las superficies hasta alcanzar la rugosidad requerida. El resultado final se observa en la imagen de la figura 2. El conjunto protésico modelado en 3D se exportó a la herramienta de simulación FEM (ANSYS/Academic Research de ANSYS Inc., Houston, PA, USA) , donde se analizaron en base a la norma ISO 14243-3:2009, la cual sugiere tener en cuenta las distribuciones de cargas para diferentes ángulos de flexión: 0°, 30°, 60°, 90° y, 120°. Para cada ángulo se llevó a cabo un análisis estático estructural considerando un contacto tipo rugoso entre las dos piezas aplicando un coeficiente de fricción de 0, 04. Se simuló una carga axial de 2000N, aplicada a la parte superior de la superficie de la pieza tibial, donde se encuentra el contacto entre los cóndilos femorales y la bandeja tibial. Para comprobar la bioactividad del material, se realizan varios ensayos sobre materiales no metálicos. En la tabla 1, se recogen las descripciones de los materiales usados en el ensayo. Tabla 1. Datos de materiales y fabricantes usados en el ensayo de viabilidad celular. Se aplican cultivos de células primarias osteoblasticas humanas (COPH, células adquiridas a la empresa PROMOCELL como HOB®) . Para dicho estudio de viabilidad elular, COPH se cultivaron en medios osteogénicos y se realizaron ensayos de viabilidad/citotoxicidad a 7 días. En este ensayo, denominado LIVE/DEAD, las células muertas se marcan con EthD-1 y las vivas con Cal-ceína AM. Como control negativo, antes del proceso de marcaje, se incubaron cultivos de COPH con metanol al 70% durante 30 minutos. Como control positivo se usaron cultivos de COPH sin ningún tratamiento. En primer lugar, se eliminó el medio de cultivo, posteriormente se lavaron con PBS y finalmente se añadió la solución de marcaje. Después de una incubación de 30 minutos a temperatura ambiente, se observaron bajo microscopía de fluorescencia. Para el análisis de la intensidad de las distintas fluorescencias se usó el software ImageJ, realizándose para su representación la relación entre ambos marcadores. Según los resultados obtenidos y presentados en la figura 3, todos los materiales estudiados no interfieren en el crecimiento y viabilidad celular de osteoblastos humanos, siendo materiales óptimos para futuros ensayos de bioactividad en cultivos con osteoblastos humanos. Esta conclusión se apoya en la comparación entre el control positivo y los distintos cultivos para cada material. En detalle, se observa que el material ULTEMTM1010 tiene un interesante efecto positivo en la viabilidad celular de las COPH cuando comparamos este tratamiento con los controles positivos, destacando con una ratio por encima de 6. APLICACIÓN INDUSTRIAL El conjunto protésico no metálicos objeto de la invención proporciona una alternativa válida a pacientes sensibles a metales. En particular, la prótesis completa de rodilla descrita ofrece una solución a los fabricantes de marcas comerciales de este tipo de productos, los cuales, no ofertan debido a su escasa producción y logística. El modelo descrito es compatible con el fabricante Str y ker con ligeras diferencias que la hacen más fácil de implantar ya que sólo presenta dos piezas: una femoral y otra tibial. Al basarse en un material certificado para su uso médico facilita su garantía de seguridad y, se ha complementado con un estudio de viabilidad celular para garantizar que no sólo exista pérdida ósea, sino que pueda generarse hueso a su alrededor.
+ ES-2936558_B2 PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) CAMPO TÉCNICO La presente invención pertenece al campo de la biomecánica. El objeto técnico consiste en un conjunto protésico formado por, fundamentalmente, dos piezas (una pieza femoral y una pieza tibial) , y un botón rotuliano, para Artroplastia Total de Rodilla (ATR) , fabricadas íntegramente en polieterimida (PEI) . ANTECEDENTES DE LA INVENCIÓN Cualquier cuerpo extraño en el organismo favorece el desarrollo de infecciones y, por consiguiente, un rechazo del mismo (Wood et al., 2015) . Particularmente, este fenómeno es frecuente en los implantes dentales, que se recubren por la saliva cuyas glucoproteínas favorecen la colonización por microorganismos (sobre todo, estreptococos) , los cuales proliferan en la cavidad oral (Siqueira et al., 2012) ; (Subramani et al., 2009) . De manera similar ocurre con las prótesis en traumatología (por ejemplo: en la artroplastia total de rodilla ATR, o cadera ATC) , cuyos materiales usados han sido a base de aceros inoxidables, aleaciones de titanio, aleaciones de Cr-Co-Ni y otros metales peligrosos para el ser humano (Keegan et al., 2007) . En este caso, el problema surge por falta de biocompatibidad demostrada a medio o largo plazo. En estas piezas se busca un aumento de su vida útil, facilitar su integración en el hueso mediante la incorporación de un material cementado a las superficies implantables, que sirva de barrera osteoinductiva real y proteja de infecciones. A pesar de conseguir un alto índice de éxito en estas intervenciones aún existe un 19% de pacientes que muestran disconformidades con las intervenciones a las que se han visto sometidas y han provocado una revisión (Bourne et al., 2010) . Según Khosravipur 2017, para reducir la revisión de estas intervenciones y dotarlas de más longevidad, habría que influir principalmente en la cinemática articular, el cual depende a su vez del diseño del implante y la biomecánica. (Fitzpatrick et al., 2012) , añade la combinación ntre el diseño y la técnica quirúrgica que exija el diseño del implante como factor decisorio. Los diseños más recientes van encaminados a personalizar las prótesis al paciente y, para ello, la fabricación aditiva (FA) brinda una oportunidad de mejora para diseñar prótesis a medida muy útil para superar este hito. Algunos materiales con los que es posible obtener prototipos en FA son biocompatibles y ofrecen unas prestaciones mecánicas idóneas para sustituir a los actuales materiales basados en aleaciones metálicas de Cr-Co-Mo (Vitalium) o titanio. Las piezas personalizadas obtenidas mediante FA resultan más baratas que ninguna otra técnica de fabricación actualmente aplicable. No obstante, para una producción seriada cubriendo las diferentes tallas anatómicas existentes en las piezas protésicas disponibles comercialmente, la FA no sería la solución más adecuada. Para este fin, es más aconsejable probar la tecnología de inyección en moldes, la cual permite fabricar piezas seriadas con máxima calidad y sin generar ningún residuo. Sin embargo, no es solo suficiente que un material sea biocompatible, adicionalmente, se deben superar ensayos bioquímicos de citotoxicidad y osteoinducción. Por último, con carácter previo a su fabricación, los modelos geométricos diseñados deben superar como mínimo, simulaciones numéricas basadas en análisis estructurales para confirmar un rendimiento similar a las actuales basadas en materiales metálicos. En la actualidad, la tipología de prótesis de deslizamiento es la que está siendo usada con mayor profusión en el mundo frente a las de bisagra, como la registrada en la patente [ES2429390B1], más adecuada para casos más severos de reemplazos (Zhang et al., 2020) . Las prótesis de deslizamiento se componen de 4 partes aunque son únicamente 3 las que influyen en la estabilidad y comportamiento biomecánico del conjunto, la cuarta pieza es el botón rotuliano que se integra para cumplir un efecto más estético que funcional. El Polietileno (PE) y más concretamente el Polietileno de peso molecular ultra alto (UHMWPE) se ha utilizado en artroplastia total de rodilla durante más de 50 años, debido a las buenas propiedades mecánicas y comportamiento bien tolerado, especialmente fricción y desgaste. Precisamente el desgaste, el aflojamiento, la inestabilidad y la infección del PE son las principales razones para revisiones de la artroplastia total de rodilla (ATR) según (Sharkey; et al., 2002) aunque la referencia (Schroer et al., 2013) demuestra lo contrario y concluye que el 50% de las revisiones vienen provocadas por una inestabilidad o por una infección. El desgaste de PE está directamente relacionado con tamaño de las áreas de contacto y la magnitud del contacto (Brien et al., 2015) . El desgaste de PE produce partículas de desgaste alrededor el implante de rodilla, que puede provocar osteólisis y el largo plazo puede rovocar el aflojamiento del implante (Khosravipour et al., 2018) . Las claves que se persiguen en cualquier nueva propuesta de prótesis deben ser: integración en el hueso sin incompatibilidad bioquímica y, longevidad que evite posteriores revisiones. El proceso de fabricación de las actuales prótesis metálicas se realiza por procesos de mecanizado por arranque de viruta y, es durante el tratamiento de la superficie donde mayor probabilidad se den alteraciones. Son varios los estudios que han analizado la superficie de las prótesis en busca de contaminantes químicos y/o físicos. Lo más habitual es encontrar residuos del granallado en la superficie, como son partículas de aluminio. Esta contaminación puede afectar gravemente a los procesos biológicos desencadenando reacciones contrarias o de cuerpo extraño que conllevarían a la inflamación de los tejidos e incluso la pérdida de la prótesis. De hecho, no sólo afecta que exista una partícula de un determinado tamaño en el comportamiento celular, si no su composición química. En la patente [US 2010/0161067A1], se contempla la introducción de cámara posterior en la pieza femoral, que proporciona control sobre el movimiento de la pieza femoral, lo que evita movimiento innecesario que llevaría al desgaste. Esta posee ciertas desventajas como incluir impacto entre la cámara y el poste de la pieza tibial, lo que produce un aumento en el desgaste y posibles deformaciones. Este efecto es incrementado en los casos en los que ocurre rotación interna o externa. Además, las traslaciones anteriores-posteriores se oponen a la tendencia natural del fémur de situarse en la zona más profunda del plato tibial. En la patente [WO 00/23011], el concepto novedoso introducido es el cambio gradual del perfil frontal del cóndilo femoral en las superficies de contacto con el plato tibial, cuya superficie cambiaría de manera similar. El resultado alcanzado será encontrar las posiciones con menor energía potencial, en cada ángulo de flexión. Estos puntos de contacto en ambos cóndilos son simétricos. Las patentes [EP2774582A1], [WO2004012633A1], [US2011184525A1], [US2012083894A1] [US2016242917A1] [WO2016046654A1] [WO2016071938A1], son similares modelos geométricos de 3 o más piezas fijadas entre ellas con limitada capacidad de giro y cuyo rozamiento agresivo provocan desprendimientos continuos de partículas metálicas y dispuestas para rellenar con cemento óseo. Las patentes [WO2013156743A1], [WO2015048273A1], sólo aportan soluciones para prótesis de sustitución temporal o de reemplazo. La patente [EP0294298A], difiere con respecto a la presente propuesta en que, no se incluyen unos pinchos adicionales a la quilla o ala delta en el componente tibial, el tipo de perforación practicado en el interior del fémur no s cilíndrico, y no se emplea una resina termoplástica como el PEI para la fabricación de la prótesis. Las patentes [US2020138584A1], [WO2012018567A1] únicamente aportan una pieza tibial con dudosa capacidad de fijación al hueso y de implantación según técnica quirúrgica. De manera similar, la patente [WO2008054389A1] sólo aporta una pieza femoral que no se especifica la forma quirúrgica de su implantación. La patente [GB2067412A] también divulga una prótesis mecánica para ATR, que incluye una pieza femoral y una pieza tibial. Las diferencias con la presente propuesta son que el material de fabricación no es PEI, las piezas no se obtienen mediante impresión 3D, y la prótesis no incluye unos pinchos para su fijación en la tibia y fémur. La patente [US5116375A] hace referencia a una prótesis de rodilla que incluye una pieza femoral que se incrusta en la zona baja del fémur, y una pieza tibial que se incrusta en la parte superior de la tibia. Ambas piezas están formadas por un material biocompatible. Las principales diferencias con respecto a la presente propuesta se basan en que, pese a indicar que el material de la prótesis es biocompatible, se utilizan materiales metálicos y, en ningún caso, una resina termoplástica como el PEI o el polieteretercetona (PEEK) . Además, no se hace referencia a que el sistema de fabricación sea mediante impresión 3D Más recientemente, la patente [EP2744452A1] hace referencia a una componente tibial de prueba, fabricada en una única pieza de un material plástico, entre los que se nombra el PEI. No se trata, por tanto, de una prótesis completa para la rodilla, ni de larga duración, no se divulga la forma de la pieza femoral. Tampoco se especifica cómo se va a fabricar la pieza mediante impresión 3D con PEI. La patente [CN107822746A], trata de una prótesis de articulación de rodilla con estructura de hueso trabecular que incluye un soporte para la tibia y una almohadilla para la espinilla. Dispone de más de 2 componentes y parece que su fabricación es íntegramente en material PEEK, mediante la técnica de modelado de deposición fundida (FDM) , sin embargo, en otro párrafo se expresa el uso de este material en polvo, imposible de usar en las actuales técnicas FDM. No se han encontrado filamentos para impresión 3D de este tipo de material en ese año 2017, ni siquiera en la actualidad existe filamento de PEEK puro, sí es posible encontrarlos, con aditivo de fibra de carbono. Tampoco se especifica qué tipo de material PEEK se usa y con qué características bioquímicas. Se desconoce el origen del PEEK, si es de fabricación propia o de alguna marca o fabricante conocido. Con todo lo anterior, resulta difícil exponer diferencias claras sobre la presente propuesta, ni siquiera, basándose en el único gráfico incluido en el documento. La patente [CN112190757A], trata de una prótesis de rodilla tumoral, orientada específicamente a la sustitución funcional del tumor, ese aspecto ya la aleja de la presente propuesta, orientada a ese tipo de defecto óseo (oncología ósea) , cuya geometría es notablemente diferente. La prótesis consta también de dos componentes: uno tibial y otro femoral fabricadas con material PEEK-CRF (Fibra de carbono) , aunque, se destaca la presencia de juntas fabricadas en PE y, la meseta tibial, en aleación de Cr-Co-Mo. No se especifica claramente el modo de fabricación de las piezas que forman la prótesis tumoral que, en ningún caso, usa la fabricación aditiva. La patente [CN105748176A] describe una prótesis para ATR, que incluye una pieza femoral y una pieza tibial fabricadas con PEEK, con buena biocompatibilidad. Las principales diferencias con respecto a la presente propuesta consisten en que no se utiliza PEI sino PEEK para la fabricación de la prótesis y no se menciona que la fabricación sea mediante impresión 3D. Tampoco se incluyen unos pinchos en el componente tibial, solamente una quilla. La patente [US2015335449A1] divulga un sistema de prueba para el remplazo de la rodilla que, aunque está compuesto por tres piezas, el inserto tibial está hecho de materiales biocompatibles, entre los que se incluye el PEI. Sin embargo, no se indica el método de fabricación, ni que las demás piezas puedan realizarse también en PEI. La patente [WO2021094382A1] hace referencia a una prótesis de rodilla, que incluye un componente tibial y otro femoral, que incluye una capa articulada de PEI, también se indica que el proceso puede llevarse a cabo por moldeo por inyección. Dicho documento también se centra en realizar un estudio de los diferentes polímeros adecuados para constituir la capa articulada y la combinación entre ellos. Sin embargo, existen varias diferencias con respecto a la presente propuesta como, por ejemplo, que el componente tibial está formado a su vez, por dos piezas, y que el PEI no se emplea en la fabricación del núcleo de estas. La patente [GB2547907A] describe una prótesis de rodilla, en particular, una pieza femoral y el método de fabricación de dicha pieza femoral. Dicha pieza incluye unos pinchos para su fijación al fémur, un botón rotuliano, y está fabricada íntegramente por moldeo por inyección, con PEEK de materia, y se indica el ejemplo de la marca PEEK-OPTIMA de la empresa Invibio Limited. Las diferencias con la presente propuesta son que el componente tibial, que no es el objetivo principal del documento [GB2547907A], se fabricaría con UHMWPE por ser más blando que el PEEK. No se utiliza, por tanto, para ninguna de las dos piezas el PEI, y no incluyen los pinchos para fijar a la tibia en la pieza tibial. Sin embargo, la bibliografía consultada no reporta casos de prótesis no metálicas en los cuales se demuestre que la inserción de la pieza tibial al hueso trabecular se realizará in ayuda de cemento óseo ni sin riesgo de sufrir aflojamientos posteriores. Tampoco, se han encontrado piezas cuyo desgaste continuo no genere contaminación de partículas de dudosa respuesta inmunitaria. Por último, tampoco se han encontrado registros donde se determine el nivel de citotoxicidad del material implantado ni el nivel de penetración y fijación al hueso de piezas no metálicas que favorezca la integración implante-hueso. El único material no metálico usado en anteriores patentes es el PEEK o compuestos de PEEK-CRF, los cuales, no han sido probados de manera concluyente su bioactividad o sus buenas prestaciones osteoinductivas o de reacción inmunológica. La referencia (Hooper et al., 2019) , es el único registro que haya usado el material ULTEMTM1010 biocompatible en la fabricación aditiva de piezas protésicas, la diferencia principal con la presente propuesta consiste en que, el estudio referenciado solo hace referencia al uso de ULTEM 1010 para la fabricación de herramientas que intervienen en una ATR y no en la prótesis en sí. Además, se indica que dichos instrumentos son de un solo uso. No obstante, en las referencias (Miguel Suffo, 2020) , (M. Suffo et al., 2020) , ya se tienen antecedentes de sus buenas prestaciones en el campo biomédico. Como conclusión, se podría considerar como el estado de la técnica más cercano, la patente [US5116375A], aunque no divulga unos cajeados en cada cóndilo para su fijación al útil empleado en la inserción, ni un botón rotuliano, ni que las perforaciones que se realicen en el fémur y en la tibia sean cilíndricas o en ala delta. No obstante, que la prótesis esté fabricada en polieterimida (PEI) no está divulgado en la patente [US5116375A]. El efecto técnico que se produce por emplear PEI en vez de materiales metálicos para la fabricación de la prótesis es, evitar el desgaste que se produce con dichos materiales. El problema técnico objetivo que se resuelve es cómo reducir el rechazo y aumentar la biocompatibilidad de las prótesis en aquella población que es sensible a los metales. Otra patente que se considera igualmente cercano al estado de la técnica es [CN105748176A] pero, las principales diferencias se basan en que la pieza tibial no incluye pinchos (solo la quilla) y que el material empleado es PEEK. Esta última, se considera la diferencia esencial. El empleo del PEEK es más común en el estado de la técnica para prótesis no metálicas pero el PEI (ULTEM 1010) tiene mejores propiedades de bioactividad. Referencias bibliográficas empleadas. Bourne, R. B., Chesworth, B. M., Davis, A. M., Mahomed, N. N., Charron, K. D. J., & Met, D. (2010) . Patient Satisfaction after Total Knee Arthroplasty Who is Satisfied and Who is Not ? 57-63. https://doi.org/10.1007/s11999-009-1119-9 Brien, S. T. O., Luo, Y., & Brandt, J. (2015) . In-vitro andin-silico investigations on the in fl uence of contact pressure on cross-linked polyethylene wear in total knee replacements. 333, 687-693. https://doi.org/10.1016Zj.wear.2015.02.048 Fitzpatrick, C. K., Clar y , C. W., & Rullkoetter, P. J. (2012) . The role of patient, surgical, and implant design variation in total knee replacement performance. Journal of Biomechanics, 45 (12) , 2092-2102. https://doi.org/10.1016/jjbiomech.2012.05.035 Hooper, J., Schwarzkopf, R., Fernandez, E., Buckland, A., Werner, J., Einhorn, T., & Walker, P. S. (2019) . Feasibility of single-use 3D-printed instruments for total knee arthroplasty. The Bone & Joint Journal, 101-B (7_Supple_C) , 115-120. https://doi.org/10.1302/0301-620X.101B7.BJJ-2018-1506.R1 Keegan, G. M., Learmonth, I. D., & Case, C. P. (2007) . Orthopaedic metals and their potential toxicity in the arthroplasty patient. A review of current knowledge and future strategies. Journal of Bone and Joint Surger y - Series B, 89 (5) , 567-573. https://doi.org/10.1302/0301-620X.89B5.18903 Khosravipour, I., Pejhan, S., Luo, Y., & Wyss, U. P. (2018) . Customized surface-guided knee implant: Contact analysis and experimental test. 232 (1) , 90-100. https://doi.org/10.1177/0954411917744586 Schroer, W. C., Berend, K. R., Lombardi, A. V, Barnes, C. L., Bolognesi, M. P., Berend, M. E., Ritter, M. A., & Nunley, R. M. (2013) . Why Are Total Knees Failing Today? Etiology of Total Knee Revision in 2010 and 2011. Journal of Arthroplasty, 28 (8) , 116-119. https://doi.org/10.1016/j.arth.2013.04.056 Sharkey;, P. F., Shastri;, R. H. R. S., & and Sidney M. Jacoby, B. (2002) . Why Are Total Knee Arthroplasties Failing Today? CLINICAL ORTHOPAEDICS AND RELATED RESEARCH, 404, 7-13. https://doi.org/10.1097/01.blo.0000036002.13841.32 Siqueira, W. L., Custodio, W., & McDonald, E. E. (2012) . New insights into the composition and functions of the acquired enamel pellicle. Journal of Dental Research, 91 (12) , 1110-1118. https://doi.org/10.1177/0022034512462578 Subramani, K., Jung, R. E., Molenberg, A., & Hammerle, C. H. F. (2009) . Biofilm on dental implants: a review of the literature. The International Journal of Oral & Maxillofacial Implants, 24 (4) , 616-626. https://doi.org/10.5167/uzh-26110 Suffo, M., Vilches-Pérez, J. I., & Salido-Peracaula, M. (2020) . Comparative Analysis of the Adhesion of Metallic Inserts on Dental Implants-Prosthetic Assembly Generated by Polymeric Materials Used for Additive Manufacturing. In Lecture Notes in Mechanical Engineering (Vol. 1, pp. 245-253) . https://doi.org/10.1007/978-3-030-41200-5_27 Suffo, Miguel. (2020) . Determination of Adhesive to Be Applied in the Fabrication of Prototypes Using FDM Techniques of 3D Printing in Component Parts Using ULTEM ™ 1010 (pp. 959-969) . Wood, N. J., Jenkinson, H. F., Davis, S. A., Mann, S., OSullivan, D. J., & Barbour, M. E. (2015) . Chlorhexidine hexametaphosphate nanoparticles as a novel antimicrobial coating for dental implants. Journal of Materials Science: Materials in Medicine, 26 (6) , 1-10. https://doi.org/10.1007/s10856-015-5532-1 Zhang, J. Y., Wang, J., Tian, D. M., Jiang, D. P., Li, J. J., & Hu, Y. C. (2020) . Spherical center and rotating platform hinged knee prosthesis: Finite-element model establishment, verification and contact analysis. Knee, 27 (3) , 731-739. https://doi.org/10.1016Zj.knee.2020.04.022 EXPLICACIÓN DE LA INVENCIÓN La invención consiste un conjunto protésico formado, fundamentalmente, por dos piezas no metálicas, una pieza femoral y una pieza tibial, ambas fabricadas en material biocompatible, y más concretamente en PEI. Se añade una tercera pieza, también en PEI, sin relevancia en la cinemática del conjunto pero que sí influye en la estética. La invención propone una reducción de piezas al conjunto protésico convencional. Su geometría está basada en un modelo comercial descrito por el fabricante Str y ker® Orthopaedics, en particular, su modelo Triathlon® Knee System. La pieza femoral apoya sus cóndilos sobre la pieza tibial y cuenta con unos pinchos en su parte superior, con objeto de que estos sean introducidos en unas perforaciones cilíndricas que habrán de ser realizadas en las paredes planas adaptadas del fémur del paciente. Estos cóndilos presentan unos cajeados en sus extremos, para permitir su correcta fijación al útil que se usará en la inserción de la pieza en el hueso. La pieza tibial que está diseñada en forma de silla de montar, con amplia superficie de contacto para permitir los ángulos de giro anatómicos en los tres planos principales. La ieza tibial cuenta con unos pinchos en su parte inferior, con objeto de que estos sean introducidos en unas perforaciones cilindricas que habrán de ser realizadas en las paredes planas adaptadas de la tibia del paciente. La pieza tibial cuenta además con unos refuerzos antirretorno en forma de triángulos, capaces de conseguir una fijación completa al hueso sin necesidad de cementación. Adicionalmente, la pieza tibial cuenta con una quilla en forma de ala delta, que igualmente habrá de ser insertada en la tibia del paciente. Esta invención propone una alternativa no metálica, biocompatible, osteoinductora y de fijación asegurada sin problemas de desprendimientos contaminantes en toda su vida útil. El material propuesto para la construcción de los componentes de este conjunto protésico es una polieteramida (PEI) , mediante cuyo empleo se pretende cubrir la necesidad de este tipo de prótesis de un sector de la población que rechaza las prótesis metálicas, debido a su especial alergia a los metales. Concretamente, en la invención se propone el empleo de un tipo de PEI, comercialmente denominado ULTEM™ 1010, un termoplástico biocompatible certificado por el fabricante (Sabic) , al que se ha sometido a ensayos de citotoxicidad y lead/death, y que posee un módulo elástico de 2, 86GPa, muy próximo al del hueso cortical. Debido a la alta elasticidad del material PEI usado, el conjunto se adapta al movimiento anatómico sin lesiones para el paciente y, al ser de bajo peso, la movilidad de este no se resiente. Adicionalmente, las buenas propiedades térmicas del PEI, permiten que no se produzca la abrasión de las zonas en contacto y el acabado superficial de estas zonas en contacto admiten un pulido que garantiza el deslizamiento con un rozamiento admisible. En cualquier caso, dado que no se usa material contaminante, los posibles desprendimientos motivados por los giros en diferentes planos no contaminan los tejidos ni producen pérdida de hueso. Por estas razones, las piezas que forman el conjunto protésico objeto de la invención, evitan los principales problemas que surgen con las prótesis basadas en materiales metálicos como el acero inoxidable, aleaciones de titanio o de Cr-Co-Ni/Mo, las cuales, o garantizan la formación de hueso y provocan problemas en la proximidad de la cirugía y, sobre todo, los fenómenos de corrosión. Adicionalmente, las prótesis metálicas que actualmente son usadas en traumatología, tanto en humano como en animal, en general, lo único que usan como barrera protectora del material metálico es cemento óseo. Con la invención propuesta, se elimina la necesidad de emplear cemento óseo, ni como barrera protectora del material metálico, ni para la fijación de sus piezas. El método de fabricación preferente de las piezas protésicas dependerá de la solución que se requiera, para piezas personalizadas se usará la técnica Fused Deposition Modeling (FDM) en impresión 3D. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Muestra la configuración geométrica de las partes de la prótesis y su inserción en huesos. En ella se representan: 1.- Fémur. 2.- Tibia. 3.- Pieza femoral. 4.- Pieza tibial. 5.- Botón rotuliano. 6.- Pinchos de la pieza femoral. 7.- Pinchos de la pieza tibial. 8.- Refuerzos antirretorno de la pieza tibial. 9.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas del fémur. 10.- Perforaciones cilíndricas realizadas en las paredes planas adaptadas de la tibia para la inserción de la quilla tibial de la prótesis. 11.- Perforación en forma de ala delta practicada en la tibia. 12.- Quilla tibial. 13.- Cóndilos. 14.- Cajeados Figura 2. Muestra los resultados obtenidos en el ensayo de viabilidad celular. REALIZACIÓN PREFERENTE DE LA INVENCIÓN La realización preferente de la invención se describe en detalle a continuación con referencia a la figura 1. A partir de los modelos 3D obtenidos, tomando como referencias las 3 partes de la prótesis metálica Triathlon® Knee System, se propone una alternativa compuesta únicamente por dos partes no metálicas, una pieza femoral y una pieza tibial, formada por la fusión de la pieza tibial con el inserto de PE, siendo ambas piezas fabricadas en PE. Partiendo de modelos 3D de huesos femoral (1) y tibial (2) , se sitúan los modelos 3D correspondientes a las piezas protésicas femoral (3) y tibial (4) , diseñadas a partir de las piezas cedidas por el fabricante Str y ker. El botón rotuliano (5) , que también forma parte del objeto de la invención, sólo tiene una función estética en el conjunto, no tiene relevancia en la funcionalidad de la prótesis y se fabrica en el mismo material que las demás piezas. Para la fijación de las piezas femoral (3) y tibial (4) en los huesos, se modelan pinchos (6) en la pieza femoral (3) , y (7) en la pieza tibial (4) . Adicionalmente, se disponen unos refuerzos antirretorno en forma de triángulos (8) , lo cuales, garantizarán una correcta fijación de la pieza (4) en todo su volumen y evitan la micromovilidad. Para comprobar la geometría y tamaño de los pinchos, se realizan perforaciones cilíndricas (9) y (10) , en las paredes planas de las piezas que representa el hueso femoral (1) y la tibia (2) . Por último, en la pieza que simula la tibia (2) , se practica una perforación en forma de ala delta (11) , la cual, permite la correcta inserción de la quilla tibial (12) . Las curvaturas dispuestas en los cóndilos (13) de la pieza femoral (3) , se adaptan a la parte superior (bandeja tibial) , de la pieza tibial (4) y su encaje es perfecto para permitir su rotación y deslizamiento, el cual, mantendrá siempre el contacto en todos los ángulos de flexión. Se disponen cajeados (14) en los extremos de cada cóndilo (13) para permitir su correcta fijación al útil con el cual se usará en la inserción de la pieza en el hueso. Las piezas femoral (3) y tibial (4) modeladas en 3D por la herramienta CAD, se exportaron para su fabricaron aditiva en FDM con filamento ULTEM™ 1010 biocompatible y adaptada a la impresora Fortus 450MC. Para este trabajo, se usó una boquilla tipo T 14 (0.254 mm) ; para el material de soporte se usó un tipo de boquilla T 16 (0.254 mm) . A la finalización de la impresión, se pulen las superficies hasta alcanzar la rugosidad requerida. El conjunto protésico modelado en 3D se exportó a la herramienta de simulación FEM (ANSYS/Academic Research de ANSYS Inc., Houston, PA, USA) , donde se analizaron en base a la norma ISO 14243-3:2009, la cual sugiere tener en cuenta las distribuciones de cargas para diferentes ángulos de flexión: 0°, 30°, 60°, 90° y, 120°. Para cada ángulo se llevó a cabo un análisis estático estructural considerando un contacto tipo rugoso entre las dos piezas aplicando un coeficiente de fricción de 0, 04. Se simuló una carga axial de 2000N, aplicada a la parte superior de la superficie de la pieza tibial, donde se encuentra el contacto entre los cóndilos femorales y la bandeja tibial. Para comprobar la bioactividad del material, se realizan varios ensayos sobre materiales no metálicos. En la tabla 1, se recogen las descripciones de los materiales usados en el ensayo. Tabla 1. Datos de materiales y fabricantes usados en el ensayo de viabilidad celular. Se aplican cultivos de células primarias osteoblasticas humanas (COPH, células adquiridas a la empresa PROMOCELL como HOB®) . Para dicho estudio de viabilidad celular, COPH se cultivaron en medios osteogénicos y se realizaron ensayos de viabilidad/citotoxicidad a 7 días. En este ensayo, denominado LIVE/DEAD, las células muertas se marcan con EthD-1 y las vivas con Cal-ceína AM. Como control negativo, ntes del proceso de mareaje, se incubaron cultivos de COPH con metanol al 70% durante 30 minutos. Como control positivo se usaron cultivos de COPH sin ningún tratamiento. En primer lugar, se eliminó el medio de cultivo, posteriormente se lavaron con PBS y finalmente se añadió la solución de marcaje. Después de una incubación de 30 minutos a temperatura ambiente, se observaron bajo microscopía de fluorescencia. Para el análisis de la intensidad de las distintas fluorescencias se usó el software ImageJ, realizándose para su representación la relación entre ambos marcadores. Según los resultados obtenidos y presentados en la figura 2, todos los materiales estudiados no interfieren en el crecimiento y viabilidad celular de osteoblastos humanos, siendo materiales óptimos para futuros ensayos de bioactividad en cultivos con osteoblastos humanos. Esta conclusión se apoya en la comparación entre el control positivo y los distintos cultivos para cada material. En detalle, se observa que el material ULTEMtm1010 tiene un interesante efecto positivo en la viabilidad celular de las COPH cuando comparamos este tratamiento con los controles positivos, destacando con una ratio por encima de 6. APLICACIÓN INDUSTRIAL El conjunto protésico no metálicos objeto de la invención proporciona una alternativa válida a pacientes sensibles a metales. En particular, la prótesis completa de rodilla descrita ofrece una solución a los fabricantes de marcas comerciales de este tipo de productos, los cuales, no ofertan debido a su escasa producción y logística. El modelo descrito es compatible con el fabricante Str y ker con ligeras diferencias que la hacen más fácil de implantar ya que sólo presenta dos piezas: una femoral y otra tibial. Al basarse en un material certificado para su uso médico facilita su garantía de seguridad y, se ha complementado con un estudio de viabilidad celular para garantizar que no sólo exista pérdida ósea, sino que pueda generarse hueso a su alrededor.
Publicaciones:
ES2936558 (17/03/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
ES2936558 (18/09/2023) - B2 Patente de invención con examen
Eventos:
En fecha 17/09/2021 se realizó Registro Instancia de Solicitud
En fecha 17/09/2021 se realizó Admisión a Trámite
En fecha 17/09/2021 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 20/09/2021 se realizó Superado examen de oficio
En fecha 14/07/2022 se realizó Realizado IET
En fecha 18/07/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 19/09/2022 se realizó PETEX_Petición de examen sustantivo
En fecha 17/03/2023 se realizó Publicación Solicitud
En fecha 17/03/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 03/07/2023 se realizó Validación petición y/o pago de examen sustantivo conforme
En fecha 04/09/2023 se realizó Designación de Comisión de Expertos
En fecha 04/09/2023 se realizó Finalización de Examen Sustantivo
En fecha 04/09/2023 se realizó 6121P_Comunicación finalización de examen sustantivo
En fecha 08/09/2023 se realizó Publicación finalización de examen sustantivo
En fecha 11/09/2023 se realizó Concesión con examen sustantivo
En fecha 11/09/2023 se realizó Entrega título
En fecha 11/09/2023 se realizó 6125P_Notificación de concesión con examen sustantivo
En fecha 18/09/2023 se realizó Publicación concesión Patente
En fecha 18/09/2023 se realizó Publicación Folleto Concesión
En fecha 18/03/2024 se realizó Plazo expirado presentación de oposiciones contra la concesión de la Patente
Pagos:
17/09/2021 - Pago Tasas IET
03/10/2023 - Pago 03 Anualidad
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 27/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869
El registro de patente nacional por PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869 fue solicitada el 17/09/2021. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869 fue solicitada por UNIVERSIDAD DE CÁDIZ. El registro [modality] por PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869 está clasificado como A61F 2/38 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes A61F 2/38.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869 está clasificado con la clasificación A61F 2/38 por lo que si se desea conocer más registros con la clasificación A61F 2/38 clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR). Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61
Es posible conocer todas las patentes registradas en la clase A61 (CIENCIAS MEDICAS O VETERINARIAS; HIGIENE) entre las que se encuentra la patente PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61F
Es posible conocer todas las patentes registradas en la clase A61F (FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVIT) entre las que se encuentra la patente PRÓTESIS MECÁNICA BIOCOMPATIBLE PARA ARTROPLASTIA TOTAL DE RODILLA (ATR) con el número P202130869. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202130577
P202130577