- Home /
- Publicaciones de patentes /
- Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma
Patente nacional por "Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma"
Este registro ha sido solicitado por
Persona física
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 06/07/2022
- Número solicitud:
-
P202230615
- Número publicación:
-
ES2958166
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
- Clasificación Internacional de Patentes:
- C12G 1/00,A01P 1/00
- Clasificación Internacional de Patentes de la publicación:
- C12G 1/00,A01P 1/00
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2958166_A11. Método de tratamiento con agua activada por plasma (AAP) de materiales auxiliares de origen forestal para la conservación del vino para la desinfección y/o descontaminación de los mismos, que comprende poner en contacto el material que va a desinfectarse y/o descontaminarse con AAP. 2. Método según la reivindicación 1, caracterizado porque la etapa de puesta en contacto del material que va a desinfectarse y/o descontaminarse con AAP se realiza de continuo durante un mínimo de 3 horas. 3. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque se obtiene una reducción de anisoles en el material sometido a descontaminación con AAP. 4. Método según la reivindicación 3, caracterizado porque se obtiene una reducción de TCA (2, 4, 6-tricloroanisol) . 5. Método según la reivindicación 4, caracterizado porque se obtiene una reducción de TCA de al menos el 50%. 6. Método según la reivindicación 5, caracterizado porque se obtiene una reducción de TCA de al menos el 75%. 7. Método según cualquiera de las reivindicaciones 3 a 6, caracterizado porque el material que se somete a descontaminación mediante contacto con AAP consiste en corchos para botellas de vino. 8. Método según cualquiera de las reivindicaciones 1 a 2, caracterizado porque comprende una etapa previa de limpiar el material que va a desinfectarse y/o descontaminarse mediante agua a presión inmediatamente antes de la etapa de puesta en contacto continua con AAP. 9. Método según la reivindicación 8, caracterizado porque el agua a presión usada en la etapa de limpieza es AAP. 10. Método según cualquiera de las reivindicaciones 1, 2, 8 o 9, caracterizado porque se aplica a recipientes de madera y se obtiene una reducción de Brettanomyces. 11. Método según la reivindicación 10, caracterizado porque se obtiene una reducción de Brettanomyces de al menos 1 log con respecto al recipiente de madera antes del tratamiento. 12. Método según la reivindicación 11, caracterizado porque se obtiene una reducción de Brettanomyces de al menos 3 log con respecto al recipiente de madera antes del tratamiento. 13. Método según cualquiera de las reivindicaciones 10 a 12, caracterizado porque se aplica a barricas de madera. 14. Método según la reivindicación 13, caracterizado porque la etapa de puesta en contacto continua de la barrica de madera con AAP se realiza llenando todo el volumen de la barrica con AAP. 15. Método según la reivindicación 13, caracterizado porque la etapa de puesta en contacto continua de la barrica de madera con AAP se realiza introduciendo un volumen mínimo de AAP en la barrica y haciendo girar la barrica de manera continua de modo que el AAP entre en contacto con toda la superficie interior de la misma. 16. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque comprende la etapa previa de producir AAP mediante la aplicación de plasma a agua de partida, usando aire como gas de plasma, un flujo de gas de plasma de 60 slm, una potencia de plasma de 500 W. 17. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque comprende la etapa previa de producir AAP mediante la aplicación de plasma a agua de partida, donde el tiempo de tratamiento del agua de partida con plasma es de entre 1, 5 min y 30 min. 18. Método según la reivindicación 16 o 17, caracterizado porque el tiempo de tratamiento del agua de partida con plasma es de 5 min. 19. Método según cualquiera de las reivindicaciones 16 a 18, caracterizado porque el agua de partida es agua destilada. 20. Método según cualquiera de las reivindicaciones 16 a 18, caracterizado porque el agua de partida es agua de red. 21. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada tiene un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV. 22. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada comprende una concentración de NO3" de más de 3 mg/l y una concentración de NO2" de más de 0, 5 mg/l. 23. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada comprende una concentración de OH* de más de 8 g/l. 24. Método según la reivindicación 23, caracterizado porque el AAP empleada comprende una concentración de OH* de más de 23 g/l. 25. Uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. 26. Uso del agua activada por plasma (AAP) según la reivindicación 25, donde el AAP empleada tiene un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV. 27. Uso del agua activada por plasma (AAP) según la reivindicación 25 o 26, donde el AAP empleada comprende una concentración de NO3" de más de 3 mg/l y una concentración de NO2" de más de 0, 5 mg/l. 28. Uso del agua activada por plasma (AAP) según cualquiera de las reivindicaciones 25 o 27, donde el AAP empleada comprende una concentración de OH* de más de 8 g/l, preferiblemente de más de 23 g/l.
Los productos y servicios protegidos por este registro son:
C12G 1/00 - A01P 1/00
Descripciones:
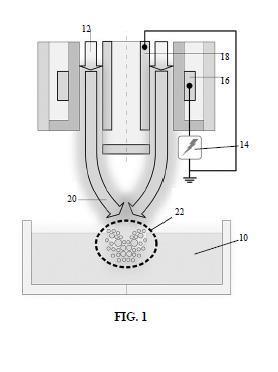
+ ES-2958166_A1 MÉTODO DE TRATAMIENTO CON AGUA ACTIVADA POR PLASMA DE MATERIALES AUXILIARES DE ORIGEN FORESTAL PARA LA CONSERVACIÓN DEL VINO Y USO DEL AGUA ACTIVADA POR PLASMA Campo de la invención La presente invención se refiere de manera general al campo de la producción del vino, y más concretamente se refiere a un método de tratamiento para la desinfección y/o descontaminación de materiales de origen forestal empleados en la conservación del vino con vistas a la preservación de su calidad y seguridad alimentaria. Antecedentes de la invención La industria del vino es uno de los sectores agroalimentarios más importantes de España y del sur de Europa. Según las estadísticas actuales (Informe Estadístico de la OIV, 2018, www.oiv.int) , España produce aproximadamente 44 millones de hectolitros de vino, ocupando la tercera posición tras Italia y Francia. Además, cuenta con la mayor superficie vitivinícola del mundo (13% del total) . La constante necesidad de innovación en el sector vitivinícola para satisfacer las demandas de los consumidores ha generado una fuerte competitividad en el mercado. Por otro lado, la creciente demanda de productos naturales está planteando a la industria alimentaria, y por tanto a la industria del vino, el reto de proporcionar alimentos seguros, saludables y mínimamente procesados. La evolución organoléptica de los vinos se ve muy favorecida cuando se utilizan barricas de roble para su elaboración y crianza. Los consumidores, cada vez más exigentes, demandan vinos equilibrados y con una aromática compleja. Esto se consigue con la crianza en barricas, ya que se producen una serie de intercambios vino/madera que enriquecen en aromas y sensaciones gustativas el vino favoreciendo una microoxigenación lo que le provoca una estabilidad tanto física como química. Aunque una barrica usada pierde potencial con respecto a una nueva, es perfectamente válida para su utilización en la elaboración de vino y productos alcohólicos a un coste menor. Por tanto, un buen mantenimiento de las mismas es imprescindible para su reutilización. Las contaminaciones icrobiológicas o químicas son los principales problemas que acontecen durante la crianza del vino, el cual se puede alterar o incluso volver inapropiado para consumo cuando se desarrolla una flora indeseable (primeros 8 mm de la madera en contacto con el vino) . Este hecho se ve agravado con la reutilización de barricas mal mantenidas, pudiendo dar lugar a la aparición del "picado acético", el carácter fenolado o "Brett", el "picado láctico", la "enfermedad de la grasa" o la "enfermedad del amargor". A. Palacios et al., Enólogos. 77 (2012) 46-54. Por otro lado, durante la crianza, los depósitos de tartrato formado quedan adheridos a las paredes internas de la barrica, sirviendo de refugio a cepas microbianas potencialmente contaminantes que pueden llegar a bloquear su estructura porosa. Se ha establecido que un volumen de vino nada despreciable, de unos 5 litros, es retenido en los primeros milímetros de las duelas en una barrica de 225 litros. Además, la penetración de los microorganismos en profundidad se ve favorecida por la estructura microporosa de la madera. Todo ello dificulta las tareas de limpieza y desinfección de las barricas. Esto resulta especialmente crítico en el caso de la contaminación por la levadura Brettanomyces o "Brett", causante del carácter fenolado del vino, con descriptores típicos como plástico, goma quemada, cuadra, sudor de caballo, etc. Esta problemática sensorial es un tema muy tratado en la actualidad y afecta especialmente a vinos de crianza o vinos que pasan tiempo en barrica. A. Palacios et al., Enólogos. 77 (2012) 46-54 En cuanto a los corchos empleados para tapar las botellas de vino, estos son propensos a la formación de TCA (2, 4, 6-tricloroanisol) , lo cual se conoce habitualmente como la enfermedad del corcho y afecta al 4% de los vinos embotellados en todo el mundo. El TCA es una molécula que se forma mediante un proceso químico como consecuencia de la presencia de clorofenoles. Éstos están presentes en el ambiente, siendo el alcornoque y los suelos de los bosques algunos de los lugares más frecuentes donde encontrarlos. Es por ello que los corchos son la principal fuente de TCA por la que el vino adquiere características negativas; sin embargo, este proceso se puede desencadenar en diferentes etapas de la producción del vino debido a que los clorofenoles forman parte, además, de los ambientes húmedos característicos de las bodegas. Este problema es de los más relevantes en la industria del vino, pues una vez que este último adquiere las características organolépticas propias del TCA, es imposible eliminarlas por lo que se produce una respuesta de rechazo en el consumidor. En 2017 Laithwaite's Wine llevó a cabo un estudio en el cual se observó que, en Gran Bretaña, se desperdician 624 millones de botellas de vino al año. El estudio citó diferentes causas tales como falta de conocimiento por parte de los consumidores sobre la conservación del vino o defectos organolépticos en el mismo. En este sentido, se ha observado que la causa principal por la cual las características organolépticas del vino se ven disminuidas está relacionada con olores desagradables en el corcho. Éstos tienen diferentes orígenes, pero el más extendido es la contaminación de los corchos por compuestos clorados, en particular el tricloroanisol (TCA) , responsable de casi el 80% de estos problemas. Por otro lado, la industria del vino es un cliente fundamental de la industria del corcho. La pérdida de participación del mercado del tapón de corcho en comparación con cierres alternativos implica la necesidad de revalorizar la industria del corcho, que transmite en su producto los beneficios intrínsecos del respeto al medio ambiente y la responsabilidad social. La Península Ibérica domina la producción mundial de corcho y España representa el 30% (506.000 Ha de bosques de alcornoques) . Uno de los desafíos de la mejora para la industria del corcho es la disminución en la incidencia de compuestos organoclorados que contribuyen con aromas desagradables al vino. El interés por eliminar esta desviación organoléptica y sus causas se justifica por la incidencia económica que supone para el sector del corcho y la industria enológica. Hasta ahora, la aplicación de agua a altas temperaturas o el uso de conservantes químicos no han sido lo suficientemente efectivos para eliminar el problema. Para resolver los problemas anteriores, se conocen en la técnica varios métodos de tratamiento de productos de origen forestal relacionados con la producción y conservación del vino, con vistas a su mantenimiento y reutilización continua. Una de las prácticas más utilizadas en bodega para la desinfección de barricas es el tradicional mechado de azufre, ya utilizado en la época de los romanos. Este método consiste en el prendido de una pastilla de azufre dentro de una barrica vacía cuya combustión produce el dióxido de azufre, compuesto con efectos biocidas sobre la madera. Esta práctica ayuda a mantener el parque de barricas de una bodega libre de cualquier microorganismo que pueda alterar el vino. Sin embargo, la aparición de la Directiva 98/8/CE2 de la Comisión Europea prohíbe el uso del dióxido de azufre para las labores de desinfección de barricas. Esta directiva ha propiciado la búsqueda urgente de nuevas soluciones de desinfección que permitan llevar a abo esta tarea de forma viable desde un punto de vista económico y operativo. En España existe un acuerdo de moratoria sobre la prohibición del uso del mechado sulfuroso hasta 2025. Este escenario ha propiciado la aparición de nuevas tecnologías alternativas para la desinfección de las barricas (térmica, por ozono, por cavitación o por chorro de arena) . Sin embargo, ninguna de ellas ha sido capaz de dar respuesta de manera adecuada a las necesidades del sector y son potencialmente contaminantes en diferentes aspectos. La desinfección no equivale a la esterilización (total eliminación de gérmenes) , sino que supone la destrucción de gérmenes viables para reducir en profundidad las poblaciones residuales mediante la acción química y/o física. En este sentido, pueden establecerse dos categorías relativas a los nuevos métodos alternativos de desinfección de barricas (alternativos al mechado de sulfuroso) : por vías químicas o físicas. Métodos químicos: se realizan mediante agentes acidificantes como el dióxido de azufre, empleado en forma líquida sobre el vino en solución de metabisulfito de sodio y en forma gaseosa sobre la madera y el vino, mediante combustión de azufre (método más utilizado y comentado anteriormente) o la utilización de gas licuado. También pueden emplearse peróxido de hidrógeno, ácido peracético, permanganato de potasio y ozono (O3) . En relación con el ozono, hay que destacar que es un gas muy oxidante, tóxico y explosivo. Su utilización sólo es posible tras su disolución en agua fría para producir una solución de ozono activo que contenga entre 3 y 5 mg/l de O3. El ozono es desinfectante, pero no tiene propiedades limpiadoras. Teniendo en cuenta su modo de actuación, es indispensable emplearlo sobre superficies perfectamente limpias para poder desinfectar. En el caso de recipientes de madera, reacciona parcialmente con respecto al ozono lo cual limita su acción en profundidad. Métodos físicos: el método físico más empleado es el térmico. En este caso, se emplean generadores de agua caliente móviles, que pueden producir agua a 80-90°C a entre 80 y 210 bares. La utilización a temperaturas más altas es ilusoria, ya que en tal caso los caudales son muy débiles. Una presión de 100-120 bares es suficientemente respetuosa con la madera. Esta tecnología permite limpiar sin detergentes, pero su eficacia desinfectante se limita a la superficie de la madera. El aumento de la temperatura de sus capas más profundas (transmitida por el vapor de agua a 105°C) es muy lento ya que la onductividad térmica de la madera es muy baja. Para que esta tecnología sea eficaz, los tratamientos deben ser muy prolongados en el tiempo. Este es un aspecto muy limitante, puesto que, como ya se mencionó anteriormente, los microorganismos pueden penetrar más de 8 mm en el interior de la madera. Según lo anterior y teniendo en cuenta las distintas superficies que pueden estar en contacto con el vino durante su elaboración, puede considerarse que los tratamientos térmicos pueden ser eficaces en superficies de acero o vidrio (con rugosidad prácticamente nula) , pero no con las superficies de origen forestal, como por ejemplo la madera y el corcho (con rugosidad y porosidad muy altas) . Otro método posible es el tratamiento electromagnético por microondas, que permite el calentamiento de la madera a través de la excitación del agua contenida en el material. La selección de la longitud de onda permite calentar la madera desde el centro de las duelas con poca energía; mientras que la forma y disposición del magnetrón y la rotación de la barrica permiten una irradiación homogénea dentro de la caja metálica de Faraday que refleja las ondas. Por otro lado, en la aplicación de ultrasonidos se introduce un sonotrón dentro de la barrica llena de agua a 60°C reciclada; y los ultrasonidos (150 kHz) producen en la superficie de la madera y en los primeros milímetros altas presiones al nivel microscópico (>2000 bares) por cavitación del agua, eliminando los compuestos que impregnan la madera y destruyen los microorganismos al mismo tiempo que se provoca su desinfección. Otros métodos físicos menos frecuentes son la proyección de hielo seco (eficiente y rápido, pero también caro y no garantiza la desinfección al nivel de profundidad de las duelas) y el empleo de oxígeno negativo. Todos estos métodos se han estudiado a nivel científico y sometido a pruebas industriales, pero ninguno de ellos ha podido mejorar los resultados de desinfección obtenidos mediante el mechado de sulfuroso. Por otro lado, el coste de instalación y de tiempo de procesado de alguna de estas tecnologías (por ejemplo, ultrasonidos y microondas) es ciertamente prohibitivo. Otro método de desinfección conocido es el plasma atmosférico frío. Aunque se ha realizado algún estudio sobre su aplicación directa a productos de madera tales como barricas, nunca se ha aplicado a nivel industrial. El plasma es el cuarto estado de la materia. Está compuesto por iones positivos y negativos, electrones, átomos excitados y neutros, radicales libres, moléculas en los estados fundamental y excitado y fotones UV. El plasma puede clasificarse en plasma térmico (caliente) y plasma no térmico (frío) según el equilibrio ermodinámico de temperatura de sus constituyentes. La temperatura del plasma frío nunca supera una temperatura de 100°C. Algunas de las fuentes de plasma no térmicas ampliamente utilizadas para aplicaciones alimentarias son las descargas de barrera dieléctrica (DBD) , los chorros de plasma y las descargas de corona. En los últimos años, muchos científicos e investigadores han empleado plasma frío en varias aplicaciones alimentarias: desinfección microbiana, inactivación enzimática, mejora de la calidad de cocción de variedades de arroz, modificación del almidón, mejora de la germinación de semillas, etc. (véase, por ejemplo, R. Thirumdas et al., "Cold Plasma: A novel Non-Thermal Technology for Food Processing", Food Biophys. 10 (2014) 1-11) . La mayoría de los estudios sobre la actividad antimicrobiana del plasma se han realizado aplicando el plasma directamente sobre los alimentos o superficies que lo contienen. No obstante, existen ocasiones en las que la aplicación directa de una fuente de plasma no es técnicamente factible o no es industrialmente rentable. Este es el caso, por ejemplo, del tratamiento por plasma del interior de una barrica, en la que, para poder introducir el equipo de plasma en su interior, habría que desmontar, al menos, uno de sus frentes. Esto resulta prácticamente inviable en una bodega. Recientemente se ha empezado a estudiar el uso de agua activada por plasma (AAP) como agente desinfectante, en lugar de aplicar directamente plasma frío o caliente. Tal como se detallará más adelante en el presente documento, el AAP contiene especies reactivas de nitrógeno y oxígeno de reconocida actividad antimicrobiana que se generan cuando se pone el plasma en contacto con el agua (especies reactivas primarias) o a partir de la posterior interacción de dichas especies reactivas primarias en reacciones secundarias (especies reactivas secundarias) . Por ejemplo, en los documentos CN212456771U, RU2746976C1 y ES2314000T3 se dan a conocer dispositivos para la producción de AAP. Sin embargo, ninguno de estos documentos enseña ni sugiere el uso del AAP producida para la desinfección de superficies de materiales de origen forestal. Existen muy pocas publicaciones sobre el empleo de AAP para descontaminar superficies. En Joshi et al ("Characterization of Microbial Inactivation Using Plasma-Activated Water and Plasma-Activated Acidified Buffer", J. Food Prot. 81 (2018) 1472-1480) se estudia el uso de AAP para la desinfección de portaobjetos de vidrio inoculado con Enterobacter aerogenes. En Kamgang-Youbi et al ("Microbial decontaminaron of stainless steel and polyethylene surfaces using GlidArc plasma activated water without chemical additives", J. Chem. Technol. Biotechnol. 93 (2018) 2544-2551) se confirmó la eficacia del AAP para la descontaminación superficial de acero inoxidable AISI304 y PET de alta densidad, contaminados con Saccharomyces cerevisiae, Staphylococcus epidermidis, Leuconostoc mesenteroides y Hafnia alvei. No obstante, no se conoce ningún estudio que haya aplicado satisfactoriamente AAP para la desinfección y descontaminación de materiales rugosos y porosos, y más concretamente de materiales de origen forestal tales como madera y corcho. Por otro lado, los documentos ES2423255B1, ES2268459T3, ES2402890T3, ES2019562A6, ES2726598B2, ES2247180T3, por ejemplo, dan a conocer diversos métodos de tratamiento de productos de corcho, tales como tapones de botellas, por ejemplo, para la reducción del contenido en TCA. Sin embargo, todos estos métodos se basan en el uso de altas temperaturas, altas presiones, largos periodos de tratamiento y/o uso de recipientes en rotación continua. Sin embargo, las altas presiones y temperaturas pueden provocar efectos adversos, tales como distorsiones irreversibles en los tapones, tal como se indica, por ejemplo, en el documento ES2423255B1. Por su parte, los largos periodos de tratamiento y la puesta en rotación de los recipientes (así como también el uso de altas presiones y temperaturas) provocan un aumento de los costes de implementación y, por tanto, una reducción de la rentabilidad del procedimiento. Por tanto, sería deseable disponer de un método alternativo para el tratamiento de desinfección y/o descontaminación de materiales y productos auxiliares para la elaboración y conservación del vino, y más específicamente de productos de origen forestal, tales como madera y corcho. En concreto, sería deseable disponer de un método alternativo al mechado sulfuroso que produzca unos resultados al menos iguales o mejores que el mismo, pero supere sus inconvenientes, concretamente que evite los problemas tóxicos derivados del uso de dióxido de azufre. Asimismo, sería deseable que dicho método no produzca efectos adversos sobre los materiales tratados (corchos y madera) , tales como deformaciones irreversibles, al tiempo que reduzca los costes económicos asociados con su implementación en comparación con alternativas conocidas en el estado de la técnica tal como se mencionó anteriormente. Sumario de la invención Para superar los problemas anteriormente mencionados, la presente invención propone un nuevo método de tratamiento de materiales auxiliares de origen forestal usados para la conservación del vino, con el fin de desinfectarlos y/o descontaminarlos con vistas a la preservación de su calidad y seguridad alimentaria. En concreto, el método se basa en poner el material que va a desinfectarse y/o descontaminarse en contacto con agua activada por plasma (AAP) . La presente invención también propone un uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. En las reivindicaciones dependientes adjuntas se describen realizaciones preferidas del método de tratamiento y del uso del AAP de la presente invención. Breve descripción de las figuras La presente invención se entenderá mejor con referencia a los siguientes dibujos que ilustran una realización preferida de la invención, proporcionada a modo de ejemplo, y que no debe interpretarse como limitativa de la invención de ninguna manera. La figura 1 muestra de manera esquemática un sistema de producción de agua activada por plasma para su uso en un método según la realización preferida de la presente invención. La figura 2 representa esquemáticamente las etapas de desinfección de una barrica de madera según varias realizaciones preferidas de la presente invención. La figura 3 muestra los cromatogramas de muestras de AAP tratadas durante diferentes periodos de tiempo, en los que se observan los productos de reacción con fenol relativos a cada una de las especies reactivas en las muestras de AAP. La figura 4 muestra la superposición del pico del producto de reacción con fenol del radical hidroxilo OH* a partir de los cromatogramas de cuatro muestras de AAP. La figura 5 es un gráfico de barras que representa el crecimiento logarítmico de células viables de Brettanomyces por gramo de madera de duelas contaminadas tratadas con agua estilada (AD) y con diversas muestras de AAP según la presente invención. Las distintas letras indican diferencias estadísticamente significativas (p < 0, 05) . La figura 6 es un gráfico de barras que representa la concentración media de TCA (ng/l) de corchos contaminados artificialmente, tratados con agua destilada (AD) y con diversas muestras de AAP según la presente invención. Las distintas letras indican diferencias estadísticamente significativas (p < 0, 05) . Descripción detallada de las realizaciones preferidas Tal como se mencionó anteriormente, la presente invención se basa en el uso de agua activada por plasma (AAP) para el tratamiento de desinfección y/o descontaminación de materiales auxiliares de origen forestal destinados a la elaboración y conservación del vino. La tecnología de AAP presenta numerosas ventajas respecto de los actuales métodos de desinfección y/o descontaminación. En primer lugar, se trata de una tecnología de bajo coste, pues únicamente consume electricidad y aire comprimido para la generación del plasma en muchos casos y no precisa de productos químicos, filtros u otros materiales consumibles. Además, se genera a presión atmosférica y temperatura ambiente, por lo que no se requieren instalaciones auxiliares. Por otro lado, se puede aplicar con los actuales sistemas de lavado de barricas (lanzas de agua a presión) , por lo que se pueden limpiar e higienizar al mismo tiempo, proporcionando un ahorro de agua, energía y tiempo de proceso. Por último, es una tecnología respetuosa con el medio ambiente ya que no se producen productos químicos tóxicos o de desecho. Sin embargo, se trata de una tecnología emergente que aún no se ha estudiado mucho ni aplicado a nivel industrial. Concretamente, no se conoce ninguna publicación que mencione el uso de AAP para desinfectar superficies de madera u otros materiales de origen forestal. Los líquidos activados por plasma se generan al poner en contacto (directa o indirectamente) una fuente de plasma con un líquido. Esta interacción produce una generación y/o transferencia de especies químicas reactivas al líquido. Las soluciones activadas por plasma se pueden utilizar como soluciones desinfectantes para su aplicación en las industrias alimentarias. El líquido activado por plasma más estudiado es el agua activada por plasma (AAP) . En numerosas publicaciones se han demostrado sus efectos ntibacterianos (véase, por ejemplo, M.J. Traylor et al., "Long-term antibacterial efficacy of air plasma-activated water", J. Phys. D. Appl. Phys. 44 (2011) 472001) . El AAP posee una composición y propiedades fisicoquímicas diferentes a las del agua. De forma habitual presenta un pH ácido, cambios en el potencial redox y conductividad y presencia de especies reactivas de oxígeno (ROS) y nitrógeno (RNS) (A. Mai-Prochnow et al., "Microbial decontamination of chicken using atmospheric plasma bubbles", Plasma Process. Polym. (2020) ) . La capacidad antimicrobiana del AAP se produce mediante varios procesos: [a] fase gaseosa: formación de especies reactivas en fase gaseosa por la interacción de las partículas cargadas (electrones, neutrones, etc.) y la radiación ultravioleta con el gas del plasma y la atmósfera circundante, [b] fase de gas-líquido: dilución en el agua de las especies químicas reactivas generadas en fase gaseosa o las generadas por la interacción plasma-líquido, especialmente aquellas que tienen una vida útil relativamente larga, como el ozono, oxígeno atómico u óxido nítrico que actúan como precursores de otros ROS y RNS, como el peróxido de hidrógeno, los nitratos o los nitritos y [c] fase líquida: reacciones secundarias de las especies reactivas de larga vida, originadas, por ejemplo, por la inestabilidad de los nitritos en medio ácido. Estas reacciones cíclicas justifican la presencia durante días de especies reactivas muy citotóxicas de corta vida, por ejemplo, radicales hidroxilo (OH*) , nitritos acidificados (NO*, NO2*) y peroxinitritos (O=NOOH) . Algunas de las especies químicas más biocidas del AAP (OH*, NO*, NO2* y O=NOOH) se generan una vez la fuente de plasma se ha apagado (ECV, especies reactivas de "corta vida") . Las ECV pueden producirse durante la generación del AAP (cuando el plasma se pone en contacto con la atmósfera y el agua) pero poseen una vida tan corta (del orden de milisegundos) que su presencia en el AAP no puede deberse a su dilución en al agua. Las ECV que finalmente se encuentran en el AAP se generan a partir de reacciones de las especies reactivas de "larga vida" (peróxido de hidrógeno, nitratos y nitritos) producidas en el AAP una vez se ha apagado la fuente de plasma. Las ECV producto de estas reacciones secundarias son especies reactivas "transitorias" que poseen propiedades altamente citotóxicas y provocan una actividad antimicrobiana prolongada del AAP incluso varios días después de la exposición del agua a la descarga de plasma. Las principales reacciones secundarias se originan debido a que los nitritos no son estables n condiciones ácidas (pH < 3, 5) . A continuación, se presentan los esquemas de las principales reacciones secundarias que tienen lugar en el AAP. El ácido nitroso (HNO2) , que se encuentra en equilibrio ácido-base con los nitritos [a], se descompone en condiciones ácidas para dar radical óxido nítrico (NO*) y radical dióxido de nitrógeno (NO2*) a través de la reacción [b]. El radical dióxido de nitrógeno (NO2*) experimenta además hidrólisis en medio acuoso para producir ion nitrito (NO2-) como producto final a través de la reacción [c]. El NO* y el NO2* también pueden reaccionar con el oxígeno disuelto para producir iones de nitrito (NO2-) y nitrato (NO3-) de acuerdo con las reacciones generales [d] y [e], respectivamente. Los radicales de nitrógeno NO* y NO2* formados en estas reacciones secundarias poseen fuertes propiedades citotóxicas y son probablemente una de las principales causas de los efectos citotóxicos de los nitritos en condiciones ácidas. Por esta razón, se denominan "nitritos acidificados". Además, en condiciones ácidas, la reacción de los nitritos (NO2-) con el peróxido de hidrógeno (H2O2) puede generar peroxinitritos (O=NOOH) [f]. Los peroxinitritos pueden reaccionar directamente con los microorganismos o indirectamente mediante su descomposición en OH* y NO2* [g]. Esta es una de las vías de generación de los radicales hidroxilo (OH*) . NO2- + H+ ~ HNO2 [a] 2 HNO2 ^ NO* + NO2* + H2O [b] 2 NO2* + H2O ^ NO3- + NO2- + 2 H+ [c] 4 NO* + O2 + 2 H2O ^ 4 NO2- + 4 H+ [d] 4 NO2* + O2 + 2 H2O ^ 4 NO3- + 4 H+ [e] NO2- + H2O2 + H+ ^ O=NOOH + H2O [f] O=NOOH ^ OH* + NO2* [g] La formación de nitritos acidificados (NO* y NO2*) y radicales OH* mediante reacciones secundarias, son la clave de las propiedades biocidas del AAP prolongadas en el tiempo. Radical hidroxilo (OH*) Los radicales OH* son probablemente las especies reactivas más importantes producidas por el tratamiento con plasma de soluciones acuosas. Pueden oxidar de forma no selectiva la mayoría de los compuestos orgánicos con los que entran en contacto y, por recombinación de radicales, son la principal fuente de peróxido de hidrógeno en los sistemas de plasma. En relación con su capacidad biocida, la parte más afectada por los adicales OH* es la pared celular externa de los microorganismos, incluida la membrana celular. La membrana celular, compuesta en gran parte por compuestos orgánicos como lípidos, proteínas y polisacáridos, es susceptible al ataque de los radicales OH*. Los lípidos son las macromoléculas de la membrana celular más vulnerables a la oxidación. Las reacciones de los lípidos con los radicales OH* se producen por la extracción de H de los enlaces de carbono insaturados de los ácidos grasos, que en presencia de oxígeno provocan la peroxidación de los lípidos. De manera similar, los radicales OH* pueden dañar las proteínas de la membrana mediante la abstracción de H del carbono a de los enlaces peptídicos -CO-NH- entre los aminoácidos de cadena unidos a péptidos. El ataque de los radicales OH* conduce a la peroxidación y escisión de la columna vertebral de las proteínas. El efecto combinado de estas afecciones conduce a la muerte celular. Radicales NO* y NO2* ("nitritos acidificados") Los nitritos acidificados poseen un importante efecto antimicrobiano contra una amplia gama de organismos patógenos, incluyendo virus (como el SARS-CoV-1, SARS-CoV-2) , bacterias y hongos. Algunos de los daños que producen a los microorganismos son: oxidación de las proteínas de las membranas, reacción con las metaloenzimas, lo que provoca el consumo del hierro disponible, inactivación de las enzimas metabólicas, afección del ADN por daños oxidativos, peroxidación de lípidos que dañan las membranas celulares, etc. Estos daños multifactoriales dan como resultado severas disfunciones y, en última instancia, la muerte celular. Tal como se mencionó anteriormente, la presente invención se refiere a un método de tratamiento con agua activada por plasma (AAP) de materiales auxiliares de origen forestal, empleados en la conservación del vino, para la desinfección y/o descontaminación de los mismos. En concreto, los materiales de origen forestal que se someten a desinfección y/o descontaminación pueden seleccionarse del grupo constituido por corchos para botellas y recipientes de madera, tales como barricas de madera. En el caso de los corchos, el método según la presente invención tiene el objetivo principal de producir una reducción de los anisoles presentes en los mismos, más concretamente de TCA (2, 4, 6-tricloroanisol) . Dicha reducción de TCA es preferiblemente de, al menos, el 50%, más preferiblemente de, al menos, el 75%, con respecto a la cantidad de TCA en los corchos antes del tratamiento. En el caso de los recipientes de madera, concretamente barricas de madera, el método según la presente invención tiene el objetivo principal de reducir la cantidad de levadura, en concreto levadura Brettanomyces, en las mismas con respecto a la cantidad de Brettanomyces en los recipientes antes del tratamiento. Dicha reducción de Brettanomyces es preferiblemente de, al menos, 1 log, más preferiblemente de, al menos, 3 log con respecto al contenido en Brettanomyces de los recipientes antes del tratamiento. Más concretamente, el método de tratamiento según la presente invención comprende las etapas de: - opcionalmente, producir AAP mediante aplicación de plasma a agua de partida, - opcionalmente, limpiar el material que va a desinfectarse mediante agua a presión, e - inmediatamente después de la etapa de limpieza, si se realiza, poner en contacto de manera continua el material que va a desinfectarse y/o descontaminarse con AAP durante un periodo de tiempo suficiente para obtener un nivel de desinfección y/o descontaminación deseado del material que va a desinfectarse y/o descontaminarse, preferiblemente durante un periodo de tiempo mínimo de 3 horas. La presente invención también se refiere al uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. Tal como se mencionó anteriormente, las especies reactivas causantes del efecto desinfectante y/o descontaminante en el AAP pueden encontrarse presentes durante un periodo relativamente prolongado, por ejemplo, de varios días. Por tanto, la etapa de producción de AAP puede realizarse como parte del método según la presente invención, puede realizarse como un procedimiento independiente en la misma ubicación o incluso puede adquirirse de un proveedor comercial externo, en función de los requisitos y las limitaciones técnicas de la instalación en la que se implemente el método dado a conocer en el presente documento. Según la realización preferida de la presente invención, para generar AAP útil para su uso n el método de tratamiento dado a conocer en el presente documento se emplea un sistema de producción de agua activada por plasma atmosférico frío tal como se representa esquemáticamente en la figura 1. En la parte inferior se muestra un depósito (10) que comprende agua destilada, empleada como agua de partida que va a activarse por el plasma. El agua destilada es útil para realizar los ensayos descritos a continuación en el presente documento ya que no cuenta con el efecto biocida del cloro presente en agua de red. Sin embargo, según una realización preferida adicional de la presente invención, se usa agua de red como agua de partida para la producción de AAP. Se emplea aire (12) como gas para la producción de plasma, ya que es el gas que produce más radicales OH* y además es el más barato. El sistema consta además de un generador de potencia (14) y dos electrodos (16, 18) . Cuando el aire (12) pasa a través del sistema, se produce un flujo de plasma (20) que se proyecta sobre el depósito (10) de agua, dando lugar a las interacciones plasma-agua (22) que producen las especies reactivas mediante las reacciones químicas anteriormente descritas. Los parámetros empleados para la generación de AAP según la realización preferida de la presente invención son los siguientes: Gas de plasma: aire Flujo de gas de plasma (aire) : 60 slm Potencia de plasma: 500 W Volumen de agua tratada: 2 litros de agua destilada Tiempo de procesamiento: entre 1, 5 y 30 min La tabla 1 a continuación muestra la nomenclatura de las cuatro muestras de AAP producidas mediante los ensayos descritos en el presente documento y el tiempo durante el ual se sometió a tratamiento con plasma el agua de partida para la producción de cada una de dichas muestras: Tabla 1 Mediante ensayos que se describirán más adelante en el presente documento, se ha determinado que las características fisicoquímicas de un AAP que reduce significativamente la carga de Brettanomyces son: pH < 4, 5, CE (conductividad eléctrica) > 50 pS/cm, ORP (potencial de oxidación-reducción) > 350 mV, NO3- > 3 mg/l y NO2' > 0, 5 mg/l. Una vez producida el AAP, se procede a emplear la misma en el método de tratamiento desinfectante/descontaminante de la presente invención. Sin embargo, antes de realizar esta etapa de desinfección/descontaminación mediante puesta en contacto con AAP, conviene limpiar la superficie del material que va a desinfectarse/descontaminarse, sobre todo en el caso de aplicarse el método de tratamiento a recipientes de madera, tales como barricas de madera. La limpieza del interior de la barrica tiene como objetivo eliminar el material incrustado y los sedimentos. Ésta es una práctica habitual en las bodegas y se realiza en la actualidad antes del mechado de sulfuro. Este lavado se suele realizar con agua a alta presión empleando lanzas (24) (véase la figura 2a) . Según una realización preferida adicional de la presente invención, el agua a presión usada en la etapa de limpieza también es AAP. A continuación, se realiza la etapa de puesta en contacto continua del interior de la barrica con AAP. Preferiblemente, esta etapa de puesta en contacto con AAP (desinfección) se realiza inmediatamente después de la etapa de limpieza. El AAP se introducirá en su interior empleando el mismo agujero por el que se introdujo el agua de lavado. Para ello puede emplearse la misma lanza (24) de lavado. Para que el AAP elimine el Brettanomyces de la barrica (tal y como se indicó anteriormente, el Brettanomyces puede alcanzar 8 mm de profundidad de las paredes interiores de la arrica) , ésta debe estar un tiempo suficiente de contacto con toda la superficie interior de la misma (preferiblemente, durante un tiempo de, al menos, 3 horas) . Para ello existen dos alternativas. Según una realización preferida, tal como se muestra en la figura 2b, se llena todo el volumen de la barrica con AAP. Según otra realización preferida alternativa, mostrada en la figura 2c, se introduce un volumen mínimo de AAP en la barrica y se hace girar la barrica de manera continua, de modo que el AAP entre en contacto con toda la superficie interior de la misma. En este caso, el consumo de AAP se reduce significativamente en comparación con la realización mostrada en la figura 2b. Estos sistemas de giro de barricas son comunes en las bodegas y se emplean para vaciar el contenido de las mismas. En el caso de la aplicación del método de tratamiento según la presente invención a la reducción de TCA en corchos, la etapa de puesta en contacto continua de los corchos con AAP se realiza sumergiendo los corchos completamente en AAP en un recipiente adecuado. No se requiere ningún tipo de agitación ni movilización de los corchos, sino que el método de tratamiento es completamente estático. En cualquier caso, el método según la presente invención se realiza preferiblemente a temperatura ambiente y a presión atmosférica. Ejemplos A continuación, se describen varios ejemplos de aplicación del método de tratamiento dado a conocer en el presente documento. 1) Análisis para la cuantificación de las especies reactivas presentes en el AAP: En primer lugar, se llevó a cabo un ensayo de cuantificación de las especies reactivas presentes en cada una de las muestras de AAP preparadas tal como se describió anteriormente. La alta reactividad de las especies secundarias más biocidas presentes en el AAP (OH*, NO*, NO2* y O=NOOH) hace que su detección y cuantificación, especialmente en la fase líquida, deba realizarse de manera indirecta. Los principales métodos de detección de estas especies emplean productos químicos que reaccionan selectivamente con estos radicales ara generar productos relativamente estables que pueden detectarse espectroscópicamente por resonancia paramagnética de electrones, fluorimetría o cromatografía de líquidos de alta resolución (HPLC) . En este caso, para la detección y cuantificación indirecta de las especies reactivas presentes en el AAP se tomó como referencia el método descrito por Lukes et al ("Aqueousphase chemistr y and bactericidal effects from an air discharge plasma in contact with water: evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2 and HNO2", Plasma Sources Sci. Technol. 23 (2014) 015019) . Este método se basa en la reacción entre el fenol (C6H5-OH) y los radicales OH*, NO* y NO2*. Se prepara una solución de fenol en agua (« 2 x 10-2 M) de la que se toman 5 ml para mezclarse con 95 ml de AAP y a continuación se calienta la mezcla a 50°C durante 24 horas. Posteriormente, se filtra la solución con un disco filtrante de 0, 45 m y se somete a cromatografía de líquidos de alta resolución (HPLC) : 20 l; columna C18; fase móvil de 1, 0 ml/min usando el siguiente gradiente de elución: Tiempo total: 16 min; presión: « 90 bares a 90/10, « 60 bares a 60/40; detector DAD a 260 nm (referencia: 699 nm) . Los productos de reacción son: benzoquinona (fenol + OH*) , 4-nitrosofenol (fenol + NO*) y 2-nitrofenol (fenol + NO2*) . Los tiempos de reacción son: hidroquinona: « 5 min, 4-nitrosofenol: « 5, 4 min, fenol: « 8, 2 min y 2-nitrofenol: « 11, 2 min. Para la cuantificación de los productos de reacción (g/l) se prepararon las correspondientes rectas de calibración a partir de la identificación de los valores de absorbancia de soluciones de productos de reacción de concentraciones conocidas. Los patrones de benzoquinona y 2-nitrofenol con una pureza > 98 % se obtuvieron de Sigma-Aldrich (Madrid, España) y el patrón de 4-nitrosofenol con una pureza > 98 % se obtuvo de TCI (Tokio, Japón) . El metanol (> 99, 5 %) se adquirió de Scharlab (Sentmenat, Barcelona, España) . Se prepararon soluciones madre individuales a una concentración de 10-2 M en aguametanol (95-5) y se almacenaron en botellas de vidrio a 8°C. Las rectas de calibración se prepararon por dilución con agua desionizada con las siguientes concentraciones: benzoquinona 1, 35x10-5 M, 2-nitrofenol 1, 60x10-4 M y 4-nitrosofenol 2, 54x10-4 M. Las rectas de calibración fueron las siguientes: Se obtuvieron los cromatogramas de las diversas muestras de AAP objeto de estudio (AAP-1, 5, AAP-5, AAP-15 y AAP-30) en las que se identificaron las señales relativas a los productos de reacción con el fenol de las especies reactivas más importantes en relación con la capacidad desinfectante/descontaminante de la AAP: radicales hidroxilo (OH*; benzoquinona) , nitritos acidificados (NO*; 4-nitrosofenol y NO2*; 2-nitrofenol) y el propio fenol (figura 3) . Debido a la importancia de los radicales hidroxilo para ambas aplicaciones (desinfección de Brett en barricas de madera y reducción de TCA en corchos) , en la figura 4 se identifican con mayor detalle los cromatogramas relativos al radical hidroxilo para todas las muestras de AAP consideradas. Finalmente, se cuantificaron indirectamente (a partir de los productos de reacción con el fenol) cada una de las especies reactivas presentes mediante el método descrito anteriormente y los resultados se muestran en la tabla 2. Tabla 2. Concentración (g/l) de los productos de reacción con fenol 2) Ensayos relativos al procedimiento de desinfección de barricas: Materiales del ensayo Se emplearon barricas de madera de roble empleadas en la elaboración de vino de crianza. Las barricas estaban contaminadas naturalmente con Brettanomyces. Se desmontaron las barricas objeto de estudio y se obtuvieron porciones de duelas de 5 x 5 cm. Se determinó que la contaminación media por Brettanomyces de una muestra configurada por 4 porciones de duelas era de 4, 35 ± 0, 26 logaritmos de células viables por gramo de madera. Tratamientos aplicados Mechado de sulfuroso (tratamiento actual de referencia) : en un frasco de cristal de 4 litros de capacidad se introdujeron 3 duelas contaminadas (5 x 5 cm) . Se colgó una pastilla de azufre de 5 gramos, que se prendió con un mechero, despidiendo así vapores de SO2. Se tapó el bote herméticamente con su tapa y Parafilm y se mantuvo durante 30 minutos. Este procedimiento reproduce a escala las mismas condiciones de aplicación de esta tecnología que se realiza en la actualidad. Inmersión con AAP: Se introdujeron 3 duelas contaminadas naturalmente en recipientes respectivos con 250 ml de las AAP consideradas en el estudio. La cara correspondiente al interior de la barrica quedó totalmente sumergida hasta los 3 cm (los microorganismos penetran hasta 8 mm en el interior de la madera) . Se consideraron 5 tratamientos por inmersión: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1, 5, AAP-5, AAP-15 y AAP-30) . Ensayos realizados Análisis de la inactivación microbiana del AAP: Se marcaron las duelas contaminadas a 10 mm de la superficie tostada. Ésta es la altura a la que se estima que se encuentra todo el Brettanomyces que contamina la madera. En recipientes de plástico, se colocaron de forma independiente las duelas (un recipiente por duela) con la superficie tostada hacia abajo (la superficie correspondiente al interior de la barrica y donde se localiza el Brettanomyces) . Posteriormente se añadieron 250 ml de AAP (cada una de las 4 consideradas) y el agua destilada (que conformó las réplicas del control) . Cada muestra estaba conformada por 3 réplicas. Una vez transcurrido el tiempo de tratamiento (inmersión de 3 horas en todos los casos) , se extrajeron las duelas y se cepillaron hasta 10 mm de profundidad. Se recogieron las virutas en bolsas de plástico estériles que se habían pesado previamente. Una vez recogidas las virutas de madera, se pesaron cada una de las bolsas que las contenía para conocer el peso de virutas recogidas de cada muestra. A continuación, se colocó cada bolsa con la boca abierta dentro de un bote de conserva estéril y se añadieron 600 ml de TSB (caldo de triptona de soja, medio de recuperación) atemperado, cerciorándose de que la viruta quedaba bien empapada. Se sometieron los botes con las bolsas a agitación orbital durante 24 h a 28°C y a 80-100 rpm. Tras ese tiempo de infusión, se sacaron los botes con las virutas del orbital, respetando el orden en que se pusieron a agitar. A continuación, se extrajo el TSB infusionado de cada muestra en la cabina de flujo laminar en condiciones de asepsia. Se tamizó el medio de cultivo infusionado por un visillo estéril y se colocó en botes de centrífuga estériles. A continuación, se procedió a centrifugar las muestras a 4°C, 30 min y 10000 g. Tras la centrifugación se eliminó el sobrenadante de forma inmediata y se resuspendió el sedimento en solución de Ringer (en refrigeración conserva la viabilidad celular hasta 7 días) enrasando a un volumen de 15 ml en tubos de plástico estériles. Finalmente, se analizaron las muestras, primero realizando el tratamiento correspondiente con PMA (monoazida de propidio) y la extracción del ADN de las muestras. Una vez extraído el ADN, se realizó la PCR cuantitativa con EvaGreen, expresando los resultados de la población de Brettanomyces viables en unidades genómicas por gramo de madera (véase la figura 5) . Resultados obtenidos Como puede observarse a partir de la figura 5, el tratamiento con AAP-5 obtiene una reducción de 3, 49 log con respecto de la muestra control (tratada con agua destilada, AD) . El tratamiento con AAP-1, 5 (obtenido con 1, 5 minutos de tratamiento de agua de partida con plasma) obtiene únicamente una reducción de 1, 46 log, lo cual todavía es sin embargo mejor que el tratamiento de referencia mediante mechado de sulfuroso. Los tratamientos con AAP-15 y AAP-30 consiguen una reducción total. Según una realización preferida de la presente invención, el tratamiento con AAP-5 se considera óptimo ya que obtiene una reducción significativa de Brettanomyces (3, 49 log) . Aunque la reducción no es total, como en el caso de AAP-15 y AAP30, el consumo energético con respecto a AAP-15 es 3 veces menor (3 veces menos tiempo de tratamiento de producción de AAP) . Sin embargo, la elección de una u otra de las AAP dadas a conocer en el presente documento, todas las cuales se encuentran dentro del alcance de protección de las reivindicaciones adjuntas, dependerá de las preferencias y restricciones técnicas de la aplicación específica en la que vaya a aplicarse el método de tratamiento dado a conocer en el presente documento. 3) Ensayos relativos al procedimiento de reducción de TCA (2, 4, 6-tricloroanisol) en corchos Materiales del ensayo Se emplearon tapones de corcho 100% natural (para botellas de vino de 750 ml) . Estos corchos no presentaban contaminación por TCA. Se analizaron algunos de los corchos de la serie empleada para descartar la presencia de polihaloanisoles y polihalofenoles. El resultado fue negativo en todos los casos. Se sumergieron 4 corchos sin contaminación en recipientes respectivos de cristal de 95 gramos con 80 ml de una solución preparada con 400 ng/l de TCA. Se dispusieron los recipientes en un agitador rotativo a 50 rpm durante 5 horas. Una vez finalizado el tratamiento, se analizó individualmente cada corcho. La concentración media de TCA de los 4 corchos contaminados artificialmente fue de 26, 59 ± 1, 64 ng/l. Tratamientos aplicados para la reducción de TCA (2, 4, 6-tricloroanisol) Se consideraron 5 tratamientos por inmersión: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1, 5, AAP-5, AAP-15 y AAP-30) . Se emplearon las mismas AAP que las utilizadas para la desinfección de las barricas de madera. Para cada tratamiento se emplearon 3 corchos contaminados artificialmente tal como se describió anteriormente. Se sumergieron (individualmente) los corchos (por triplicado) en recipientes de cristal de 95 gramos con 80 ml de cada tipo de solución (AD y 4 AAP) durante 3 horas. No se empleó ningún tipo de movimiento, ni giro, ni agitación. Nótese que el método de aplicación de las distintas soluciones (AD y 4 AAP) fue el mismo que el empleado para la desinfección de las barricas de madera: 3 horas de inmersión. Ensayos realizados Análisis de polihaloanisoles y polihalofenoles: se analizaron todos los corchos del estudio (corchos contaminados artificialmente, tratados con agua destilada y con AAP) siguiendo los métodos de análisis químicos OIV-MA-AS315-16 (Determinación del 2, 4, 6-tricloroanisol cedido al vino por los tapones de corcho, Resolución OIV/OENO 296/2009) y OIV-MA-AS315-17 (Determinación de los policlorofenoles y de los policloroanisoles en los vinos, los tapones, las maderas y las bentonitas utilizadas como adsorbente de estos compuestos en la atmosfera, Resolución OIV/OENO 374/2009) correspondientes al "Compendio de los métodos internacionales de análisis de los vinos y de los mostos" de la "Organización Internacional de la Viña y el Vino" (OIV) . Estos métodos simulan los fenómenos de migración del 2, 4, 6-tricloroanisol (TCA) , 2, 4, 6-tricloroanisol, 2, 4, 6-triclorofenol, 2, 3, 4, 6-tetracloroanisol, 2, 3, 4, 6-tetraclorofenol, pentacloroanisol y pentaclorofenol susceptibles de producirse entre el tapón de corcho y el vino embotellado. Se ponen a macerar los tapones de corcho en una solución hidroalcohólica hasta la obtención de un equilibrio. Se extraen los polihaloanisoles y polihalofenoles del espacio de cabeza de una parte alícuota del macerado por medio de la técnica de microextracción en fase sólida (SPME) y se analiza por cromatografía en fase gaseosa, con detección por espectrometría de masas (GC/MS) . Resultados obtenidos Los resultados de descontaminación se muestran en la figura 6. Como puede observarse, el ratamiento con AAP-5 produce una reducción del 75, 2% del TCA que contienen los corchos contaminados sin tratar (muestra control) . El tratamiento con agua destilada (AD) no es eficaz en ningún caso. Este hecho sugiere que la contaminación artificial con TCA no es superficial (como ocurre con los corchos contaminados naturalmente) pues el agua destilada no ha "arrastrado" el TCA de la superficie. Suponiendo que el agua destilada y el AAP han alcanzado los poros interiores del corcho, todo el TCA que se reduce proviene de la descomposición obtenida por los radicales hidroxilo (OH*) del AAP. El tratamiento con AAP-1, 5 (obtenido con 1, 5 minutos de generación) obtiene una reducción del 18, 1% del TCA que contienen los corchos contaminados sin tratar Los tratamientos con AAP-15 y AAP-30 consiguen una reducción similar a la de AAP-5. En base a estos resultados, según una realización preferida de la presente invención, el tratamiento con AAP-5 se considera óptimo para la reducción de TCA en corchos, ya que obtiene una reducción significativa de TCA (más del 75%) . Además, el consumo energético con respecto a AAP-15 (que además elimina una cantidad similar de TCA) es 3 veces menor (3 veces menos tiempo de tratamiento de producción de AAP) . Tal como puede apreciarse a partir de los ensayos anteriores, en ambas aplicaciones consideradas en el presente documento (desinfección de Brett en madera y reducción de TCA en corchos) , el tratamiento preferido es el mismo: inmersión estática (de madera y corchos contaminados) durante 3 horas empleando APP-5. El agua activada por plasma, sometida a tratamiento de activación durante 5 minutos (AAP-5) se caracteriza por una concentración de OH* de más de 23 g/l (23, 1 g/l tal como se mostró en la tabla 2 anterior) . Sin embargo, se considera que en otras aplicaciones el uso de AAP-1, 5 (también incluido dentro del alcance de protección definido por las reivindicaciones adjuntas) también puede ser deseable en función de limitaciones técnicas y otros aspectos específicos de la instalación en la que se aplique el método de la presente invención. AAP-1, 5 (agua sometida a tratamiento de activación por plasma durante 1, 5 minutos) se caracteriza por una concentración de OH* de más de 8 g/l (en concreto, 8, 2 g/l tal como se mostró en la tabla 2 anterior) . Del mismo modo se ha considerado que las características fisicoquímicas preferidas del gua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino son los siguientes: un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV, una concentración de NO3" de más de 3 mg/l, una concentración de NO2" de más de 0, 5 mg/l y una concentración de OH* de más de 8 g/l, preferiblemente de más de 23 g/l. Dichos parámetros, ya se consiguen con 1, 5 minutos de tratamiento de activación por plasma (AAP-1, 5) . Siendo el tiempo de tratamiento de activación por plasma más preferido de 5 minutos (AAP-5) . Para determinar los valores de pH, CE (conductividad eléctrica) , ORP (potencial de oxidación-reducción) y la concentración de NO3- y NO2-, se han utilizado técnicas ampliamente conocidas en la técnica. Aunque en el presente documento se ha descrito la presente invención haciendo referencia a realizaciones preferidas de la misma, debe entenderse que estas realizaciones tienen carácter explicativo y no limitativo. El experto en la técnica podrá implementar fácilmente modificaciones y variaciones a las realizaciones descritas en el presente documento, sin por ello salir del alcance de protección definido exclusivamente por las reivindicaciones adjuntas.
Publicaciones:
ES2958166 (02/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 06/07/2022 se realizó Registro Instancia de Solicitud
En fecha 06/07/2022 se realizó Admisión a Trámite
En fecha 06/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 12/07/2022 se realizó Superado examen de oficio
En fecha 03/03/2023 se realizó Realizado IET
En fecha 09/03/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 02/02/2024 se realizó Publicación Solicitud
En fecha 02/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
28/06/2022 - Pago Tasas IET
+ ES-2958166_A11. Método de tratamiento con agua activada por plasma (AAP) de materiales auxiliares de origen forestal para la conservación del vino para la desinfección y/o descontaminación de los mismos, que comprende poner en contacto el material que va a desinfectarse y/o descontaminarse con AAP. 2. Método según la reivindicación 1, caracterizado porque la etapa de puesta en contacto del material que va a desinfectarse y/o descontaminarse con AAP se realiza de continuo durante un mínimo de 3 horas. 3. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque se obtiene una reducción de anisoles en el material sometido a descontaminación con AAP. 4. Método según la reivindicación 3, caracterizado porque se obtiene una reducción de TCA (2, 4, 6-tricloroanisol) . 5. Método según la reivindicación 4, caracterizado porque se obtiene una reducción de TCA de al menos el 50%. 6. Método según la reivindicación 5, caracterizado porque se obtiene una reducción de TCA de al menos el 75%. 7. Método según cualquiera de las reivindicaciones 3 a 6, caracterizado porque el material que se somete a descontaminación mediante contacto con AAP consiste en corchos para botellas de vino. 8. Método según cualquiera de las reivindicaciones 1 a 2, caracterizado porque comprende una etapa previa de limpiar el material que va a desinfectarse y/o descontaminarse mediante agua a presión inmediatamente antes de la etapa de puesta en contacto continua con AAP. 9. Método según la reivindicación 8, caracterizado porque el agua a presión usada en la etapa de limpieza es AAP. 10. Método según cualquiera de las reivindicaciones 1, 2, 8 o 9, caracterizado porque se aplica a recipientes de madera y se obtiene una reducción de Brettanomyces. 11. Método según la reivindicación 10, caracterizado porque se obtiene una reducción de Brettanomyces de al menos 1 log con respecto al recipiente de madera antes del tratamiento. 12. Método según la reivindicación 11, caracterizado porque se obtiene una reducción de Brettanomyces de al menos 3 log con respecto al recipiente de madera antes del tratamiento. 13. Método según cualquiera de las reivindicaciones 10 a 12, caracterizado porque se aplica a barricas de madera. 14. Método según la reivindicación 13, caracterizado porque la etapa de puesta en contacto continua de la barrica de madera con AAP se realiza llenando todo el volumen de la barrica con AAP. 15. Método según la reivindicación 13, caracterizado porque la etapa de puesta en contacto continua de la barrica de madera con AAP se realiza introduciendo un volumen mínimo de AAP en la barrica y haciendo girar la barrica de manera continua de modo que el AAP entre en contacto con toda la superficie interior de la misma. 16. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque comprende la etapa previa de producir AAP mediante la aplicación de plasma a agua de partida, usando aire como gas de plasma, un flujo de gas de plasma de 60 slm, una potencia de plasma de 500 W. 17. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque comprende la etapa previa de producir AAP mediante la aplicación de plasma a agua de partida, donde el tiempo de tratamiento del agua de partida con plasma es de entre 1, 5 min y 30 min. 18. Método según la reivindicación 16 o 17, caracterizado porque el tiempo de tratamiento del agua de partida con plasma es de 5 min. 19. Método según cualquiera de las reivindicaciones 16 a 18, caracterizado porque el agua de partida es agua destilada. 20. Método según cualquiera de las reivindicaciones 16 a 18, caracterizado porque el agua de partida es agua de red. 21. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada tiene un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV. 22. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada comprende una concentración de NO3" de más de 3 mg/l y una concentración de NO2" de más de 0, 5 mg/l. 23. Método según cualquiera de las reivindicaciones anteriores, caracterizado porque el AAP empleada comprende una concentración de OH* de más de 8 g/l. 24. Método según la reivindicación 23, caracterizado porque el AAP empleada comprende una concentración de OH* de más de 23 g/l. 25. Uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. 26. Uso del agua activada por plasma (AAP) según la reivindicación 25, donde el AAP empleada tiene un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV. 27. Uso del agua activada por plasma (AAP) según la reivindicación 25 o 26, donde el AAP empleada comprende una concentración de NO3" de más de 3 mg/l y una concentración de NO2" de más de 0, 5 mg/l. 28. Uso del agua activada por plasma (AAP) según cualquiera de las reivindicaciones 25 o 27, donde el AAP empleada comprende una concentración de OH* de más de 8 g/l, preferiblemente de más de 23 g/l.
Los productos y servicios protegidos por este registro son:
C12G 1/00 - A01P 1/00
Descripciones:
+ ES-2958166_A1 MÉTODO DE TRATAMIENTO CON AGUA ACTIVADA POR PLASMA DE MATERIALES AUXILIARES DE ORIGEN FORESTAL PARA LA CONSERVACIÓN DEL VINO Y USO DEL AGUA ACTIVADA POR PLASMA Campo de la invención La presente invención se refiere de manera general al campo de la producción del vino, y más concretamente se refiere a un método de tratamiento para la desinfección y/o descontaminación de materiales de origen forestal empleados en la conservación del vino con vistas a la preservación de su calidad y seguridad alimentaria. Antecedentes de la invención La industria del vino es uno de los sectores agroalimentarios más importantes de España y del sur de Europa. Según las estadísticas actuales (Informe Estadístico de la OIV, 2018, www.oiv.int) , España produce aproximadamente 44 millones de hectolitros de vino, ocupando la tercera posición tras Italia y Francia. Además, cuenta con la mayor superficie vitivinícola del mundo (13% del total) . La constante necesidad de innovación en el sector vitivinícola para satisfacer las demandas de los consumidores ha generado una fuerte competitividad en el mercado. Por otro lado, la creciente demanda de productos naturales está planteando a la industria alimentaria, y por tanto a la industria del vino, el reto de proporcionar alimentos seguros, saludables y mínimamente procesados. La evolución organoléptica de los vinos se ve muy favorecida cuando se utilizan barricas de roble para su elaboración y crianza. Los consumidores, cada vez más exigentes, demandan vinos equilibrados y con una aromática compleja. Esto se consigue con la crianza en barricas, ya que se producen una serie de intercambios vino/madera que enriquecen en aromas y sensaciones gustativas el vino favoreciendo una microoxigenación lo que le provoca una estabilidad tanto física como química. Aunque una barrica usada pierde potencial con respecto a una nueva, es perfectamente válida para su utilización en la elaboración de vino y productos alcohólicos a un coste menor. Por tanto, un buen mantenimiento de las mismas es imprescindible para su reutilización. Las contaminaciones icrobiológicas o químicas son los principales problemas que acontecen durante la crianza del vino, el cual se puede alterar o incluso volver inapropiado para consumo cuando se desarrolla una flora indeseable (primeros 8 mm de la madera en contacto con el vino) . Este hecho se ve agravado con la reutilización de barricas mal mantenidas, pudiendo dar lugar a la aparición del "picado acético", el carácter fenolado o "Brett", el "picado láctico", la "enfermedad de la grasa" o la "enfermedad del amargor". A. Palacios et al., Enólogos. 77 (2012) 46-54. Por otro lado, durante la crianza, los depósitos de tartrato formado quedan adheridos a las paredes internas de la barrica, sirviendo de refugio a cepas microbianas potencialmente contaminantes que pueden llegar a bloquear su estructura porosa. Se ha establecido que un volumen de vino nada despreciable, de unos 5 litros, es retenido en los primeros milímetros de las duelas en una barrica de 225 litros. Además, la penetración de los microorganismos en profundidad se ve favorecida por la estructura microporosa de la madera. Todo ello dificulta las tareas de limpieza y desinfección de las barricas. Esto resulta especialmente crítico en el caso de la contaminación por la levadura Brettanomyces o "Brett", causante del carácter fenolado del vino, con descriptores típicos como plástico, goma quemada, cuadra, sudor de caballo, etc. Esta problemática sensorial es un tema muy tratado en la actualidad y afecta especialmente a vinos de crianza o vinos que pasan tiempo en barrica. A. Palacios et al., Enólogos. 77 (2012) 46-54 En cuanto a los corchos empleados para tapar las botellas de vino, estos son propensos a la formación de TCA (2, 4, 6-tricloroanisol) , lo cual se conoce habitualmente como la enfermedad del corcho y afecta al 4% de los vinos embotellados en todo el mundo. El TCA es una molécula que se forma mediante un proceso químico como consecuencia de la presencia de clorofenoles. Éstos están presentes en el ambiente, siendo el alcornoque y los suelos de los bosques algunos de los lugares más frecuentes donde encontrarlos. Es por ello que los corchos son la principal fuente de TCA por la que el vino adquiere características negativas; sin embargo, este proceso se puede desencadenar en diferentes etapas de la producción del vino debido a que los clorofenoles forman parte, además, de los ambientes húmedos característicos de las bodegas. Este problema es de los más relevantes en la industria del vino, pues una vez que este último adquiere las características organolépticas propias del TCA, es imposible eliminarlas por lo que se produce una respuesta de rechazo en el consumidor. En 2017 Laithwaite's Wine llevó a cabo un estudio en el cual se observó que, en Gran Bretaña, se desperdician 624 millones de botellas de vino al año. El estudio citó diferentes causas tales como falta de conocimiento por parte de los consumidores sobre la conservación del vino o defectos organolépticos en el mismo. En este sentido, se ha observado que la causa principal por la cual las características organolépticas del vino se ven disminuidas está relacionada con olores desagradables en el corcho. Éstos tienen diferentes orígenes, pero el más extendido es la contaminación de los corchos por compuestos clorados, en particular el tricloroanisol (TCA) , responsable de casi el 80% de estos problemas. Por otro lado, la industria del vino es un cliente fundamental de la industria del corcho. La pérdida de participación del mercado del tapón de corcho en comparación con cierres alternativos implica la necesidad de revalorizar la industria del corcho, que transmite en su producto los beneficios intrínsecos del respeto al medio ambiente y la responsabilidad social. La Península Ibérica domina la producción mundial de corcho y España representa el 30% (506.000 Ha de bosques de alcornoques) . Uno de los desafíos de la mejora para la industria del corcho es la disminución en la incidencia de compuestos organoclorados que contribuyen con aromas desagradables al vino. El interés por eliminar esta desviación organoléptica y sus causas se justifica por la incidencia económica que supone para el sector del corcho y la industria enológica. Hasta ahora, la aplicación de agua a altas temperaturas o el uso de conservantes químicos no han sido lo suficientemente efectivos para eliminar el problema. Para resolver los problemas anteriores, se conocen en la técnica varios métodos de tratamiento de productos de origen forestal relacionados con la producción y conservación del vino, con vistas a su mantenimiento y reutilización continua. Una de las prácticas más utilizadas en bodega para la desinfección de barricas es el tradicional mechado de azufre, ya utilizado en la época de los romanos. Este método consiste en el prendido de una pastilla de azufre dentro de una barrica vacía cuya combustión produce el dióxido de azufre, compuesto con efectos biocidas sobre la madera. Esta práctica ayuda a mantener el parque de barricas de una bodega libre de cualquier microorganismo que pueda alterar el vino. Sin embargo, la aparición de la Directiva 98/8/CE2 de la Comisión Europea prohíbe el uso del dióxido de azufre para las labores de desinfección de barricas. Esta directiva ha propiciado la búsqueda urgente de nuevas soluciones de desinfección que permitan llevar a abo esta tarea de forma viable desde un punto de vista económico y operativo. En España existe un acuerdo de moratoria sobre la prohibición del uso del mechado sulfuroso hasta 2025. Este escenario ha propiciado la aparición de nuevas tecnologías alternativas para la desinfección de las barricas (térmica, por ozono, por cavitación o por chorro de arena) . Sin embargo, ninguna de ellas ha sido capaz de dar respuesta de manera adecuada a las necesidades del sector y son potencialmente contaminantes en diferentes aspectos. La desinfección no equivale a la esterilización (total eliminación de gérmenes) , sino que supone la destrucción de gérmenes viables para reducir en profundidad las poblaciones residuales mediante la acción química y/o física. En este sentido, pueden establecerse dos categorías relativas a los nuevos métodos alternativos de desinfección de barricas (alternativos al mechado de sulfuroso) : por vías químicas o físicas. Métodos químicos: se realizan mediante agentes acidificantes como el dióxido de azufre, empleado en forma líquida sobre el vino en solución de metabisulfito de sodio y en forma gaseosa sobre la madera y el vino, mediante combustión de azufre (método más utilizado y comentado anteriormente) o la utilización de gas licuado. También pueden emplearse peróxido de hidrógeno, ácido peracético, permanganato de potasio y ozono (O3) . En relación con el ozono, hay que destacar que es un gas muy oxidante, tóxico y explosivo. Su utilización sólo es posible tras su disolución en agua fría para producir una solución de ozono activo que contenga entre 3 y 5 mg/l de O3. El ozono es desinfectante, pero no tiene propiedades limpiadoras. Teniendo en cuenta su modo de actuación, es indispensable emplearlo sobre superficies perfectamente limpias para poder desinfectar. En el caso de recipientes de madera, reacciona parcialmente con respecto al ozono lo cual limita su acción en profundidad. Métodos físicos: el método físico más empleado es el térmico. En este caso, se emplean generadores de agua caliente móviles, que pueden producir agua a 80-90°C a entre 80 y 210 bares. La utilización a temperaturas más altas es ilusoria, ya que en tal caso los caudales son muy débiles. Una presión de 100-120 bares es suficientemente respetuosa con la madera. Esta tecnología permite limpiar sin detergentes, pero su eficacia desinfectante se limita a la superficie de la madera. El aumento de la temperatura de sus capas más profundas (transmitida por el vapor de agua a 105°C) es muy lento ya que la onductividad térmica de la madera es muy baja. Para que esta tecnología sea eficaz, los tratamientos deben ser muy prolongados en el tiempo. Este es un aspecto muy limitante, puesto que, como ya se mencionó anteriormente, los microorganismos pueden penetrar más de 8 mm en el interior de la madera. Según lo anterior y teniendo en cuenta las distintas superficies que pueden estar en contacto con el vino durante su elaboración, puede considerarse que los tratamientos térmicos pueden ser eficaces en superficies de acero o vidrio (con rugosidad prácticamente nula) , pero no con las superficies de origen forestal, como por ejemplo la madera y el corcho (con rugosidad y porosidad muy altas) . Otro método posible es el tratamiento electromagnético por microondas, que permite el calentamiento de la madera a través de la excitación del agua contenida en el material. La selección de la longitud de onda permite calentar la madera desde el centro de las duelas con poca energía; mientras que la forma y disposición del magnetrón y la rotación de la barrica permiten una irradiación homogénea dentro de la caja metálica de Faraday que refleja las ondas. Por otro lado, en la aplicación de ultrasonidos se introduce un sonotrón dentro de la barrica llena de agua a 60°C reciclada; y los ultrasonidos (150 kHz) producen en la superficie de la madera y en los primeros milímetros altas presiones al nivel microscópico (>2000 bares) por cavitación del agua, eliminando los compuestos que impregnan la madera y destruyen los microorganismos al mismo tiempo que se provoca su desinfección. Otros métodos físicos menos frecuentes son la proyección de hielo seco (eficiente y rápido, pero también caro y no garantiza la desinfección al nivel de profundidad de las duelas) y el empleo de oxígeno negativo. Todos estos métodos se han estudiado a nivel científico y sometido a pruebas industriales, pero ninguno de ellos ha podido mejorar los resultados de desinfección obtenidos mediante el mechado de sulfuroso. Por otro lado, el coste de instalación y de tiempo de procesado de alguna de estas tecnologías (por ejemplo, ultrasonidos y microondas) es ciertamente prohibitivo. Otro método de desinfección conocido es el plasma atmosférico frío. Aunque se ha realizado algún estudio sobre su aplicación directa a productos de madera tales como barricas, nunca se ha aplicado a nivel industrial. El plasma es el cuarto estado de la materia. Está compuesto por iones positivos y negativos, electrones, átomos excitados y neutros, radicales libres, moléculas en los estados fundamental y excitado y fotones UV. El plasma puede clasificarse en plasma térmico (caliente) y plasma no térmico (frío) según el equilibrio ermodinámico de temperatura de sus constituyentes. La temperatura del plasma frío nunca supera una temperatura de 100°C. Algunas de las fuentes de plasma no térmicas ampliamente utilizadas para aplicaciones alimentarias son las descargas de barrera dieléctrica (DBD) , los chorros de plasma y las descargas de corona. En los últimos años, muchos científicos e investigadores han empleado plasma frío en varias aplicaciones alimentarias: desinfección microbiana, inactivación enzimática, mejora de la calidad de cocción de variedades de arroz, modificación del almidón, mejora de la germinación de semillas, etc. (véase, por ejemplo, R. Thirumdas et al., "Cold Plasma: A novel Non-Thermal Technology for Food Processing", Food Biophys. 10 (2014) 1-11) . La mayoría de los estudios sobre la actividad antimicrobiana del plasma se han realizado aplicando el plasma directamente sobre los alimentos o superficies que lo contienen. No obstante, existen ocasiones en las que la aplicación directa de una fuente de plasma no es técnicamente factible o no es industrialmente rentable. Este es el caso, por ejemplo, del tratamiento por plasma del interior de una barrica, en la que, para poder introducir el equipo de plasma en su interior, habría que desmontar, al menos, uno de sus frentes. Esto resulta prácticamente inviable en una bodega. Recientemente se ha empezado a estudiar el uso de agua activada por plasma (AAP) como agente desinfectante, en lugar de aplicar directamente plasma frío o caliente. Tal como se detallará más adelante en el presente documento, el AAP contiene especies reactivas de nitrógeno y oxígeno de reconocida actividad antimicrobiana que se generan cuando se pone el plasma en contacto con el agua (especies reactivas primarias) o a partir de la posterior interacción de dichas especies reactivas primarias en reacciones secundarias (especies reactivas secundarias) . Por ejemplo, en los documentos CN212456771U, RU2746976C1 y ES2314000T3 se dan a conocer dispositivos para la producción de AAP. Sin embargo, ninguno de estos documentos enseña ni sugiere el uso del AAP producida para la desinfección de superficies de materiales de origen forestal. Existen muy pocas publicaciones sobre el empleo de AAP para descontaminar superficies. En Joshi et al ("Characterization of Microbial Inactivation Using Plasma-Activated Water and Plasma-Activated Acidified Buffer", J. Food Prot. 81 (2018) 1472-1480) se estudia el uso de AAP para la desinfección de portaobjetos de vidrio inoculado con Enterobacter aerogenes. En Kamgang-Youbi et al ("Microbial decontaminaron of stainless steel and polyethylene surfaces using GlidArc plasma activated water without chemical additives", J. Chem. Technol. Biotechnol. 93 (2018) 2544-2551) se confirmó la eficacia del AAP para la descontaminación superficial de acero inoxidable AISI304 y PET de alta densidad, contaminados con Saccharomyces cerevisiae, Staphylococcus epidermidis, Leuconostoc mesenteroides y Hafnia alvei. No obstante, no se conoce ningún estudio que haya aplicado satisfactoriamente AAP para la desinfección y descontaminación de materiales rugosos y porosos, y más concretamente de materiales de origen forestal tales como madera y corcho. Por otro lado, los documentos ES2423255B1, ES2268459T3, ES2402890T3, ES2019562A6, ES2726598B2, ES2247180T3, por ejemplo, dan a conocer diversos métodos de tratamiento de productos de corcho, tales como tapones de botellas, por ejemplo, para la reducción del contenido en TCA. Sin embargo, todos estos métodos se basan en el uso de altas temperaturas, altas presiones, largos periodos de tratamiento y/o uso de recipientes en rotación continua. Sin embargo, las altas presiones y temperaturas pueden provocar efectos adversos, tales como distorsiones irreversibles en los tapones, tal como se indica, por ejemplo, en el documento ES2423255B1. Por su parte, los largos periodos de tratamiento y la puesta en rotación de los recipientes (así como también el uso de altas presiones y temperaturas) provocan un aumento de los costes de implementación y, por tanto, una reducción de la rentabilidad del procedimiento. Por tanto, sería deseable disponer de un método alternativo para el tratamiento de desinfección y/o descontaminación de materiales y productos auxiliares para la elaboración y conservación del vino, y más específicamente de productos de origen forestal, tales como madera y corcho. En concreto, sería deseable disponer de un método alternativo al mechado sulfuroso que produzca unos resultados al menos iguales o mejores que el mismo, pero supere sus inconvenientes, concretamente que evite los problemas tóxicos derivados del uso de dióxido de azufre. Asimismo, sería deseable que dicho método no produzca efectos adversos sobre los materiales tratados (corchos y madera) , tales como deformaciones irreversibles, al tiempo que reduzca los costes económicos asociados con su implementación en comparación con alternativas conocidas en el estado de la técnica tal como se mencionó anteriormente. Sumario de la invención Para superar los problemas anteriormente mencionados, la presente invención propone un nuevo método de tratamiento de materiales auxiliares de origen forestal usados para la conservación del vino, con el fin de desinfectarlos y/o descontaminarlos con vistas a la preservación de su calidad y seguridad alimentaria. En concreto, el método se basa en poner el material que va a desinfectarse y/o descontaminarse en contacto con agua activada por plasma (AAP) . La presente invención también propone un uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. En las reivindicaciones dependientes adjuntas se describen realizaciones preferidas del método de tratamiento y del uso del AAP de la presente invención. Breve descripción de las figuras La presente invención se entenderá mejor con referencia a los siguientes dibujos que ilustran una realización preferida de la invención, proporcionada a modo de ejemplo, y que no debe interpretarse como limitativa de la invención de ninguna manera. La figura 1 muestra de manera esquemática un sistema de producción de agua activada por plasma para su uso en un método según la realización preferida de la presente invención. La figura 2 representa esquemáticamente las etapas de desinfección de una barrica de madera según varias realizaciones preferidas de la presente invención. La figura 3 muestra los cromatogramas de muestras de AAP tratadas durante diferentes periodos de tiempo, en los que se observan los productos de reacción con fenol relativos a cada una de las especies reactivas en las muestras de AAP. La figura 4 muestra la superposición del pico del producto de reacción con fenol del radical hidroxilo OH* a partir de los cromatogramas de cuatro muestras de AAP. La figura 5 es un gráfico de barras que representa el crecimiento logarítmico de células viables de Brettanomyces por gramo de madera de duelas contaminadas tratadas con agua estilada (AD) y con diversas muestras de AAP según la presente invención. Las distintas letras indican diferencias estadísticamente significativas (p < 0, 05) . La figura 6 es un gráfico de barras que representa la concentración media de TCA (ng/l) de corchos contaminados artificialmente, tratados con agua destilada (AD) y con diversas muestras de AAP según la presente invención. Las distintas letras indican diferencias estadísticamente significativas (p < 0, 05) . Descripción detallada de las realizaciones preferidas Tal como se mencionó anteriormente, la presente invención se basa en el uso de agua activada por plasma (AAP) para el tratamiento de desinfección y/o descontaminación de materiales auxiliares de origen forestal destinados a la elaboración y conservación del vino. La tecnología de AAP presenta numerosas ventajas respecto de los actuales métodos de desinfección y/o descontaminación. En primer lugar, se trata de una tecnología de bajo coste, pues únicamente consume electricidad y aire comprimido para la generación del plasma en muchos casos y no precisa de productos químicos, filtros u otros materiales consumibles. Además, se genera a presión atmosférica y temperatura ambiente, por lo que no se requieren instalaciones auxiliares. Por otro lado, se puede aplicar con los actuales sistemas de lavado de barricas (lanzas de agua a presión) , por lo que se pueden limpiar e higienizar al mismo tiempo, proporcionando un ahorro de agua, energía y tiempo de proceso. Por último, es una tecnología respetuosa con el medio ambiente ya que no se producen productos químicos tóxicos o de desecho. Sin embargo, se trata de una tecnología emergente que aún no se ha estudiado mucho ni aplicado a nivel industrial. Concretamente, no se conoce ninguna publicación que mencione el uso de AAP para desinfectar superficies de madera u otros materiales de origen forestal. Los líquidos activados por plasma se generan al poner en contacto (directa o indirectamente) una fuente de plasma con un líquido. Esta interacción produce una generación y/o transferencia de especies químicas reactivas al líquido. Las soluciones activadas por plasma se pueden utilizar como soluciones desinfectantes para su aplicación en las industrias alimentarias. El líquido activado por plasma más estudiado es el agua activada por plasma (AAP) . En numerosas publicaciones se han demostrado sus efectos ntibacterianos (véase, por ejemplo, M.J. Traylor et al., "Long-term antibacterial efficacy of air plasma-activated water", J. Phys. D. Appl. Phys. 44 (2011) 472001) . El AAP posee una composición y propiedades fisicoquímicas diferentes a las del agua. De forma habitual presenta un pH ácido, cambios en el potencial redox y conductividad y presencia de especies reactivas de oxígeno (ROS) y nitrógeno (RNS) (A. Mai-Prochnow et al., "Microbial decontamination of chicken using atmospheric plasma bubbles", Plasma Process. Polym. (2020) ) . La capacidad antimicrobiana del AAP se produce mediante varios procesos: [a] fase gaseosa: formación de especies reactivas en fase gaseosa por la interacción de las partículas cargadas (electrones, neutrones, etc.) y la radiación ultravioleta con el gas del plasma y la atmósfera circundante, [b] fase de gas-líquido: dilución en el agua de las especies químicas reactivas generadas en fase gaseosa o las generadas por la interacción plasma-líquido, especialmente aquellas que tienen una vida útil relativamente larga, como el ozono, oxígeno atómico u óxido nítrico que actúan como precursores de otros ROS y RNS, como el peróxido de hidrógeno, los nitratos o los nitritos y [c] fase líquida: reacciones secundarias de las especies reactivas de larga vida, originadas, por ejemplo, por la inestabilidad de los nitritos en medio ácido. Estas reacciones cíclicas justifican la presencia durante días de especies reactivas muy citotóxicas de corta vida, por ejemplo, radicales hidroxilo (OH*) , nitritos acidificados (NO*, NO2*) y peroxinitritos (O=NOOH) . Algunas de las especies químicas más biocidas del AAP (OH*, NO*, NO2* y O=NOOH) se generan una vez la fuente de plasma se ha apagado (ECV, especies reactivas de "corta vida") . Las ECV pueden producirse durante la generación del AAP (cuando el plasma se pone en contacto con la atmósfera y el agua) pero poseen una vida tan corta (del orden de milisegundos) que su presencia en el AAP no puede deberse a su dilución en al agua. Las ECV que finalmente se encuentran en el AAP se generan a partir de reacciones de las especies reactivas de "larga vida" (peróxido de hidrógeno, nitratos y nitritos) producidas en el AAP una vez se ha apagado la fuente de plasma. Las ECV producto de estas reacciones secundarias son especies reactivas "transitorias" que poseen propiedades altamente citotóxicas y provocan una actividad antimicrobiana prolongada del AAP incluso varios días después de la exposición del agua a la descarga de plasma. Las principales reacciones secundarias se originan debido a que los nitritos no son estables n condiciones ácidas (pH < 3, 5) . A continuación, se presentan los esquemas de las principales reacciones secundarias que tienen lugar en el AAP. El ácido nitroso (HNO2) , que se encuentra en equilibrio ácido-base con los nitritos [a], se descompone en condiciones ácidas para dar radical óxido nítrico (NO*) y radical dióxido de nitrógeno (NO2*) a través de la reacción [b]. El radical dióxido de nitrógeno (NO2*) experimenta además hidrólisis en medio acuoso para producir ion nitrito (NO2-) como producto final a través de la reacción [c]. El NO* y el NO2* también pueden reaccionar con el oxígeno disuelto para producir iones de nitrito (NO2-) y nitrato (NO3-) de acuerdo con las reacciones generales [d] y [e], respectivamente. Los radicales de nitrógeno NO* y NO2* formados en estas reacciones secundarias poseen fuertes propiedades citotóxicas y son probablemente una de las principales causas de los efectos citotóxicos de los nitritos en condiciones ácidas. Por esta razón, se denominan "nitritos acidificados". Además, en condiciones ácidas, la reacción de los nitritos (NO2-) con el peróxido de hidrógeno (H2O2) puede generar peroxinitritos (O=NOOH) [f]. Los peroxinitritos pueden reaccionar directamente con los microorganismos o indirectamente mediante su descomposición en OH* y NO2* [g]. Esta es una de las vías de generación de los radicales hidroxilo (OH*) . NO2- + H+ ~ HNO2 [a] 2 HNO2 ^ NO* + NO2* + H2O [b] 2 NO2* + H2O ^ NO3- + NO2- + 2 H+ [c] 4 NO* + O2 + 2 H2O ^ 4 NO2- + 4 H+ [d] 4 NO2* + O2 + 2 H2O ^ 4 NO3- + 4 H+ [e] NO2- + H2O2 + H+ ^ O=NOOH + H2O [f] O=NOOH ^ OH* + NO2* [g] La formación de nitritos acidificados (NO* y NO2*) y radicales OH* mediante reacciones secundarias, son la clave de las propiedades biocidas del AAP prolongadas en el tiempo. Radical hidroxilo (OH*) Los radicales OH* son probablemente las especies reactivas más importantes producidas por el tratamiento con plasma de soluciones acuosas. Pueden oxidar de forma no selectiva la mayoría de los compuestos orgánicos con los que entran en contacto y, por recombinación de radicales, son la principal fuente de peróxido de hidrógeno en los sistemas de plasma. En relación con su capacidad biocida, la parte más afectada por los adicales OH* es la pared celular externa de los microorganismos, incluida la membrana celular. La membrana celular, compuesta en gran parte por compuestos orgánicos como lípidos, proteínas y polisacáridos, es susceptible al ataque de los radicales OH*. Los lípidos son las macromoléculas de la membrana celular más vulnerables a la oxidación. Las reacciones de los lípidos con los radicales OH* se producen por la extracción de H de los enlaces de carbono insaturados de los ácidos grasos, que en presencia de oxígeno provocan la peroxidación de los lípidos. De manera similar, los radicales OH* pueden dañar las proteínas de la membrana mediante la abstracción de H del carbono a de los enlaces peptídicos -CO-NH- entre los aminoácidos de cadena unidos a péptidos. El ataque de los radicales OH* conduce a la peroxidación y escisión de la columna vertebral de las proteínas. El efecto combinado de estas afecciones conduce a la muerte celular. Radicales NO* y NO2* ("nitritos acidificados") Los nitritos acidificados poseen un importante efecto antimicrobiano contra una amplia gama de organismos patógenos, incluyendo virus (como el SARS-CoV-1, SARS-CoV-2) , bacterias y hongos. Algunos de los daños que producen a los microorganismos son: oxidación de las proteínas de las membranas, reacción con las metaloenzimas, lo que provoca el consumo del hierro disponible, inactivación de las enzimas metabólicas, afección del ADN por daños oxidativos, peroxidación de lípidos que dañan las membranas celulares, etc. Estos daños multifactoriales dan como resultado severas disfunciones y, en última instancia, la muerte celular. Tal como se mencionó anteriormente, la presente invención se refiere a un método de tratamiento con agua activada por plasma (AAP) de materiales auxiliares de origen forestal, empleados en la conservación del vino, para la desinfección y/o descontaminación de los mismos. En concreto, los materiales de origen forestal que se someten a desinfección y/o descontaminación pueden seleccionarse del grupo constituido por corchos para botellas y recipientes de madera, tales como barricas de madera. En el caso de los corchos, el método según la presente invención tiene el objetivo principal de producir una reducción de los anisoles presentes en los mismos, más concretamente de TCA (2, 4, 6-tricloroanisol) . Dicha reducción de TCA es preferiblemente de, al menos, el 50%, más preferiblemente de, al menos, el 75%, con respecto a la cantidad de TCA en los corchos antes del tratamiento. En el caso de los recipientes de madera, concretamente barricas de madera, el método según la presente invención tiene el objetivo principal de reducir la cantidad de levadura, en concreto levadura Brettanomyces, en las mismas con respecto a la cantidad de Brettanomyces en los recipientes antes del tratamiento. Dicha reducción de Brettanomyces es preferiblemente de, al menos, 1 log, más preferiblemente de, al menos, 3 log con respecto al contenido en Brettanomyces de los recipientes antes del tratamiento. Más concretamente, el método de tratamiento según la presente invención comprende las etapas de: - opcionalmente, producir AAP mediante aplicación de plasma a agua de partida, - opcionalmente, limpiar el material que va a desinfectarse mediante agua a presión, e - inmediatamente después de la etapa de limpieza, si se realiza, poner en contacto de manera continua el material que va a desinfectarse y/o descontaminarse con AAP durante un periodo de tiempo suficiente para obtener un nivel de desinfección y/o descontaminación deseado del material que va a desinfectarse y/o descontaminarse, preferiblemente durante un periodo de tiempo mínimo de 3 horas. La presente invención también se refiere al uso del agua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino. Tal como se mencionó anteriormente, las especies reactivas causantes del efecto desinfectante y/o descontaminante en el AAP pueden encontrarse presentes durante un periodo relativamente prolongado, por ejemplo, de varios días. Por tanto, la etapa de producción de AAP puede realizarse como parte del método según la presente invención, puede realizarse como un procedimiento independiente en la misma ubicación o incluso puede adquirirse de un proveedor comercial externo, en función de los requisitos y las limitaciones técnicas de la instalación en la que se implemente el método dado a conocer en el presente documento. Según la realización preferida de la presente invención, para generar AAP útil para su uso n el método de tratamiento dado a conocer en el presente documento se emplea un sistema de producción de agua activada por plasma atmosférico frío tal como se representa esquemáticamente en la figura 1. En la parte inferior se muestra un depósito (10) que comprende agua destilada, empleada como agua de partida que va a activarse por el plasma. El agua destilada es útil para realizar los ensayos descritos a continuación en el presente documento ya que no cuenta con el efecto biocida del cloro presente en agua de red. Sin embargo, según una realización preferida adicional de la presente invención, se usa agua de red como agua de partida para la producción de AAP. Se emplea aire (12) como gas para la producción de plasma, ya que es el gas que produce más radicales OH* y además es el más barato. El sistema consta además de un generador de potencia (14) y dos electrodos (16, 18) . Cuando el aire (12) pasa a través del sistema, se produce un flujo de plasma (20) que se proyecta sobre el depósito (10) de agua, dando lugar a las interacciones plasma-agua (22) que producen las especies reactivas mediante las reacciones químicas anteriormente descritas. Los parámetros empleados para la generación de AAP según la realización preferida de la presente invención son los siguientes: Gas de plasma: aire Flujo de gas de plasma (aire) : 60 slm Potencia de plasma: 500 W Volumen de agua tratada: 2 litros de agua destilada Tiempo de procesamiento: entre 1, 5 y 30 min La tabla 1 a continuación muestra la nomenclatura de las cuatro muestras de AAP producidas mediante los ensayos descritos en el presente documento y el tiempo durante el ual se sometió a tratamiento con plasma el agua de partida para la producción de cada una de dichas muestras: Tabla 1 Mediante ensayos que se describirán más adelante en el presente documento, se ha determinado que las características fisicoquímicas de un AAP que reduce significativamente la carga de Brettanomyces son: pH < 4, 5, CE (conductividad eléctrica) > 50 pS/cm, ORP (potencial de oxidación-reducción) > 350 mV, NO3- > 3 mg/l y NO2' > 0, 5 mg/l. Una vez producida el AAP, se procede a emplear la misma en el método de tratamiento desinfectante/descontaminante de la presente invención. Sin embargo, antes de realizar esta etapa de desinfección/descontaminación mediante puesta en contacto con AAP, conviene limpiar la superficie del material que va a desinfectarse/descontaminarse, sobre todo en el caso de aplicarse el método de tratamiento a recipientes de madera, tales como barricas de madera. La limpieza del interior de la barrica tiene como objetivo eliminar el material incrustado y los sedimentos. Ésta es una práctica habitual en las bodegas y se realiza en la actualidad antes del mechado de sulfuro. Este lavado se suele realizar con agua a alta presión empleando lanzas (24) (véase la figura 2a) . Según una realización preferida adicional de la presente invención, el agua a presión usada en la etapa de limpieza también es AAP. A continuación, se realiza la etapa de puesta en contacto continua del interior de la barrica con AAP. Preferiblemente, esta etapa de puesta en contacto con AAP (desinfección) se realiza inmediatamente después de la etapa de limpieza. El AAP se introducirá en su interior empleando el mismo agujero por el que se introdujo el agua de lavado. Para ello puede emplearse la misma lanza (24) de lavado. Para que el AAP elimine el Brettanomyces de la barrica (tal y como se indicó anteriormente, el Brettanomyces puede alcanzar 8 mm de profundidad de las paredes interiores de la arrica) , ésta debe estar un tiempo suficiente de contacto con toda la superficie interior de la misma (preferiblemente, durante un tiempo de, al menos, 3 horas) . Para ello existen dos alternativas. Según una realización preferida, tal como se muestra en la figura 2b, se llena todo el volumen de la barrica con AAP. Según otra realización preferida alternativa, mostrada en la figura 2c, se introduce un volumen mínimo de AAP en la barrica y se hace girar la barrica de manera continua, de modo que el AAP entre en contacto con toda la superficie interior de la misma. En este caso, el consumo de AAP se reduce significativamente en comparación con la realización mostrada en la figura 2b. Estos sistemas de giro de barricas son comunes en las bodegas y se emplean para vaciar el contenido de las mismas. En el caso de la aplicación del método de tratamiento según la presente invención a la reducción de TCA en corchos, la etapa de puesta en contacto continua de los corchos con AAP se realiza sumergiendo los corchos completamente en AAP en un recipiente adecuado. No se requiere ningún tipo de agitación ni movilización de los corchos, sino que el método de tratamiento es completamente estático. En cualquier caso, el método según la presente invención se realiza preferiblemente a temperatura ambiente y a presión atmosférica. Ejemplos A continuación, se describen varios ejemplos de aplicación del método de tratamiento dado a conocer en el presente documento. 1) Análisis para la cuantificación de las especies reactivas presentes en el AAP: En primer lugar, se llevó a cabo un ensayo de cuantificación de las especies reactivas presentes en cada una de las muestras de AAP preparadas tal como se describió anteriormente. La alta reactividad de las especies secundarias más biocidas presentes en el AAP (OH*, NO*, NO2* y O=NOOH) hace que su detección y cuantificación, especialmente en la fase líquida, deba realizarse de manera indirecta. Los principales métodos de detección de estas especies emplean productos químicos que reaccionan selectivamente con estos radicales ara generar productos relativamente estables que pueden detectarse espectroscópicamente por resonancia paramagnética de electrones, fluorimetría o cromatografía de líquidos de alta resolución (HPLC) . En este caso, para la detección y cuantificación indirecta de las especies reactivas presentes en el AAP se tomó como referencia el método descrito por Lukes et al ("Aqueousphase chemistr y and bactericidal effects from an air discharge plasma in contact with water: evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2 and HNO2", Plasma Sources Sci. Technol. 23 (2014) 015019) . Este método se basa en la reacción entre el fenol (C6H5-OH) y los radicales OH*, NO* y NO2*. Se prepara una solución de fenol en agua (« 2 x 10-2 M) de la que se toman 5 ml para mezclarse con 95 ml de AAP y a continuación se calienta la mezcla a 50°C durante 24 horas. Posteriormente, se filtra la solución con un disco filtrante de 0, 45 m y se somete a cromatografía de líquidos de alta resolución (HPLC) : 20 l; columna C18; fase móvil de 1, 0 ml/min usando el siguiente gradiente de elución: Tiempo total: 16 min; presión: « 90 bares a 90/10, « 60 bares a 60/40; detector DAD a 260 nm (referencia: 699 nm) . Los productos de reacción son: benzoquinona (fenol + OH*) , 4-nitrosofenol (fenol + NO*) y 2-nitrofenol (fenol + NO2*) . Los tiempos de reacción son: hidroquinona: « 5 min, 4-nitrosofenol: « 5, 4 min, fenol: « 8, 2 min y 2-nitrofenol: « 11, 2 min. Para la cuantificación de los productos de reacción (g/l) se prepararon las correspondientes rectas de calibración a partir de la identificación de los valores de absorbancia de soluciones de productos de reacción de concentraciones conocidas. Los patrones de benzoquinona y 2-nitrofenol con una pureza > 98 % se obtuvieron de Sigma-Aldrich (Madrid, España) y el patrón de 4-nitrosofenol con una pureza > 98 % se obtuvo de TCI (Tokio, Japón) . El metanol (> 99, 5 %) se adquirió de Scharlab (Sentmenat, Barcelona, España) . Se prepararon soluciones madre individuales a una concentración de 10-2 M en aguametanol (95-5) y se almacenaron en botellas de vidrio a 8°C. Las rectas de calibración se prepararon por dilución con agua desionizada con las siguientes concentraciones: benzoquinona 1, 35x10-5 M, 2-nitrofenol 1, 60x10-4 M y 4-nitrosofenol 2, 54x10-4 M. Las rectas de calibración fueron las siguientes: Se obtuvieron los cromatogramas de las diversas muestras de AAP objeto de estudio (AAP-1, 5, AAP-5, AAP-15 y AAP-30) en las que se identificaron las señales relativas a los productos de reacción con el fenol de las especies reactivas más importantes en relación con la capacidad desinfectante/descontaminante de la AAP: radicales hidroxilo (OH*; benzoquinona) , nitritos acidificados (NO*; 4-nitrosofenol y NO2*; 2-nitrofenol) y el propio fenol (figura 3) . Debido a la importancia de los radicales hidroxilo para ambas aplicaciones (desinfección de Brett en barricas de madera y reducción de TCA en corchos) , en la figura 4 se identifican con mayor detalle los cromatogramas relativos al radical hidroxilo para todas las muestras de AAP consideradas. Finalmente, se cuantificaron indirectamente (a partir de los productos de reacción con el fenol) cada una de las especies reactivas presentes mediante el método descrito anteriormente y los resultados se muestran en la tabla 2. Tabla 2. Concentración (g/l) de los productos de reacción con fenol 2) Ensayos relativos al procedimiento de desinfección de barricas: Materiales del ensayo Se emplearon barricas de madera de roble empleadas en la elaboración de vino de crianza. Las barricas estaban contaminadas naturalmente con Brettanomyces. Se desmontaron las barricas objeto de estudio y se obtuvieron porciones de duelas de 5 x 5 cm. Se determinó que la contaminación media por Brettanomyces de una muestra configurada por 4 porciones de duelas era de 4, 35 ± 0, 26 logaritmos de células viables por gramo de madera. Tratamientos aplicados Mechado de sulfuroso (tratamiento actual de referencia) : en un frasco de cristal de 4 litros de capacidad se introdujeron 3 duelas contaminadas (5 x 5 cm) . Se colgó una pastilla de azufre de 5 gramos, que se prendió con un mechero, despidiendo así vapores de SO2. Se tapó el bote herméticamente con su tapa y Parafilm y se mantuvo durante 30 minutos. Este procedimiento reproduce a escala las mismas condiciones de aplicación de esta tecnología que se realiza en la actualidad. Inmersión con AAP: Se introdujeron 3 duelas contaminadas naturalmente en recipientes respectivos con 250 ml de las AAP consideradas en el estudio. La cara correspondiente al interior de la barrica quedó totalmente sumergida hasta los 3 cm (los microorganismos penetran hasta 8 mm en el interior de la madera) . Se consideraron 5 tratamientos por inmersión: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1, 5, AAP-5, AAP-15 y AAP-30) . Ensayos realizados Análisis de la inactivación microbiana del AAP: Se marcaron las duelas contaminadas a 10 mm de la superficie tostada. Ésta es la altura a la que se estima que se encuentra todo el Brettanomyces que contamina la madera. En recipientes de plástico, se colocaron de forma independiente las duelas (un recipiente por duela) con la superficie tostada hacia abajo (la superficie correspondiente al interior de la barrica y donde se localiza el Brettanomyces) . Posteriormente se añadieron 250 ml de AAP (cada una de las 4 consideradas) y el agua destilada (que conformó las réplicas del control) . Cada muestra estaba conformada por 3 réplicas. Una vez transcurrido el tiempo de tratamiento (inmersión de 3 horas en todos los casos) , se extrajeron las duelas y se cepillaron hasta 10 mm de profundidad. Se recogieron las virutas en bolsas de plástico estériles que se habían pesado previamente. Una vez recogidas las virutas de madera, se pesaron cada una de las bolsas que las contenía para conocer el peso de virutas recogidas de cada muestra. A continuación, se colocó cada bolsa con la boca abierta dentro de un bote de conserva estéril y se añadieron 600 ml de TSB (caldo de triptona de soja, medio de recuperación) atemperado, cerciorándose de que la viruta quedaba bien empapada. Se sometieron los botes con las bolsas a agitación orbital durante 24 h a 28°C y a 80-100 rpm. Tras ese tiempo de infusión, se sacaron los botes con las virutas del orbital, respetando el orden en que se pusieron a agitar. A continuación, se extrajo el TSB infusionado de cada muestra en la cabina de flujo laminar en condiciones de asepsia. Se tamizó el medio de cultivo infusionado por un visillo estéril y se colocó en botes de centrífuga estériles. A continuación, se procedió a centrifugar las muestras a 4°C, 30 min y 10000 g. Tras la centrifugación se eliminó el sobrenadante de forma inmediata y se resuspendió el sedimento en solución de Ringer (en refrigeración conserva la viabilidad celular hasta 7 días) enrasando a un volumen de 15 ml en tubos de plástico estériles. Finalmente, se analizaron las muestras, primero realizando el tratamiento correspondiente con PMA (monoazida de propidio) y la extracción del ADN de las muestras. Una vez extraído el ADN, se realizó la PCR cuantitativa con EvaGreen, expresando los resultados de la población de Brettanomyces viables en unidades genómicas por gramo de madera (véase la figura 5) . Resultados obtenidos Como puede observarse a partir de la figura 5, el tratamiento con AAP-5 obtiene una reducción de 3, 49 log con respecto de la muestra control (tratada con agua destilada, AD) . El tratamiento con AAP-1, 5 (obtenido con 1, 5 minutos de tratamiento de agua de partida con plasma) obtiene únicamente una reducción de 1, 46 log, lo cual todavía es sin embargo mejor que el tratamiento de referencia mediante mechado de sulfuroso. Los tratamientos con AAP-15 y AAP-30 consiguen una reducción total. Según una realización preferida de la presente invención, el tratamiento con AAP-5 se considera óptimo ya que obtiene una reducción significativa de Brettanomyces (3, 49 log) . Aunque la reducción no es total, como en el caso de AAP-15 y AAP30, el consumo energético con respecto a AAP-15 es 3 veces menor (3 veces menos tiempo de tratamiento de producción de AAP) . Sin embargo, la elección de una u otra de las AAP dadas a conocer en el presente documento, todas las cuales se encuentran dentro del alcance de protección de las reivindicaciones adjuntas, dependerá de las preferencias y restricciones técnicas de la aplicación específica en la que vaya a aplicarse el método de tratamiento dado a conocer en el presente documento. 3) Ensayos relativos al procedimiento de reducción de TCA (2, 4, 6-tricloroanisol) en corchos Materiales del ensayo Se emplearon tapones de corcho 100% natural (para botellas de vino de 750 ml) . Estos corchos no presentaban contaminación por TCA. Se analizaron algunos de los corchos de la serie empleada para descartar la presencia de polihaloanisoles y polihalofenoles. El resultado fue negativo en todos los casos. Se sumergieron 4 corchos sin contaminación en recipientes respectivos de cristal de 95 gramos con 80 ml de una solución preparada con 400 ng/l de TCA. Se dispusieron los recipientes en un agitador rotativo a 50 rpm durante 5 horas. Una vez finalizado el tratamiento, se analizó individualmente cada corcho. La concentración media de TCA de los 4 corchos contaminados artificialmente fue de 26, 59 ± 1, 64 ng/l. Tratamientos aplicados para la reducción de TCA (2, 4, 6-tricloroanisol) Se consideraron 5 tratamientos por inmersión: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1, 5, AAP-5, AAP-15 y AAP-30) . Se emplearon las mismas AAP que las utilizadas para la desinfección de las barricas de madera. Para cada tratamiento se emplearon 3 corchos contaminados artificialmente tal como se describió anteriormente. Se sumergieron (individualmente) los corchos (por triplicado) en recipientes de cristal de 95 gramos con 80 ml de cada tipo de solución (AD y 4 AAP) durante 3 horas. No se empleó ningún tipo de movimiento, ni giro, ni agitación. Nótese que el método de aplicación de las distintas soluciones (AD y 4 AAP) fue el mismo que el empleado para la desinfección de las barricas de madera: 3 horas de inmersión. Ensayos realizados Análisis de polihaloanisoles y polihalofenoles: se analizaron todos los corchos del estudio (corchos contaminados artificialmente, tratados con agua destilada y con AAP) siguiendo los métodos de análisis químicos OIV-MA-AS315-16 (Determinación del 2, 4, 6-tricloroanisol cedido al vino por los tapones de corcho, Resolución OIV/OENO 296/2009) y OIV-MA-AS315-17 (Determinación de los policlorofenoles y de los policloroanisoles en los vinos, los tapones, las maderas y las bentonitas utilizadas como adsorbente de estos compuestos en la atmosfera, Resolución OIV/OENO 374/2009) correspondientes al "Compendio de los métodos internacionales de análisis de los vinos y de los mostos" de la "Organización Internacional de la Viña y el Vino" (OIV) . Estos métodos simulan los fenómenos de migración del 2, 4, 6-tricloroanisol (TCA) , 2, 4, 6-tricloroanisol, 2, 4, 6-triclorofenol, 2, 3, 4, 6-tetracloroanisol, 2, 3, 4, 6-tetraclorofenol, pentacloroanisol y pentaclorofenol susceptibles de producirse entre el tapón de corcho y el vino embotellado. Se ponen a macerar los tapones de corcho en una solución hidroalcohólica hasta la obtención de un equilibrio. Se extraen los polihaloanisoles y polihalofenoles del espacio de cabeza de una parte alícuota del macerado por medio de la técnica de microextracción en fase sólida (SPME) y se analiza por cromatografía en fase gaseosa, con detección por espectrometría de masas (GC/MS) . Resultados obtenidos Los resultados de descontaminación se muestran en la figura 6. Como puede observarse, el ratamiento con AAP-5 produce una reducción del 75, 2% del TCA que contienen los corchos contaminados sin tratar (muestra control) . El tratamiento con agua destilada (AD) no es eficaz en ningún caso. Este hecho sugiere que la contaminación artificial con TCA no es superficial (como ocurre con los corchos contaminados naturalmente) pues el agua destilada no ha "arrastrado" el TCA de la superficie. Suponiendo que el agua destilada y el AAP han alcanzado los poros interiores del corcho, todo el TCA que se reduce proviene de la descomposición obtenida por los radicales hidroxilo (OH*) del AAP. El tratamiento con AAP-1, 5 (obtenido con 1, 5 minutos de generación) obtiene una reducción del 18, 1% del TCA que contienen los corchos contaminados sin tratar Los tratamientos con AAP-15 y AAP-30 consiguen una reducción similar a la de AAP-5. En base a estos resultados, según una realización preferida de la presente invención, el tratamiento con AAP-5 se considera óptimo para la reducción de TCA en corchos, ya que obtiene una reducción significativa de TCA (más del 75%) . Además, el consumo energético con respecto a AAP-15 (que además elimina una cantidad similar de TCA) es 3 veces menor (3 veces menos tiempo de tratamiento de producción de AAP) . Tal como puede apreciarse a partir de los ensayos anteriores, en ambas aplicaciones consideradas en el presente documento (desinfección de Brett en madera y reducción de TCA en corchos) , el tratamiento preferido es el mismo: inmersión estática (de madera y corchos contaminados) durante 3 horas empleando APP-5. El agua activada por plasma, sometida a tratamiento de activación durante 5 minutos (AAP-5) se caracteriza por una concentración de OH* de más de 23 g/l (23, 1 g/l tal como se mostró en la tabla 2 anterior) . Sin embargo, se considera que en otras aplicaciones el uso de AAP-1, 5 (también incluido dentro del alcance de protección definido por las reivindicaciones adjuntas) también puede ser deseable en función de limitaciones técnicas y otros aspectos específicos de la instalación en la que se aplique el método de la presente invención. AAP-1, 5 (agua sometida a tratamiento de activación por plasma durante 1, 5 minutos) se caracteriza por una concentración de OH* de más de 8 g/l (en concreto, 8, 2 g/l tal como se mostró en la tabla 2 anterior) . Del mismo modo se ha considerado que las características fisicoquímicas preferidas del gua activada por plasma (AAP) para la desinfección y/o descontaminación de materiales auxiliares de origen forestal utilizados en la elaboración y conservación del vino son los siguientes: un pH de menos de 4, 5, una CE de más de 50 pS/cm, un ORP de más de 350 mV, una concentración de NO3" de más de 3 mg/l, una concentración de NO2" de más de 0, 5 mg/l y una concentración de OH* de más de 8 g/l, preferiblemente de más de 23 g/l. Dichos parámetros, ya se consiguen con 1, 5 minutos de tratamiento de activación por plasma (AAP-1, 5) . Siendo el tiempo de tratamiento de activación por plasma más preferido de 5 minutos (AAP-5) . Para determinar los valores de pH, CE (conductividad eléctrica) , ORP (potencial de oxidación-reducción) y la concentración de NO3- y NO2-, se han utilizado técnicas ampliamente conocidas en la técnica. Aunque en el presente documento se ha descrito la presente invención haciendo referencia a realizaciones preferidas de la misma, debe entenderse que estas realizaciones tienen carácter explicativo y no limitativo. El experto en la técnica podrá implementar fácilmente modificaciones y variaciones a las realizaciones descritas en el presente documento, sin por ello salir del alcance de protección definido exclusivamente por las reivindicaciones adjuntas.
Publicaciones:
ES2958166 (02/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 06/07/2022 se realizó Registro Instancia de Solicitud
En fecha 06/07/2022 se realizó Admisión a Trámite
En fecha 06/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 12/07/2022 se realizó Superado examen de oficio
En fecha 03/03/2023 se realizó Realizado IET
En fecha 09/03/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 02/02/2024 se realizó Publicación Solicitud
En fecha 02/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
28/06/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 27/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615
El registro de patente nacional por Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615 fue solicitada el 06/07/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615 fue solicitada por UNIVERSIDAD DE LA RIOJA. El registro [modality] por Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615 está clasificado como C12G 1/00,A01P 1/00 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes C12G 1/00,A01P 1/00.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615 está clasificado con la clasificación C12G 1/00,A01P 1/00 por lo que si se desea conocer más registros con la clasificación C12G 1/00,A01P 1/00 clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12
Es posible conocer todas las patentes registradas en la clase C12 (BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUT) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12G
Es posible conocer todas las patentes registradas en la clase C12G (VINO; OTRAS BEBIDAS ALCOHOLICAS; SU PREPARACION ) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A01
Es posible conocer todas las patentes registradas en la clase A01 (AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A01P
Es posible conocer todas las patentes registradas en la clase A01P (BIOCIDAS, SUSTANCIAS QUE REPELEN O QUE ATRAEN A ANIMALES NOCIVOS O PREPARACIONES O COMPUESTOS QUIMIC) entre las que se encuentra la patente Método de tratamiento con agua activada por plasma de materiales auxiliares de origen forestal para la conservación del vino y uso del agua activada por plasma con el número P202230615. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202230612
P202230612