- Home /
- Publicaciones de patentes /
- PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS
PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS
Patente nacional por "PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS"
Este registro ha sido solicitado por
HYDROGEN & INNOVATION, S.L.
a través del representanteSÉNIDA REMEDIOS CUETO PRIEDE
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 06/06/2022
- Número solicitud:
-
P202230493
- Número publicación:
-
ES2957422
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
HYDROGEN & INNOVATION, S.L.
- Datos del representante:
-
Sénida Remedios Cueto Priede
- Clasificación Internacional de Patentes:
- C25B 1/04,C01B 3/02,C02F 1/461
- Clasificación Internacional de Patentes de la publicación:
- C25B 1/04,C01B 3/02,C02F 1/461
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2957422_A11. Un procedimiento de eliminación de compuestos nitrogenados, caracterizado porque comprende realizar una electrolisis de un derivado de urea de fórmula general I: (R1, R2) N-C (=X) -N (R3, R4) donde: X significa NH, NR5 o S R1, R2, R3, R4 y R5 pueden ser iguales o distintos, y significan: - hidrógeno, - grupo alquilo de 1 a 6 átomos de carbono que puede ser lineal o ramificado, no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, - grupo alquilo insaturado con al menos un enlace doble o triple, de 2 a 6 átomos de carbono, que puede ser lineal o ramificado, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales, y/o grupos alquilo saturados o insaturados - cicloalquilo, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados - arilo no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados o de un polímero del compuesto de fórmula I, en un medio acuoso, en al menos una celda electrolítica que comprende: - un ánodo que comprende un metal, donde "metal" significa: - uno o más metales - uno o más compuestos de un metal o mezcla de compuestos de metales - o combinaciones de los anteriores, - y un cátodo metálico, y obtener nitrógeno como resultado de la oxidación de los compuestos nitrogenados en el ánodo e hidrógeno como resultado de la reducción del agua en el cátodo, con la condición de que si el ánodo, es de platino, el cátodo, no es de platino. 2. Un procedimiento según la reivindicación 1, en el que el medio acuoso es un medio básico que se genera con hidróxido de potasio. 3. Un procedimiento según la reivindicación 1, en el que la celda electrolítica comprende al menos un cátodo de platino. 4. Un procedimiento según una de las reivindicaciones 1 a 3, en el que la celda electrolítica comprende al menos un ánodo de níquel o de un compuesto de níquel, o el ánodo es de níquel o de un compuesto de níquel. 5. Un procedimiento según la reivindicación 4, en el que el compuesto de níquel es hidróxido de níquel. 6. Un procedimiento según la reivindicación 5, en el que el hidróxido de níquel es oxidado en el ánodo a oxihidróxido de níquel. 7. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que el compuesto de níquel está depositado sobre titanio poroso. 8. Un procedimiento según la reivindicación 1, en el que el ánodo es de un compuesto de níquel que está depositado sobre titanio poroso. 9. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que se obtiene hidrógeno como resultado de la reducción del agua en el cátodo. 10. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que el derivado de urea es guanidina. 11. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que el derivado de urea es tiourea.
Los productos y servicios protegidos por este registro son:
C25B 1/04 - C01B 3/02 - C02F 1/461
Descripciones:
+ ES-2957422_A1 PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS Campo de la invención La presente invención se enmarca en el campo de la eliminación de compuestos nitrogenados y su aprovechamiento para obtener fuentes de energías limpias, como es el hidrógeno. Estado del arte Los compuestos de nitrógeno se encuentran en exceso en el aire, el agua, el suelo y los alimentos, lo que los convierte en un peligro para la salud pública. Por ejemplo, los nitratos y nitritos son perjudiciales para el hombre como para el medio ambiente y hay una necesidad de reducir su presencia. En particular, se considera especialmente interesante poder aprovecharlos para producir energía. Por otra parte, el hidrógeno es conocido como la fuente de energía del futuro, debido a que es más energético que los combustibles fósiles (gas, carbón y petróleo) e ilimitado. Además, su transformación en energía solo genera vapor de agua, siendo, por lo tanto, totalmente limpia. Actualmente, solo existe un método de electrólisis que sea viable para la obtención de hidrógeno, que es la electrolisis del agua, pero sus aplicaciones en el mercado se ven limitadas por su baja eficiencia en la producción de este elemento, por lo que se acaba obteniendo en un 96 % de los combustibles fósiles, lo que genera una elevada contaminación debido a su extracción. A pesar de ser un campo de investigación abordado por numerosos investigadores, no existe una tecnología que pueda llevar a cabo la transformación de derivados de urea, como tiourea y guanidina, mediante electrolisis para la producción de hidrógeno en un único paso. Este proceso, además de permitir aumentar los recursos de hidrógeno, podrá desnitrificar el agua de ríos, arroyos y plantas de tratamiento de efluentes de aguas residuales municipales. Actualmente, el contenido de nitratos en estas aguas antes de su vertido está regulado, pero las técnicas de desnitrificación disponibles son caras e ineficientes por lo que el desarrollo de tecnologías que permitan la conversión directa de derivados de urea en productos valiosos antes de que se hidrolice naturalmente a amoníaco y derivados nitrogenados tóxicos puede suponer una importante ventaja tecnológica. Derivados de urea aparecen en la bibliografía, bien como electrolitos en algunos procesos o como material para fabricar electrodos, o como fuente de azufre. Por ejemplo, se ha descrito el uso de la tiourea en la fabricación de electrodos en Mixed MoS2/MoO3 Nanostructures for Hydrogen Evolution Reaction; Aftab, Umair; Ansari, Hamza Majeed; (...) ; Ibupoto, Zafar Hussain, 2021-04-01, Journal of Nanoscience and Nanotechnology 21 (4) , pp. 2500-2510. El documento Abdulkadir Levent, Ertugrul Keskin, Yavuz Yardim and Zühre Sentürk; Electrooxidation of thiourea and its square-wave voltammetric determination using pencil graphite electrode; Article in Reviews in Analytical Chemistr y , April 2011; DOI: 10.1515/revac.2011.005 tiene como objetivo detectar el compuesto en el intervalo de concentraciones micromolares y divulga las propiedades electroquímicas de la tiourea en el intervalo de pH de 2, 0 a 12, 0 mediante voltametría cíclica y voltametría de onda cuadrada. El sistema de electrodos usados según este artículo comprendía un electrodo PG (grafito de mina de lápiz) , un electrodo de trabajo de Ag/AgCl/3 M NaCl y un electrodo de referencia (Model RE-1, BAS, USA) , y platino como contraelectrodo. La tiourea fue oxidada en un electrodo de grafito de mina de lápiz. Y se ensayó la aplicabilidad al tratamiento de aguas residuales. Sin embargo, según este artículo no se realiza una electrolisis de tiourea. Por otro lado, el documento JPH02163392 (A) , publicado en 1990, "production of electrode"se refiere a cómo producir un electrodo que tenga una baja sobretensión de hidrógeno y una durabilidad superior mediante la formación de una capa de revestimiento de Ni que contiene azufre sobre un material base, a un pH especificado concreto. El material base es, por ejemplo, un material base de hierro con un baño de Ni de pH<=2 que contiene una sal de Ni tal como NiCh y un compuesto soluble de azufre tal como tiourea. Se obtiene un electrodo que tiene una baja sobretensión de hidrógeno de unos 100-150mV, útil como electrodo para la electrólisis a escala industrial, tal como electrólisis de agua. WO2020213648 (A1) describe el uso de tiourea con el objetivo de conseguir la electrolisis del agua pero se refiere a la obtención de oxígeno (ORRs) . Un catalizador según este documento contiene átomos de Ni, un condensado de tiourea y formaldehído, y carbono poroso. El documento Effect of thiourea on the hydrogen yield in electrolysis, Yazici, B.; Arslan, G.; Erbil, M.; Zor, S.; International Journal of Hydrogen Energy (1998) , 23 (10) , 867-872 e refiere al efecto que tiene el uso de tiourea en la electrólisis para obtener hidrógeno. Así, se analizó el efecto de tiourea en Na2SO4 1.0M + x mM TU (x = 0, 5, 15, 50) a diferentes pH (de 2-8) en una electrolisis usando Pt como electrodo, tanto en el ánodo como en el cátodo. En relación con otros derivados de urea, como la guanidina, el documento EP3054034A1, "amine-containing electmlyte for electmchemical devices", se refiere a cómo aumentar la fiabilidad de dispositivos electroquímicos que operan en medio alcalino, evitando membranas aniónicas y la degradación de componentes de acero inoxidable. La guanidina forma parte de la solución acuosa del electrolito. Otros documentos se refieren a la reacción de guanidina con agua para producir al menos hidrógeno o amoniaco, para accionar una celda de combustible óxido sólido (SOFC) , en la que se oxide el hidrógeno para producir energía eléctrica: Uno de estos documentos es WO2008115662 A2, carbón dioxide sequestering fuel synthesis system and use thereof, pero no se refiere a la electrolisis de la propia guanidina. Otro de estos documentos es WO2012123380, también relativo a la generación de energía a partir de agua y una composición que comprende cianoguanidina, pero no se refiere a la electrolisis de la propia guanidina. Finalmente, WO2017125610A1, se refiere a la guanidina como un posible componente de un electrolito, pero no divulga la electrolisis de la guanidina. Los electrodos, tanto ánodo como cátodo deben cumplir varias funciones para ser útiles en la electrolisis de derivados de urea en la obtención de hidrógeno: - Deben catalizar la reacción de descomposición del derivado de urea. - Deben permitir la generación de burbujas sin bloquear los poros del material activo, entendiendo como "material activo" un material, generalmente utilizado en la superficie del electrodo, por ejemplo, un metal (sería el "metal activo") que cataliza las reacciones redox. - Deben permitir el paso de las especies de interés hacia los centros catalíticos - Deben ser conductores eléctricos para no incurrir en excesivas pérdidas óhmicas. - Deben ser químicamente estables en contacto con el electrolito de carácter básico o neutro (como, por ejemplo, de KOH) . - Deben ser lo más baratos, eficientes y ligeros posible. Todas estas premisas hacen complejo diseñar y fabricar electrodos que cumplan con todas ellas sin problemas. Por esta razón esta invención tiene como objeto la eliminación de compuestos nitrogenados, mediante la electrolisis de los mismos con producción de hidrógeno y nitrógeno. A partir de un derivado de urea, como la tiourea o la guanidina, se obtiene hidrógeno y nitrógeno mediante el tratamiento por vías electroquímicas de efluentes de desecho, de manera directa o indirecta. Es decir, se puede utilizar el efluente de desecho directamente, o compuestos sintetizados artificialmente, o los efluyentes obtenidos y tratados químicamente con anterioridad al proceso de producción de hidrógeno (electrolisis) y nitrógeno. Con esta invención podemos generar hidrógeno y nitrógeno utilizando la misma fuente de energía (derivados de urea) y a precios mucho más competitivos que los combustibles fósiles, restringidos por la UE para los próximos años. Asimismo, podemos aplicar esta tecnología a motores de combustión o pilas de combustible, evitando el gran problema de distribución y almacenamiento de las distintas fuentes energéticas, que producen fuertes costes de canalización y transporte, ya que materias primas como la tiourea y la guanidina son materias adquiribles en cualquier sitio sin restricciones. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere a un procedimiento de eliminación de compuestos nitrogenados, que comprende realizar una electrolisis de un derivado de urea de fórmula general I: (R i , R2) N-C (=X) -N (R3, R4) donde: X significa NH, NR5 o S Ri, R2, R3, R4 y R5 pueden ser iguales o distintos, y significan: - hidrógeno, - grupo alquilo de 1 a 6 átomos de carbono que puede ser lineal o ramificado, no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, - grupo alquilo insaturado con al menos un enlace doble o triple, de 2 a 6 átomos de carbono, que puede ser lineal o ramificado, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales, y/o grupos alquilo saturados o insaturados - cicloalquilo, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados - arilo no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, o es un polímero del compuesto de fórmula I, en un medio acuoso, en al menos una celda electrolítica que comprende: - un ánodo que comprende un metal, donde "metal" significa: - uno o más metales - uno o más compuestos de un metal o mezcla de compuestos de metales - o combinaciones de los anteriores, - y un cátodo metálico, y obtener nitrógeno como resultado de la oxidación de los compuestos nitrogenados en el ánodo e hidrógeno como resultado de la reducción del agua en el cátodo, con la condición de que si uno de los electrodos, por ejemplo, el ánodo, es de platino, el otro electrodo, cátodo, no es de platino. Los sustituyentes de los radicales Ri, R2, R3, R4 y R5 pueden ser uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados. Los heteroátomos pueden ser oxígeno, nitrógeno, azufre, halógenos, fósforo. Los grupos funcionales sustituyentes pueden ser hidroxi, alcoxi, éter, éster, ácido (carboxilo) , amino, ciano, amido, nitro, carbonilo, carbamoilo. Los grupos alquilo saturados o insaturados que pueden ser sustituyentes pueden tener un número variable de átomos de carbono, preferentemente de 1 a 5. La expresión "medio acuoso" significa que dicho medio comprende agua sola, o alcoholes o agua mezclada con alcohol, o agua mezclada con cetonas o combinaciones de los tres componentes. Los alcoholes pueden ser alcoholes de 1 a 6 átomos de carbono, por ejemplo, metanol, etano, propanol, isopropanol, butanol, isobutanol, pentanol, hexanol. Las cetonas pueden ser, por ejemplo, acetona, butanona o pentanona. El medio acuoso, puede ser ácido, básico o neutro. Según realizaciones particulares, y cuando se utiliza un compuesto de níquel en el ánodo, durante la electrolisis se produce, además de la reducción del agua en el cátodo con producción de hidrógeno, una oxidación en el ánodo del compuesto nitrogenado, y al mismo tiempo, en el mismo electrodo, la reacción de oxidación de Ni (OH) 2 a NiOOH. El derivado de urea está preferentemente seleccionado entre tiourea y guanidina. La electrolisis se puede realizar en condiciones tales que: - la concentración de derivado de urea: puede ser cualquiera, por ejemplo, entre 0, 01 y 100 moles /l, - voltaje: puede ser cualquiera, por ejemplo, entre 1 y 100 voltios, - corriente de: puede ser cualquiera, por ejemplo, entre 0.01 y 1 amperios. La función principal del ánodo es que cataliza la oxidación del compuesto nitrogenado. El ánodo puede ser cualquier metal o comprender cualquier metal. El término "metal" incluye las opciones: - un metal - un compuesto de un metal - o una mezcla de metales - una mezcla de compuestos de metales, o una combinación de los anteriores, por ejemplo, hidróxido de níquel, oxihidróxido de níquel, platino, óxido de platino o mezcla de estos. Según realizaciones particulares, el ánodo es, o comprende, una mezcla tales como níquel y platino El componente "metal", tal como se ha definido del ánodo puede ser uno o más metales activos, o compuestos de los mismos, que permiten la transformación electroquímica de los compuestos nitrogenados. Los metales activos pueden ser níquel, paladio, cobalto, ierro, cobre, platino, iridio, rutenio, rodio, titanio o cualquier lantánido como europio, terbio y aleaciones o combinaciones de los mismos, por ejemplo, y en particular, níquel. El ánodo, según realizaciones particulares es de hidróxido de níquel o de oxihidróxido de níquel, o ambos. Se representará por simplicidad ambos casos como "níquel en forma de óxido" o como "níquel óxido/oxihidróxido". La expresión "níquel en forma de óxido" se refiere, si no se indica otra cosa, a cualquiera de níquel hidróxido, a níquel oxihidróxido, o a la mezcla de ambos. El ánodo, según realizaciones particulares adicionales, puede ser un material que comprende níquel en forma de óxido, y platino, más específicamente, níquel hidróxido/platino [Ni (OH) 2/Pt] o níquel oxihidróxido/platino [NiOOH/Pt] para electrolisis. El símbolo "/" en la presente memoria es equivalente a ", ", es decir, que están presentes los materiales o sustancias que se mencionan unidos por dicho símbolo. Además, significa el orden de adición o deposición de un material sobre el material previamente mencionado. A modo de ejemplo: NiOOH/Pt/alótropo de C significa que el Pt se ha depositado o mezclado con NiOOH, y que el alótropo de C se ha depositado sobre, o mezclado con, el material resultante de la mezcla anterior. Los porcentajes indicados en la memoria se refieren a porcentajes en peso - salvo que específicamente se indique otra cosa. Según realizaciones particulares adicionales, el ánodo comprende un metal formado por: - hidróxido de níquel Ni (OH) 2 /platino en cualquier proporción entre Ni y Pt, o - oxihidróxido de níquel (NiOOH/platino (Pt) en cualquier proporción Ni y Pt, por ejemplo, con intervalos de las proporciones entre Ni y Pt de 75-95% de Ni frente a 5 25 % de Pt, más preferentemente entre 80-90% de Ni frente a 10-20 % de Pt. En el ánodo puede haber otros componentes: además del metal, que siempre está presente, puede comprender material semiconductor y/o material fotovoltaico El ánodo puede comprender materiales semiconductores, tales como alótropos de carbono, por ejemplo, grafito, grafeno, nanotubos o fullerenos. Cuando el ánodo comprende una combinación de metal/material semiconductor, las proporciones de metal a material semiconductor pueden ser cualquiera, preferentemente con intervalos de proporciones para el metal de 6-99% respecto al material semiconductor y material semiconductor 1-94 % respecto al metal. El ánodo, según realizaciones particulares adicionales, es de, o comprende (níquel óxido/oxihidróxido) /semiconductor, tal como alótropo de C. En este caso la proporción de (níquel óxido/oxihidróxido) en el ánodo puede ser cualquiera respecto al peso del semiconductor, y en particular, por ejemplo, de 2 a 95% (níquel óxido/oxihidróxido) respecto al peso del semiconductor. Una alternativa particular es una realización en la que el ánodo comprende un metal que comprende Ni (OH) 2/ Pt o NiOOH/Pt en cualquier proporción, entre los componentes del metal (Ni (OH) 2 y Pt, o NiOOH y Pt, ) , y pueden estar depositados sobre, o mezclados con, un material semiconductor, por ejemplo, cualquier alótropo del carbono y más específicamente, grafito o grafeno, nanotubos o fullerenos. Según realizaciones particulares el ánodo comprende una mezcla de metales y material semiconductor, por ejemplo Ni (OH) 2/Pt/alótropo de C o NiOOH/Pt/alótropo de C, en cualquier proporción entre el metal y componente semiconductor, preferentemente con intervalos del metal entre 6-99% respecto al alótropo de carbono y alótropo de carbono 1-94 % con respecto al metal. El ánodo puede comprender, además, material fotovoltaico, término que se debe entender como una sustancia capaz de generar la electrolisis aplicando luz de cualquier longitud de onda sobre ella. Ejemplos de material fotovoltaico son un metal, o un óxido de metal, tal como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2. Según realizaciones particulares adicionales, el ánodo comprende un material formado por una mezcla de metal y material fotovoltaico en cualquier proporción entre el metal respecto al material fotovoltaico y de material fotovoltaico con respecto el metal. Según realizaciones particulares el ánodo es de, o comprende, metal/material fotovoltaico por ejemplo (níquel óxido/oxihidróxido) /material fotovoltaico, tal como (níquel óxido/oxihidróxido) /TiO2. En este caso la proporción del metal (tal como níquel óxido/oxihidróxido) en el ánodo puede ser cualquiera, y en particular, por ejemplo, de 5 a 98% respecto al peso del material fotovoltaico. Según realizaciones particulares el ánodo es de, o comprende (níquel óxido/oxihidróxido) /material fotovoltaico/semiconductor, por ejemplo de (níquel óxido/oxihidróxido) /TiO2/alótropo de C. En este caso la proporción del metal níquel óxido/oxihidróxido en el ánodo puede ser cualquiera, y en particular, por ejemplo, de 5 a 98% respecto al peso del conjunto del material semiconductor y fotovoltaico. Una alternativa preferente adicional es una realización en la que el ánodo comprende un metal de Ni (OH) 2/ Pt o NiOOH/Pt en cualquier proporción entre los componentes del metal, depositado o mezclado con un material fotovoltaico como TiO2 , WO3, ZnO, CdS, Fe2O3 y SnO2, específicamente TiO2, en un rango de proporciones del metal comprendidas entre 1-94% con respecto al material fotovoltaico. "Entre los componentes del metal" significa entre Ni (OH) 2 y Pt o entre NiOOH y Pt. Según realizaciones particulares adicionales, el ánodo comprende Ni (OH) 2/Pt/TiO2 o NiOOH/Pt/TiO2 depositado sobre, o mezclado con, un material semiconductor, preferentemente, cualquier alótropo de carbono, como grafito, grafeno, nanotubos o fullerenos. En el caso de incluir TiO2, Ni (OH) 2 o NiOOH y Pt y TiO2 están mezclados y aglomerados estando la granulometría del aglomerado en torno a los micrometros o inferior. Según realizaciones particulares adicionales, el ánodo comprende un material formado por una mezcla de Ni (OH) 2/Pt/TiO2 o NiOOH/Pt/TiO2 en cualquier proporción entre la mezcla de Ni (OH) 2 o NiOOH y Pt, y el TiO2, por ejemplo, de 5-50% la mezcla de Ni (OH) 2 o NiOOH y Pt, y el TiO2, respecto al material fotovoltaico y una proporción de 50-95 %de TiO2 con respecto al metal. Según realizaciones particulares adicionales, el ánodo comprende una mezcla Ni (OH) 2/Pt/TiO2/alótropo de carbono en todas sus formas o NiOOH/Pt/TiO2/alótropo de carbono en todas sus formas y en cualquier proporción entre Ni y Pt, preferentemente Ni (OH) 2 o NiOOH (5-97%) , Pt (1-93%) y T O (1-93 %) , Carbono (1-93%) . En el contexto de la invención "níquel" se debe entender que puede ser el metal elemental, el óxido de níquel, el oxihidróxido de níquel o la mezcla del óxido y del oxihidróxido de níquel. Una alternativa preferente adicional, es una realización en la que el ánodo comprende - Ni (OH) 2/Pt/material fotovoltaico/material semiconductor en cualquier proporción entre Ni y Pt - o NiOOH/Pt/ material fotovolatico /material semiconductor en cualquier proporción entre Ni y Pt preferentemente en las proporciones siguientes de los componentes del metal: Ni (OH) 2 o NiOOH de Ni, Pt en un 7-98% del metal respecto a los otros componentes, material fotovolatico 1-93 % y material semiconductor (1-93%) , respecto al metal. Una alternativa adicional, es una realización en la que el ánodo comprende Ni (OH) 2/Pt o NiOOH/Pt en cualquier proporción entre Ni y Pt, depositado o mezclado sobre un material fotovoltaico como, TiO2, WO3, ZnO, CdS, Fe2O3 y son2, específicamente TiO2 y a su vez depositado o mezclado sobre un material semiconductor, más específicamente grafito, grafeno, nanotubos o fullerenos. El ánodo de la presente invención puede tener cualquier forma, tales como laminar o cilíndrica. Según realizaciones particulares, el ánodo comprende un compuesto de níquel depositado sobre titanio poroso, preferentemente, hidróxido de níquel depositado sobre titanio poroso. Para la obtención del ánodo, concretamente, de hidróxido de níquel depositado sobre colectores de corriente de titanio poroso, se pueden utilizar métodos convencionales de aplicación con Pistola de Aerografía y colaje en cinta. Según realizaciones particulares, un primer procedimiento de obtención del ánodo comprende la deposición de hidróxido de níquel sobre colectores de corriente de titanio poroso mediante aerografía. Según realizaciones particulares, un segundo procedimiento de obtención del ánodo comprende la deposición de hidróxido de níquel sobre colectores de corriente de titanio poroso mediante colaje en cinta, siendo esta técnica la que ha permitido fabricar electrodos estables y reproducibles. El cátodo puede comprender cualquier metal, o mezclas de metales. Ejemplos preferentes de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido como europio o terbio y mezclas y aleaciones de los mismos, por ejemplo y más preferentemente, platino (Pt) . Cualquier cátodo según la invención se puede combinar con cualquier ánodo según la invención. Una alternativa particular es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción entre ellos, soportado o mezclado sobre un material semiconductor. Ejemplos de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido como europio o terbio y mezclas y aleaciones de los mismos, depositados o mezclados sobre un material semiconductor, como cualquier alótropo de carbono, preferentemente grafito, grafeno, anotubos y fullerenos. Según realizaciones particulares el metal es Pt soportado o mezclado sobre un material semiconductor, preferentemente, alótropo de carbono, preferentemente grafito, grafeno, nanotubos y fullerenos. Una alternativa adicional es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción entre ellos, depositados o mezclados con un material fotovoltaico. Ejemplos preferentes de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido, como europio o terbio, y mezclas y aleaciones de los mismos, soportados sobre o mezclados con un material fotovoltaico, preferentemente, Pt depositado o mezclado con un material fotovoltaico, como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2, preferentemente, TiO2. Una alternativa adicional es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción, tales como cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido, como europio o terbio, y mezclas y aleaciones de los mismos, que puede ir depositado mezclado sobre un material semiconductor, específicamente grafito en todas sus formas o grafeno en todas sus formas y a su vez soportado o mezclado sobre un material fotovoltaico como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2. Según realizaciones particulares, el cátodo es de platino. La presente invención se refiere además a una celda electrolítica o conjunto de celdas que comprende uno o varios ánodos tal como el ánodo que se ha definido anteriormente. Dicha celda, o conjunto de celdas, puede comprender además uno o varios cátodos, electrolitos, separadores y diversos catalizadores, como bases, por ejemplo KOH, cromóforos como aquellos derivados rutenio o iridio o compuestos orgánicos como tiourea para mejorar la velocidad de la reacción con concentraciones de éstos dependiendo del tamaño de la celda y del volumen y concentración de electrolito. La celda electrolítica puede estar constituida por cualquier material normalmente utilizado en la técnica, con las particularidades que pueda imponer una realización concreta, por ejemplo, en el caso de la celda cuyos electrodos utilicen materiales fotovoltaicos se utilizan mezclas de materiales o un solo material que permita el paso de la luz en cualquier intervalo del espectro electromagnético, específicamente cuarzo. Según realizaciones particulares, la presente invención se refiere también a una celda electrolítica que comprende el ánodo que se ha definido anteriormente para pilas de combustible de electrolito polimérico. La forma tanto del ánodo y del cátodo podrá ser cualquier estructura geométrica o amoría, específicamente laminar, rectangular o cilíndrica. La absorción de los compuestos nitrogenados tiene lugar en el ánodo. Por lo tanto, el componente conductor del ánodo es uno o más metales activos que permiten la transformación electroquímica de los compuestos nitrogenados. En cuanto a los elementos pasivos incluyendo como tales agentes conductores, aglomerantes y colectores de corriente, se pueden usar aquellos que están comercialmente disponibles. Cuando la electrolisis se realiza en medio básico, el medio básico se puede generar con compuestos como hidróxidos de metal, carbonatos, fosfatos, hidrógeno fosfatos, , donde el metal puede ser cualquier elemento químico alcalino (por ejemplo, K2HPO4, KH2PO4, ) , alcalinotérreo, metales de transición, lantánidos, actínidos, metales del bloque p, o no metales. Según realizaciones particulares el medio básico es generado con KOH. Los electrolitos utilizados pueden ser derivados de urea según la fórmula I indicada, tales como, tiourea, polímeros de tiourea o mezclas de cualquiera de ellos, guanidina, polímeros de guanidina. Cualquiera de ellos o sus mezclas se puede utilizar para cualquier alternativa de la invención. Dichos electrolitos podrán encontrarse disueltos, en estado líquido o sólido. Dichos electrolitos podrán actuar en la producción de hidrógeno y nitrógeno directamente o como catalizadores. Por ejemplo, la tiourea puede ser el electrolito de donde se obtiene el hidrógeno y el nitrógeno, pero también puede mezclarse en pequeñas proporciones con otro derivado de urea para facilitar la eletrooxidación del mismo, actuando en ese caso como un catalizador. Se podrán utilizar como catalizadores de la reacción cualquier cromóforo, y de forma más específica, derivados de rutenio y de iridio. De manera preferente, la celda electrolítica comprende un cátodo de platino y un ánodo de un compuesto de níquel, y de forma más preferente, el compuesto de níquel está depositado sobre titanio poroso. Según realizaciones particulares la celda electrolítica para realizar electrolisis de un derivado de urea en medio básico, comprende: - un cátodo de hidróxido de níquel depositado sobre titanio poroso, - un ánodo unido al cátodo de Pt, mediante un agente conductor, - una disolución de KOH acuoso como base. Según realizaciones particulares adicionales la celda contiene electrodos de los siguientes materiales: • Cátodo: Lámina de Platino. • Ánodo: material que comprende una mezcla Ni (OH) 2/Pt/material fotovoltaico o NiOOH/Pt/material fotovoltaico en cualquier proporción entre Ni y Pt. Según realizaciones particulares adicionales, la celda contiene electrodos de los siguientes materiales: • Cátodo: Lámina de Platino • Ánodo: material que comprende por una mezcla Ni (OH) 2/Pt/material fotovoltáico/alotropo de C en todas sus formas o NiOOH/Pt/ material fotovoltáico/alótropo de C en todas sus formas y en cualquier proporción entre Ni y Pt. La celda puede tener electrodos separados en dos compartimentos. También puede ser una celda de tres o más electrodos. Según una realización particular, durante la aplicación de corriente a la celda electroquímica, el derivado de urea, preferentemente tiourea o guanidina, contenido en una disolución de hidróxido potásico (KOH) se oxida en el ánodo, que consiste en un electrodo poroso de hidróxido de níquel (positivo) , y al mismo tiempo, en el mismo electrodo tiene lugar la reacción de oxidación de Ni (OH) 2 a NiOOH que sirve de catalizador de la descomposición del derivado de urea. El electrodo negativo, consistente en una malla de platino es donde ocurre la reacción de reducción alcalina de agua con producción de hidrógeno. La presente invención demuestra que la guanidina y la tiourea representan una alternativa a la urea por sus similares prestaciones de eliminación de contaminantes nitrogenados y mejores valores de consumo de energía. Por lo tanto, representan una ventaja sobre el estado de la técnica conocido. Se ha conseguido gracias a la presente invención mejorar los cátodos a fin de evitar interferencias debidas a la presencia de compuestos nitrogenados que pueden provocan reacciones secundarias. Una ventaja de usar como compuesto nitrogenado tiourea o guanidina, es que comprenden 4 o 5 átomos de hidrógeno respectivamente y sumadas a las moléculas de agua que contienen 2 átomos de hidrógeno el proceso de electrolisis se obtiene con mayor eficiencia, con menor utilización de energía y mayor generación de hidrógeno que la electrolisis del agua (usada en otras celdas de combustible) que contiene solo 2 átomos de hidrógeno. Los compuestos nitrogenados como tiourea o guanidina se oxidan en el ánodo, mientras que la reducción (por ejemplo, alcalina) del agua se produce en el cátodo. Reacción para la tiourea en el caso particular de electrolisis alcalina: (1) Ánodo: CS (NHz) z (aq) + 6OH- N2 (g ) + 5H20 + CO (aq) +S (aq) + 6e - (2) Cátodo: 6H20 + 6e - 3 H 2 (g) + 60H- (3) Reacción global: CS (NH2) 2 (aq) + H2O N2 (g) + 3H2 + CO (aq) +S (aq) Reacción global para la guanidina. Reacción global: CNH (NH2) 2 (aq) + H2O 1, N2 (g) + 3+ H2 + CO (aq) BREVE DESCRIPCIÓN DE LAS FIGURAS La figura 1 muestra una representación esquemática de un electrolizador para descomponer derivados nitrogenados. Donde N-BCs significa "derivados nitrogenados" La figura 2 muestra una curva de potencial - tiempo y a la derecha una curva de corriente frente a potencial. Figura 3. Electrodos de Ni (OH) 2 conformados mediante colaje en cinta. En base a estos resultados se prepararon electrodos mediante colaje en cinta para las pruebas de caracterización electroquímica. La Figura 4. Electrodos de Ni (OH) 2 conformados mediante pistola de aerografía. Muestra el aspecto de los electrodos, después de la aplicación de la tinta y de las pruebas de adherencia. Figura 5a. Voltametrías cíclicas de las disoluciones de KOH 5 M en distintas condiciones y utilizando hidróxido de Ni como ánodo: a) sin ureavelocidad de barrido 10 mV/s (curva 1) y 20 mV/s (curva 2) , T= 25°C en ambas curvas. Figura 5b. Voltametrías cíclicas de las disoluciones de KOH 5 M en distintas condiciones y utilizando hidróxido de Ni como ánodo: b) con urea (0, 33M) ; velocidad de barrido 10 mV/s (curva 1) y 20 mV/s (curva 2) , T= 25°C en ambas curvas. Figura 6a. Ciclovoltametrías (25° C) (10mV/s) con diferentes electrolitos: a) KOH 5 M -blanco b) urea Figura 6b. Ciclovoltametrías (25° C) (10mV/s) con diferentes electrolitos: c) nitrato de guanidina d) tiourea. Figura 6c. superposición de los voltagramas de todos los solutos individualmente ensayados y mostrados en las figuras 5a y 5b. Figura 7a a 7 d. Ciclovoltametrías (10mV/s) con diferentes electrolitos ensayados a diferentes temperaturas (25°C, 40°C, 60°C y 80°C) : a) urea; b) tiourea; c) guanidina. Figura 8. Ensayo de polarización con hidróxido potásico 5M, y con urea 0.33M en KOH 5M. Figura 9. Cronopotenciometrías realizadas en celda completa. Disoluciones 0, 33 M de cada compuesto en KOH 5 M, a 10 mA y 25 °C. Figura 10. Cronopotenciometrías realizadas en celda completa a 2 Ma y a 25°C. El análisis energético se realizó cuando el sistema era estable, en concreto se hicieron medidas de producción de hidrógeno y de consumos entre los minutos 100 y 150 de operación. (1: KOH 5M, 2: urea 0, 33M en KOH 5M, 3: tiourea 0, 33 M en KOH 5 M, y 4: nitrato de guanidina 0, 33 M en KOH 5M) . EJEMPLOS Se realizaron pruebas de los materiales de ánodo más adecuados para la electrooxidación en celda electroquímica con configuración de tres electrodos, y una segunda parte de ensayos de producción de hidrógeno en celda completa con los electrodos seleccionados y con diferentes disoluciones de urea - para comparación - y derivados. Se investigaron características de formulados de electrodos de níquel (NiOOH) con diferentes modos de preparación, y se investigó el comportamiento electroquímico de los mismos en semicelda y en condiciones operativas de electrolisis en una celda completa. La preparación de los formulados de hidróxido de níquel se hizo mediante 2 procedimientos fundamentalmente; colaje en tinta y aplicación de tinta con pistola de aerografía, seleccionando este último método como el más adecuado. Adicionalmente, se llevaron a cabo pruebas de estabilidad térmica y eléctrica de las disoluciones con guanidina y tiourea en las que simulan las condiciones operativas del proceso de electrolisis. Los formulados son soluciones/suspensiones con el material activo (hidróxido de Ni, por ejemplo) mezclado con disolvente acuoso, agente conductor y aglomerante que le den a la mezcla unas condiciones reológicas que permitan su manejo y posterior dispersión sobre un soporte metálico, de modo que permitan su aplicación sobre el ánodo. Se estudiaron las prestaciones electroquímicas de los ánodos de NiOOH, primero en celda electroquímica de tres electrodos y posteriormente en una celda completa que emula un electrolizador, con análisis de producciones de hidrógeno, eliminación de contaminantes y consumos. Preparación de Ánodos Se prepararon ejemplos de formulados de hidróxido de níquel siguiendo diferentes metodologías para obtener electrodos con el material disperso y estabilizado homogéneamente sobre un soporte metálico de titanio poroso. Colaje en cinta La preparación del formulado de hidróxido de níquel mediante el colaje en cinta se fundamenta en la preparación de una suspensión del material activo de interés, es decir, hidróxido de níquel en un medio compuesto por disolvente, por ejemplo (N-metil-2-pirrolidina (NMP) , agente conductor, tal como negro de humo o negro de acetileno, y aglomerante, tal como fluoruro de polivinilideno, PVDF que se cuela sobre una superficie plana deslizante que actúa de soporte, como por ejemplo titanio poroso, por la que se pasa una cuchilla que nivela la suspensión, dando lugar a una película de anchura y espesor controlados, por ejemplo 2-3 cm de anchura y 50-100 ^m de espesor. Posteriormente, cuando se evapora el disolvente, las partículas se consolidan para dar ugar a una pieza que adaptada mecánicamente puede ser usada como electrodo. Para aplicar el proceso de colaje de cinta a la preparación de electrodos se usó un equipo COATMASTER Mod 510, Erichsen, Alemania. Las muestras (aquellos electrodos con consistencia adecuada y cargas másicas en torno a 10-15 mgNi (OH) 2/cm2 que son las óptimas para la aplicación deseada (composición: 7:1:2 de hidróxido de níquel, negro de humo y PVDF) ) del formulado de hidróxido de níquel mediante el colaje en cinta se prepararon en forma de tinta del siguiente modo Una vez pesados todos los componentes, se echan en un vaso de precipitados de 250 mL y se va añadiendo poco a poco el disolvente N-Metil-2-pirrolidina (NMP) mientras se va realizando la agitación vigorosa de la mezcla usando una varilla de vidrio. El objetivo final es obtener una pulpa adecuada. Se estudiaron diferentes composiciones esencialmente modificando el contenido (8:1:1, 6:2:2, 7:2:1 y 7:1:2, de hidróxido de níquel, negro de humo y PVDF) de aglomerante. Las tintas que mejor resultado dieron se prepararon dispersando en un homogeneizadordispersor una mezcla que contiene 1.6 g de hidróxido de níquel, 0.2 g de negro de humo y 0.5 g de PVDF en 10 mL de N-Metil-2-pirrolidina (NMP) , todos ellos reactivos suministrados por Alfa Aesar. Posteriormente se dejaron secar a 110°C a vacío, de forma que se evaporó el disolvente y quedó el material puro consistente en hidróxido de níquel y negro de humo. Los electrodos obtenidos por este procedimiento mostraron consistencia y cargas másicas en torno a 10-15 mgNi (OH) 2/cm2 que son adecuadas para la aplicación deseada. En la figura 3 se muestra el aspecto de los electrodos. Ensayos de estabilidad térm ica de los e lectro litos Para estudiar la estabilidad de las disoluciones con contaminantes nitrogenados se diseñaron ensayos térmicos en los que se sometieron las diferentes muestras; disolución 0.33 M de tiourea en hidróxido potásico 5M, disolución 0.33 M de nitrato de guanidina en hidróxido potásico 5M, y disolución 0.33 M de urea en hidróxido potásico 5M, a varias temperaturas en presencia y en ausencia de electrodos de Ni (OH) 2 preparados por colaje en cinta. Se usaron vasos de vidrio y baños termostatados. Las muestras se sometieron a diferentes temperaturas 40, 60 y 80° C durante varios periodos de tiempo (1, 5 y 10 horas) , y se efectuaron inspecciones visuales del electrolito. Se evaluaron las características de estabilidad térmica de los derivados de nitrógeno mencionados con dos enfoques; estabilidad de las disoluciones de componentes con 0.33 M de concentración en vasos termostatados, y estabilidad con la misma configuración añadiendo dos electrodos conectados entre sí y sin aplicación de corriente. El calentamiento se realizó por etapas (40-60-80°C) , una vez alcanzada la temperatura se mantuvo durante un tiempo determinado observando posibles cambios en la coloración de la disolución o en la aparición de precipitados. La Tabla 1 recoge el esquema del ensayo realizado y los resultados sin electrodos y con electrodos sumergidos y conectados entre sí después de 5 horas a 80°C. Tabla 1. Etapas del ensayo de estabilidad térmica y observaciones registradas para cada disolución. Los resultados indican que el aumento de temperatura por sí solo no produce cambios significativos en la disolución (salvo en el caso de la tiourea, donde la coloración se intensifica a 80° C) . Sin embargo, cuando se introducen electrodos y se cortocircuitan se observa la aparición de sólidos en suspensión, siendo esta presencia más claramente observada en la disolución de tiourea. También, en la disolución de guanidina se observan ciertas partículas en suspensión. Caracterización de las reacciones de los electrolitos en semicelda Para estudiar los procesos electroquímicos de los diferentes ánodos preparados se realizaron experimentos de voltametría cíclica. El procedimiento consiste en aplicar un sobrepotencial al electrodo de estudio, también llamado de trabajo (WE) , frente a un electrodo de referencia (RE) desde un voltaje inicial hasta un potencial límite, lo que se conoce como ventana de potencial que debe cubrir las zonas en las que ocurren las reacciones de interés, para posteriormente realizar el barrido inverso mientras se registra la señal de intensidad que se experimenta en el electrodo de trabajo en lo que sería equivalente a electrones liberados (reacciones de oxidación) y que tienen que ser consumidos en un electrodo de auxiliar llamado contraelectrodo (CE) en el que tiene lugar una reacción de reducción, todo ello a una velocidad de barrido definida. Este procedimiento genera una curva triangular de potencial-tiempo y otra que corresponde con la intensidad de corriente medida como respuesta a la aplicación del sobrepotencial, tal como se puede observar en las imágenes izquierda y derecha de la Figura 2, respectivamente. Respecto a la interpretación de esta última, al aplicar una diferencia de voltaje al electrodo de trabajo se promueve que el potencial supere al potencial termodinámico de las posibles reacciones redox que pueden tener lugar en la interfase disolución-electrodo en función de especies contenidas en la misma. Esencialmente se promueven dichas reacciones bajando su energía de activación. Esto se observa claramente en la curva intensidad-voltaje de la Figura 2 llamada Voltametría Cíclica, hacia potenciales negativos (a la izquierda) , región en la que la intensidad de corriente medida como respuesta a la aplicación de voltaje modifica de tal manera las energías de activación de las reacciones redox que hace que, cuando se llega a ese tramo de la curva la corriente sea creciente en magnitud con valores negativos indicativos de que están teniendo lugar reacciones de reducción en el electrodo de trabajo. Este fenómeno se intensifica a medida que se desplaza el potencial a valores todavía más negativos porque la energía de activación de la reacción se hace cada vez menor y se produce por tanto un aumento de la velocidad de la reacción, provocando un aumento súbito de la corriente que da forma al inicio de un pico apuntando hacia corrientes negativas. Sin embargo, en ese punto como consecuencia de la alta velocidad, la especie oxidada, que es el reactivo que protagoniza la reacción de reducción, comienza a escasear en las inmediaciones de la interfase disolución-electrodo. Cuando la velocidad es moderada hay especies disponibles en la superficie del electrodo que van reponiendo a las que habían reaccionado, pero cuando la velocidad es elevada, no es posible acceder a las especies reaccionantes a la misma velocidad que éstas desaparecen, por lo que, una ez alcanzado el máximo, la corriente decrece de forma súbita dando la forma de pico que se ve en la Figura 2. Posteriormente cuando el barrido de potencial se acerca a la misma región, pero en el barrido de voltaje a valores positivos, se observa el mismo comportamiento con el reactivo en forma reducida que procede a oxidarse y aparece una señal de corriente, esta vez de valores positivos, con forma de onda. La combinación del pico de oxidación y el de reducción se conoce como picos de reacción redox y se puede asociar a las reacciones redox de interés. Atendiendo a la forma de estos picos se pueden interpretar los fenómenos redox que ocurren en el sistema, específicamente porque presentan una densidad de corriente y una separación entre los picos de oxidación y de reducción cuya magnitud es indicativa de la reversibilidad electroquímica y de la cinética de las reacciones de estas especies. En la caracterización de ánodos, se utilizaron celdas comerciales de vidrio en configuración de tres electrodos. El electrodo de trabajo consistía en una lámina de titanio poroso (grado 2 >99% Titanium Metals UK Limited (TML) ) con un área efectiva de entre 2 y 5 cm2, controlada mediante un recubrimiento de teflón y adhesivo termofusible en la superficie lateral y posterior del electrodo. Como electrodo de referencia se utilizó Hg/HgO (1M NaOH) y como contraelectrodo, una malla de platino de área considerablemente superior a la del electrodo de trabajo (12.5 cm2) . La distancia entre el electrodo de trabajo y el de referencia era de unos 2 cm aproximadamente, por lo que se asumió cierta imprecisión en las medidas debido al efecto de las pérdidas Óhmicas. Para llevar a cabo los experimentos a diferentes temperaturas se usaron baños termostáticos que permitieron operar en un intervalo de entre 25 y 80°C. Resultados Se prepararon electrodos mediante colaje en cinta para las pruebas de caracterización electroquímica. Para estudiar las prestaciones electroquímicas de los electrodos, se llevaron a cabo ensayos de voltametrías cíclicas en celdas de tres electrodos: Las celdas se rellenaron con 75 mL de disolución de los electrolitos en agua (las concentraciones se muestran más abajo) , urea, tiourea y guanidina en cada caso y la temperatura se controló mediante la utilización de un baño termostático. Se realizaron experimentos a distintas temperaturas, obteniendo los mejores resultados a temperatura ambiente. Después se investigó la actividad catalítica de los materiales de hidróxido de níquel mediante voltametrías cíclicas entre 0.0 y 0.8 VHg/HgO en disoluciones de KOH 5 M en presencia y ausencia de urea, tiourea y nitrato de guanidina a una concentración de electrolito (tiourea, guanidina) de 0.33 M. Ensayos con urea a 25°C Se llevó a cabo un estudio de las propiedades electroquímicas de las disoluciones de urea en condiciones de temperatura ambiente a fin de validar el sistema experimental y disponer de valores de referencia con los que poder comparar. En la Figura 5 se muestran las voltametrías cíclicas de disoluciones en presencia y en ausencia de urea, en base KOH 5 M. En el sistema sin urea (Figura 5a) se pueden observar claramente los picos tanto de la oxidación de Ni (OH) 2 a NiOOH como su reducción en potenciales de 0.52 y 0.20 VHg/HgO siendo de mayor densidad de corriente y con mayor separación entre picos cuando la velocidad de barrido es más rápida. Estas reacciones son bien conocidas en medio alcalino y responden a la siguiente ecuación: Si el barrido se extiende a valores de potencial ligeramente más positivos en torno a 0.70 VHg/HgO, puede observarse el incremento en corriente asociado a la evolución de oxígeno debido a la descomposición del agua que, en medio alcalino, progresa según la siguiente ecuación: Si se está rompiendo la molécula de agua de la disolución, en el electrodo auxiliar (CE) deben estar ocurriendo las reacciones asociadas a la generación de hidrógeno (Ecuación 3) , y así quedó constatado con la visualización de burbujeo en la malla de platino usada como electrodo auxiliar durante los experimentos. Además, aunque no se muestra en el voltamograma, el voltaje en el electrodo auxiliar fue registrado y se observó estable en valores próximos a -1.15 VHg/HgO. Con estos valores de potencial, tanto de la evolución de oxígeno como de generación de hidrógeno es posible estimar que, en una celda de electrolisis con electrodos de platino e hidróxido de níquel en los electrodos negativo y positivo respectivamente, en una disolución de 5 M KOH en ausencia de urea, pueden esperarse tensiones de celda quivalentes a la diferencia entre las reacciones del electrodo positivo menos el negativo, es decir alrededor de 1.85 V. La reacción global se describe a continuación, con producción del doble de hidrógeno que de oxígeno: Cuando se utilizan disoluciones con urea (¡Error! No se encuentra el origen de la referencia.b) , no fue posible observar el pico de oxidación a NiOOH con claridad. La forma de las voltametrías indica una transición directa a la descomposición de urea sin la formación de NiOOH. Sin embargo, a la oxidación de Ni (OH) 2 a NiOOH se le atribuyen propiedades catalíticas para descomponer la urea, que es el proceso que se observa si el barrido se extiende a valores de potencial ligeramente más positivos en valores próximos a 0.55 VHg/HgO con burbujeo intensivo en el electrodo, que puede atribuirse a la formación de nitrógeno mientras se reduce el agua en el contra electrodo que produce hidrógeno, igual que en el proceso sin urea. Por lo tanto, durante el barrido anódico, la urea contenida en la disolución se oxida según la reacción que se detalla a continuación: Después, en el barrido catódico, puede observarse un bucle que suele asociarse a procesos de nucleación relacionados con la electrodeposición de alguna especie. Además, se observa la reducción de NiOOH a Ni (OH) 2. Igual que anteriormente, el voltaje en el electrodo auxiliar se registró y se observó la reducción del agua estable en valores próximos a -1.20 VHg/HgO, por tanto, con potenciales de descomposición de urea en torno a 0.50 VHg/HgO es posible estimar el voltaje de la siguiente reacción global en 1.70 V: Estos valores de voltaje son orientativos ya que indican esencialmente el potencial mínimo que habrá que comunicar para que la electrolisis tenga lugar, En la realidad la diferencia de potencial necesaria para la electrolisis puede ser mayor, debido a la aparición de sobretensiones, especialmente importantes cuando se desprenden gases o cuando se depositan sustancias sobre el electrodo. Ensayos con derivados de urea La reacción global con la urea es: Una vez que la instalación experimental y las condiciones de ensayo fueron validadas con disoluciones de urea se evaluó el comportamiento electroquímico de tiourea, y la guanidina. Ésta última fue preparada en forma de su sal de nitrato porque la sal pura era poco soluble. Aunque se evaluaron diferentes velocidades de barrido, en la figura 6se muestra la recopilación de voltametrías cíclicas de estas disoluciones a 10 mV/s. Se incluyen también como blanco las voltametrías de disoluciones en ausencia de compuestos nitrogenados, en base KOH 5 M. En todas las configuraciones con derivados de urea se observa el mismo comportamiento que en las muestras con la disolución problema de urea, el pico de reducción de NiOOH, ausencia del pico de oxidación probablemente superpuesto con las reacciones de descomposición de compuestos más allá de valores de 0.55 VHg/HgO zona en la que se observa un crecimiento de la curva probablemente por formación de nitrógeno siguiendo la reacción (5) descrita anteriormente. Para la tiourea y guanidina se observan diferencias con la urea, y es que sus potenciales de reducción de NiOOH son más positivos que los observados con urea, alrededor de 0.30 VHg/HgO, frente a la urea (0.25 VHg/HgO) . En términos prácticos esto implica que la polarización del electrodo para que las reacciones de reducción de NiOOH a Ni (OH) 2 tengan lugar requiere que el potencial se alcance a valores menos catódicos, lo cual genera procesos más eficientes energéticamente. Ensayos de los reactivos urea, tiourea, guanidina, a diferentes temperaturas Para estudiar la electrolisis de las disoluciones de urea y sus derivados, se llevaron a cabo voltametrías cíclicas en celda de tres electrodos (en la misma configuración que anteriormente) con una velocidad de barrido de 10 mV/s. En cada ensayo se utilizaron electrolitos y electrodos nuevos, de forma que el efecto de la posible degradación del material y/o del medio no condiciona los siguientes ensayos. Se ensayaron cuatro temperaturas: 25, 40, 60 y 80° C. En la figura 7 se muestran las voltametrías con disoluciones de urea, tiourea y la guanidina. Los resultados indican que, en términos generales las temperaturas más elevadas son más desfavorables para la evolución de las reacciones electroquímicas que las ondiciones de temperatura ambiente. Esto se deduce de la baja densidad de corriente obtenida al aumentar la temperatura, siendo especialmente remarcable a 80° C ya que en todos los electrolitos se reduce la densidad de corriente. Con la guanidina no se aprecian diferencias significativas entre 40 y 60° C, siendo la temperatura ambiente la que muestra mayor intensidad en el voltamograma. En el caso de la tiourea, se aprecia una inestabilidad con el aumento de la temperatura. Caracterización de los e lectro litos y del com portam iento de los e lectrodos en celda com pleta Se realizaron experimentos en una celda completa emulando un electrolizador. La celda, tiene ubicados electrodos en cada uno de los lados, una malla de platino en el compartimento catódico para la producción de hidrógeno y los electrodos preparados con hidróxido de níquel en el compartimento anódico, la celda se llenó con una disolución de urea, o tiourea o guanidina, a través del depósito de alimentación (con las mismas concentraciones que se indicaron en la voltametría) . También se comparó con la electrolisis del agua. El procedimiento consistió en aplicar corriente al sistema formado por los dos electrodos con un potenciostato registrando la evolución del voltaje. Los gases generados en cada compartimento fueron cuantificados en volumen y acumulados para, en momentos puntuales, realizar análisis por cromatografía de gases con diferentes detectores: de conductividad térmica (TCD) y de masas (MS) . Además, se registró la carga aplicada al sistema para correlacionarla con el volumen de hidrógeno generado y calcular así la eficiencia del sistema para la producción de hidrógeno: siendo P la presión del sistema, V el volumen de gas generado, R la constante de los gases, T la temperatura del sistema, Q la carga eléctrica aplicada, N el número de equivalentes y F la constante de Faraday. Con este procedimiento, en el cátodo se producirá hidrógeno y en el ánodo los gases correspondientes dependiendo de la disolución, con KOH se producirá oxígeno y con la urea, la tiourea o la guanidina la ruta principal debe conducir principalmente a formar itrógeno por lo que se propone la siguiente ecuación para estimar la degradación del contaminante. donde Prodgas es el caudal de gas anódico (se estima como nitrógeno puro en el caso de los derivados nitrogenados) en mL/h; meq son el número de moles producidos por la descomposición del derivado nitrogenado; masamat.act. es la cantidad en gramos de material activo presente en el electrodo. Para la aplicación de este estudio se utilizaron electrodos con la misma composición que anteriormente (Nil) H/NiOOH en el ánodo y platino en el cátodo) esta vez con un área efectiva de 5 cm2, controlada mediante un recubrimiento de teflón y adhesivo termofusible en las aristas y el reverso del electrodo. Como cátodo se utilizó una malla de platino de área considerablemente superior a la del electrodo de trabajo (12.5 cm2) . La distancia entre electrodos era de unos 10 cm aproximadamente, por lo que se asumió cierta imprecisión en las medidas debido al efecto de las pérdidas Óhmicas. Para llevar a cabo el estudio en celda completa de las distintas disoluciones de urea, tiourea y guanidina, se utilizó la celda descrita en la sección "caracterización de los electrolitos y del comportamiento de los electrodos en celda completa" con capacidad para 90 mL de disolución. Con ella, se realizaron primero ensayos a corriente constante a una intensidad de corriente, de 2 mA y temperatura ambiente (20-25°C) , y registrando tanto el voltaje de la celda y la carga eléctrica aplicada, como la producción de gases, y posteriormente se llevaron cabo ensayos a en los que se hizo un seguimiento del volumen de producción de hidrógeno para correlacionarlo con la carga eléctrica aplicada. A esta intensidad de corriente la tiourea y la guanidina dan mejores resultados que la urea. Ensayos de polarización Inicialmente, con el objetivo de determinar los sobrevoltajes de las reacciones en unas condiciones de referencia, se realizaron ensayos de polarización sobre disoluciones de KOH 5 M en presencia y en ausencia de disolución de urea que es la base nitrogenada usada de referencia, en los que tras aplicar una determinada corriente durante un corto período de tiempo se registra el voltaje alcanzado. Los resultados se muestran en la Figura 8 y permiten relacionar linealmente el voltaje de la celda con la corriente aplicada, y decidir las intensidades de corriente que se pueden aplicar en la celda completa dispuesta para emular un electrolizador. Los valores de potencial medidos en estos experimentos son elevados comparado con el potencial estándar de electrolisis. Eso es debido a que las semirreacciones que tienen lugar en una celda de electrolisis no son espontáneas y por tanto hay que comunicar, como mínimo, una diferencia de potencial mayor al potencial estándar de la celda para llevarla a cabo. Sin embargo, cuando se realiza electrolisis de sustancias en disolución acuosa resulta difícil de prever el voltaje operativo, ya que pueden existir reacciones en competencia a las principales en ambos electrodos. El que suceda una u otra dependerá de varios factores, como la concentración de la sustancia disuelta, o las características físicas de los electrodos, pero en general la diferencia de potencial necesaria para la electrolisis puede ser bastante mayor que el potencial estándar, debido a la aparición de sobretensiones, especialmente importantes cuando se desprenden gases o cuando se depositan sustancias sobre el electrodo. Como consecuencia, se puede establecer que los potenciales de celda obtenidos en estos experimentos son adecuados para disoluciones con tiourea y guanidina. A la vista de estos resultados, se seleccionó una corriente de 2 mA, para la realización de los ensayos en celda completa. Ensayos en celda com pleta En los experimentos se usaron disoluciones de 90 mL de electrolito aplicando 2 mA de intensidad de corriente. Como ánodo se utilizaron electrodos de 5 cm2 con cargas másicas de material activo [Ni (OH) 2] de 3.5-4.5 mgMNcm2. Se utilizaron electrodos nuevos en cada ensayo. El tiempo de duración del ensayo vino determinado por la producción del volumen mínimo de gas anódico medible en la celda, siendo al menos una hora. En la Figura 10 se muestra la evolución del voltaje con los 3 compuestos estudiados, todos ellos a una concentración de 0, 33 M (0, 33 M en KOH 5M cada uno de ellos) y su comparativa con KOH 5 M que equivaldría a un electrolizador alcalino. El resultado es que el sistema con electrolito de hidróxido potásico conduce al voltaje más alto, mientras que la guanidina y la tiourea, que favorecerían reacciones de oxidación a potenciales menos positivos que la evolución de oxígeno, operan a menos tensión. Esto resulta consistente con los resultados del estudio electroquímico realizado a nivel de celda de tres electrodos En la Figura 10 se muestran las curvas potencial vs. tiempo y en la Tabla 4 se recopilan los valores de voltaje promedio durante el experimento, la producción de hidrógeno en el cátodo, los consumos y la eficiencia, para las 4 disoluciones estudiadas. Se ha simplificado el ensayo atendiendo solamente a la producción de hidrógeno, a la carga aplicada y a la energía consumida. Tabla 1. Cálculos de eficiencias y producciones para los ensayos en celda completa en condiciones a 2 mA. El análisis energético se realizó cuando el sistema era estable, en concreto se hicieron medidas de producción de hidrógeno y de consumos entre los minutos 100 y 150 de operación. Por esta razón, para el análisis comparativo de consumos se tomaron 50 minutos pasado ese momento inicial de estabilización para cada experimento. Los resultados indican que, cuando se compara la ausencia de derivados nitrogenados con su presencia, la producción de hidrógeno transcurre a voltajes significativamente inferiores cuando la disolución contiene derivados nitrogenados, en torno a 1.42-1.45 V, mientras que con KOH 5 M se obtienen valores de 1.63 V. En estas condiciones, produciendo aproximadamente la misma cantidad de hidrógeno, se obtienen diferencias en el consumo energético por kilogramo de hidrógeno producido que muestran que la electrolisis utilizando disoluciones con derivados de nitrógeno y particularmente basados en guanidina y tiourea transcurre con un importante menor consumo energético.
Publicaciones:
ES2957422 (18/01/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 06/06/2022 se realizó Registro Instancia de Solicitud
En fecha 07/06/2022 se realizó Admisión a Trámite
En fecha 07/06/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 15/06/2022 se realizó Superado examen de oficio
En fecha 14/03/2023 se realizó Realizado IET
En fecha 17/03/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 18/01/2024 se realizó Publicación Solicitud
En fecha 18/01/2024 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 28/03/2024 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
Pagos:
06/06/2022 - Pago Tasas IET
+ ES-2957422_A11. Un procedimiento de eliminación de compuestos nitrogenados, caracterizado porque comprende realizar una electrolisis de un derivado de urea de fórmula general I: (R1, R2) N-C (=X) -N (R3, R4) donde: X significa NH, NR5 o S R1, R2, R3, R4 y R5 pueden ser iguales o distintos, y significan: - hidrógeno, - grupo alquilo de 1 a 6 átomos de carbono que puede ser lineal o ramificado, no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, - grupo alquilo insaturado con al menos un enlace doble o triple, de 2 a 6 átomos de carbono, que puede ser lineal o ramificado, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales, y/o grupos alquilo saturados o insaturados - cicloalquilo, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados - arilo no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados o de un polímero del compuesto de fórmula I, en un medio acuoso, en al menos una celda electrolítica que comprende: - un ánodo que comprende un metal, donde "metal" significa: - uno o más metales - uno o más compuestos de un metal o mezcla de compuestos de metales - o combinaciones de los anteriores, - y un cátodo metálico, y obtener nitrógeno como resultado de la oxidación de los compuestos nitrogenados en el ánodo e hidrógeno como resultado de la reducción del agua en el cátodo, con la condición de que si el ánodo, es de platino, el cátodo, no es de platino. 2. Un procedimiento según la reivindicación 1, en el que el medio acuoso es un medio básico que se genera con hidróxido de potasio. 3. Un procedimiento según la reivindicación 1, en el que la celda electrolítica comprende al menos un cátodo de platino. 4. Un procedimiento según una de las reivindicaciones 1 a 3, en el que la celda electrolítica comprende al menos un ánodo de níquel o de un compuesto de níquel, o el ánodo es de níquel o de un compuesto de níquel. 5. Un procedimiento según la reivindicación 4, en el que el compuesto de níquel es hidróxido de níquel. 6. Un procedimiento según la reivindicación 5, en el que el hidróxido de níquel es oxidado en el ánodo a oxihidróxido de níquel. 7. Un procedimiento según una cualquiera de las reivindicaciones anteriores, en el que el compuesto de níquel está depositado sobre titanio poroso. 8. Un procedimiento según la reivindicación 1, en el que el ánodo es de un compuesto de níquel que está depositado sobre titanio poroso. 9. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que se obtiene hidrógeno como resultado de la reducción del agua en el cátodo. 10. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que el derivado de urea es guanidina. 11. Un procedimiento según una cualquiera de las reivindicaciones anteriores en el que el derivado de urea es tiourea.
Los productos y servicios protegidos por este registro son:
C25B 1/04 - C01B 3/02 - C02F 1/461
Descripciones:
+ ES-2957422_A1 PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS Campo de la invención La presente invención se enmarca en el campo de la eliminación de compuestos nitrogenados y su aprovechamiento para obtener fuentes de energías limpias, como es el hidrógeno. Estado del arte Los compuestos de nitrógeno se encuentran en exceso en el aire, el agua, el suelo y los alimentos, lo que los convierte en un peligro para la salud pública. Por ejemplo, los nitratos y nitritos son perjudiciales para el hombre como para el medio ambiente y hay una necesidad de reducir su presencia. En particular, se considera especialmente interesante poder aprovecharlos para producir energía. Por otra parte, el hidrógeno es conocido como la fuente de energía del futuro, debido a que es más energético que los combustibles fósiles (gas, carbón y petróleo) e ilimitado. Además, su transformación en energía solo genera vapor de agua, siendo, por lo tanto, totalmente limpia. Actualmente, solo existe un método de electrólisis que sea viable para la obtención de hidrógeno, que es la electrolisis del agua, pero sus aplicaciones en el mercado se ven limitadas por su baja eficiencia en la producción de este elemento, por lo que se acaba obteniendo en un 96 % de los combustibles fósiles, lo que genera una elevada contaminación debido a su extracción. A pesar de ser un campo de investigación abordado por numerosos investigadores, no existe una tecnología que pueda llevar a cabo la transformación de derivados de urea, como tiourea y guanidina, mediante electrolisis para la producción de hidrógeno en un único paso. Este proceso, además de permitir aumentar los recursos de hidrógeno, podrá desnitrificar el agua de ríos, arroyos y plantas de tratamiento de efluentes de aguas residuales municipales. Actualmente, el contenido de nitratos en estas aguas antes de su vertido está regulado, pero las técnicas de desnitrificación disponibles son caras e ineficientes por lo que el desarrollo de tecnologías que permitan la conversión directa de derivados de urea en productos valiosos antes de que se hidrolice naturalmente a amoníaco y derivados nitrogenados tóxicos puede suponer una importante ventaja tecnológica. Derivados de urea aparecen en la bibliografía, bien como electrolitos en algunos procesos o como material para fabricar electrodos, o como fuente de azufre. Por ejemplo, se ha descrito el uso de la tiourea en la fabricación de electrodos en Mixed MoS2/MoO3 Nanostructures for Hydrogen Evolution Reaction; Aftab, Umair; Ansari, Hamza Majeed; (...) ; Ibupoto, Zafar Hussain, 2021-04-01, Journal of Nanoscience and Nanotechnology 21 (4) , pp. 2500-2510. El documento Abdulkadir Levent, Ertugrul Keskin, Yavuz Yardim and Zühre Sentürk; Electrooxidation of thiourea and its square-wave voltammetric determination using pencil graphite electrode; Article in Reviews in Analytical Chemistr y , April 2011; DOI: 10.1515/revac.2011.005 tiene como objetivo detectar el compuesto en el intervalo de concentraciones micromolares y divulga las propiedades electroquímicas de la tiourea en el intervalo de pH de 2, 0 a 12, 0 mediante voltametría cíclica y voltametría de onda cuadrada. El sistema de electrodos usados según este artículo comprendía un electrodo PG (grafito de mina de lápiz) , un electrodo de trabajo de Ag/AgCl/3 M NaCl y un electrodo de referencia (Model RE-1, BAS, USA) , y platino como contraelectrodo. La tiourea fue oxidada en un electrodo de grafito de mina de lápiz. Y se ensayó la aplicabilidad al tratamiento de aguas residuales. Sin embargo, según este artículo no se realiza una electrolisis de tiourea. Por otro lado, el documento JPH02163392 (A) , publicado en 1990, "production of electrode"se refiere a cómo producir un electrodo que tenga una baja sobretensión de hidrógeno y una durabilidad superior mediante la formación de una capa de revestimiento de Ni que contiene azufre sobre un material base, a un pH especificado concreto. El material base es, por ejemplo, un material base de hierro con un baño de Ni de pH<=2 que contiene una sal de Ni tal como NiCh y un compuesto soluble de azufre tal como tiourea. Se obtiene un electrodo que tiene una baja sobretensión de hidrógeno de unos 100-150mV, útil como electrodo para la electrólisis a escala industrial, tal como electrólisis de agua. WO2020213648 (A1) describe el uso de tiourea con el objetivo de conseguir la electrolisis del agua pero se refiere a la obtención de oxígeno (ORRs) . Un catalizador según este documento contiene átomos de Ni, un condensado de tiourea y formaldehído, y carbono poroso. El documento Effect of thiourea on the hydrogen yield in electrolysis, Yazici, B.; Arslan, G.; Erbil, M.; Zor, S.; International Journal of Hydrogen Energy (1998) , 23 (10) , 867-872 e refiere al efecto que tiene el uso de tiourea en la electrólisis para obtener hidrógeno. Así, se analizó el efecto de tiourea en Na2SO4 1.0M + x mM TU (x = 0, 5, 15, 50) a diferentes pH (de 2-8) en una electrolisis usando Pt como electrodo, tanto en el ánodo como en el cátodo. En relación con otros derivados de urea, como la guanidina, el documento EP3054034A1, "amine-containing electmlyte for electmchemical devices", se refiere a cómo aumentar la fiabilidad de dispositivos electroquímicos que operan en medio alcalino, evitando membranas aniónicas y la degradación de componentes de acero inoxidable. La guanidina forma parte de la solución acuosa del electrolito. Otros documentos se refieren a la reacción de guanidina con agua para producir al menos hidrógeno o amoniaco, para accionar una celda de combustible óxido sólido (SOFC) , en la que se oxide el hidrógeno para producir energía eléctrica: Uno de estos documentos es WO2008115662 A2, carbón dioxide sequestering fuel synthesis system and use thereof, pero no se refiere a la electrolisis de la propia guanidina. Otro de estos documentos es WO2012123380, también relativo a la generación de energía a partir de agua y una composición que comprende cianoguanidina, pero no se refiere a la electrolisis de la propia guanidina. Finalmente, WO2017125610A1, se refiere a la guanidina como un posible componente de un electrolito, pero no divulga la electrolisis de la guanidina. Los electrodos, tanto ánodo como cátodo deben cumplir varias funciones para ser útiles en la electrolisis de derivados de urea en la obtención de hidrógeno: - Deben catalizar la reacción de descomposición del derivado de urea. - Deben permitir la generación de burbujas sin bloquear los poros del material activo, entendiendo como "material activo" un material, generalmente utilizado en la superficie del electrodo, por ejemplo, un metal (sería el "metal activo") que cataliza las reacciones redox. - Deben permitir el paso de las especies de interés hacia los centros catalíticos - Deben ser conductores eléctricos para no incurrir en excesivas pérdidas óhmicas. - Deben ser químicamente estables en contacto con el electrolito de carácter básico o neutro (como, por ejemplo, de KOH) . - Deben ser lo más baratos, eficientes y ligeros posible. Todas estas premisas hacen complejo diseñar y fabricar electrodos que cumplan con todas ellas sin problemas. Por esta razón esta invención tiene como objeto la eliminación de compuestos nitrogenados, mediante la electrolisis de los mismos con producción de hidrógeno y nitrógeno. A partir de un derivado de urea, como la tiourea o la guanidina, se obtiene hidrógeno y nitrógeno mediante el tratamiento por vías electroquímicas de efluentes de desecho, de manera directa o indirecta. Es decir, se puede utilizar el efluente de desecho directamente, o compuestos sintetizados artificialmente, o los efluyentes obtenidos y tratados químicamente con anterioridad al proceso de producción de hidrógeno (electrolisis) y nitrógeno. Con esta invención podemos generar hidrógeno y nitrógeno utilizando la misma fuente de energía (derivados de urea) y a precios mucho más competitivos que los combustibles fósiles, restringidos por la UE para los próximos años. Asimismo, podemos aplicar esta tecnología a motores de combustión o pilas de combustible, evitando el gran problema de distribución y almacenamiento de las distintas fuentes energéticas, que producen fuertes costes de canalización y transporte, ya que materias primas como la tiourea y la guanidina son materias adquiribles en cualquier sitio sin restricciones. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere a un procedimiento de eliminación de compuestos nitrogenados, que comprende realizar una electrolisis de un derivado de urea de fórmula general I: (R i , R2) N-C (=X) -N (R3, R4) donde: X significa NH, NR5 o S Ri, R2, R3, R4 y R5 pueden ser iguales o distintos, y significan: - hidrógeno, - grupo alquilo de 1 a 6 átomos de carbono que puede ser lineal o ramificado, no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, - grupo alquilo insaturado con al menos un enlace doble o triple, de 2 a 6 átomos de carbono, que puede ser lineal o ramificado, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales, y/o grupos alquilo saturados o insaturados - cicloalquilo, no sustituido, o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados - arilo no sustituido o sustituido con uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados, o es un polímero del compuesto de fórmula I, en un medio acuoso, en al menos una celda electrolítica que comprende: - un ánodo que comprende un metal, donde "metal" significa: - uno o más metales - uno o más compuestos de un metal o mezcla de compuestos de metales - o combinaciones de los anteriores, - y un cátodo metálico, y obtener nitrógeno como resultado de la oxidación de los compuestos nitrogenados en el ánodo e hidrógeno como resultado de la reducción del agua en el cátodo, con la condición de que si uno de los electrodos, por ejemplo, el ánodo, es de platino, el otro electrodo, cátodo, no es de platino. Los sustituyentes de los radicales Ri, R2, R3, R4 y R5 pueden ser uno o más heteroátomos, grupos funcionales y/o grupos alquilo saturados o insaturados. Los heteroátomos pueden ser oxígeno, nitrógeno, azufre, halógenos, fósforo. Los grupos funcionales sustituyentes pueden ser hidroxi, alcoxi, éter, éster, ácido (carboxilo) , amino, ciano, amido, nitro, carbonilo, carbamoilo. Los grupos alquilo saturados o insaturados que pueden ser sustituyentes pueden tener un número variable de átomos de carbono, preferentemente de 1 a 5. La expresión "medio acuoso" significa que dicho medio comprende agua sola, o alcoholes o agua mezclada con alcohol, o agua mezclada con cetonas o combinaciones de los tres componentes. Los alcoholes pueden ser alcoholes de 1 a 6 átomos de carbono, por ejemplo, metanol, etano, propanol, isopropanol, butanol, isobutanol, pentanol, hexanol. Las cetonas pueden ser, por ejemplo, acetona, butanona o pentanona. El medio acuoso, puede ser ácido, básico o neutro. Según realizaciones particulares, y cuando se utiliza un compuesto de níquel en el ánodo, durante la electrolisis se produce, además de la reducción del agua en el cátodo con producción de hidrógeno, una oxidación en el ánodo del compuesto nitrogenado, y al mismo tiempo, en el mismo electrodo, la reacción de oxidación de Ni (OH) 2 a NiOOH. El derivado de urea está preferentemente seleccionado entre tiourea y guanidina. La electrolisis se puede realizar en condiciones tales que: - la concentración de derivado de urea: puede ser cualquiera, por ejemplo, entre 0, 01 y 100 moles /l, - voltaje: puede ser cualquiera, por ejemplo, entre 1 y 100 voltios, - corriente de: puede ser cualquiera, por ejemplo, entre 0.01 y 1 amperios. La función principal del ánodo es que cataliza la oxidación del compuesto nitrogenado. El ánodo puede ser cualquier metal o comprender cualquier metal. El término "metal" incluye las opciones: - un metal - un compuesto de un metal - o una mezcla de metales - una mezcla de compuestos de metales, o una combinación de los anteriores, por ejemplo, hidróxido de níquel, oxihidróxido de níquel, platino, óxido de platino o mezcla de estos. Según realizaciones particulares, el ánodo es, o comprende, una mezcla tales como níquel y platino El componente "metal", tal como se ha definido del ánodo puede ser uno o más metales activos, o compuestos de los mismos, que permiten la transformación electroquímica de los compuestos nitrogenados. Los metales activos pueden ser níquel, paladio, cobalto, ierro, cobre, platino, iridio, rutenio, rodio, titanio o cualquier lantánido como europio, terbio y aleaciones o combinaciones de los mismos, por ejemplo, y en particular, níquel. El ánodo, según realizaciones particulares es de hidróxido de níquel o de oxihidróxido de níquel, o ambos. Se representará por simplicidad ambos casos como "níquel en forma de óxido" o como "níquel óxido/oxihidróxido". La expresión "níquel en forma de óxido" se refiere, si no se indica otra cosa, a cualquiera de níquel hidróxido, a níquel oxihidróxido, o a la mezcla de ambos. El ánodo, según realizaciones particulares adicionales, puede ser un material que comprende níquel en forma de óxido, y platino, más específicamente, níquel hidróxido/platino [Ni (OH) 2/Pt] o níquel oxihidróxido/platino [NiOOH/Pt] para electrolisis. El símbolo "/" en la presente memoria es equivalente a ", ", es decir, que están presentes los materiales o sustancias que se mencionan unidos por dicho símbolo. Además, significa el orden de adición o deposición de un material sobre el material previamente mencionado. A modo de ejemplo: NiOOH/Pt/alótropo de C significa que el Pt se ha depositado o mezclado con NiOOH, y que el alótropo de C se ha depositado sobre, o mezclado con, el material resultante de la mezcla anterior. Los porcentajes indicados en la memoria se refieren a porcentajes en peso - salvo que específicamente se indique otra cosa. Según realizaciones particulares adicionales, el ánodo comprende un metal formado por: - hidróxido de níquel Ni (OH) 2 /platino en cualquier proporción entre Ni y Pt, o - oxihidróxido de níquel (NiOOH/platino (Pt) en cualquier proporción Ni y Pt, por ejemplo, con intervalos de las proporciones entre Ni y Pt de 75-95% de Ni frente a 5 25 % de Pt, más preferentemente entre 80-90% de Ni frente a 10-20 % de Pt. En el ánodo puede haber otros componentes: además del metal, que siempre está presente, puede comprender material semiconductor y/o material fotovoltaico El ánodo puede comprender materiales semiconductores, tales como alótropos de carbono, por ejemplo, grafito, grafeno, nanotubos o fullerenos. Cuando el ánodo comprende una combinación de metal/material semiconductor, las proporciones de metal a material semiconductor pueden ser cualquiera, preferentemente con intervalos de proporciones para el metal de 6-99% respecto al material semiconductor y material semiconductor 1-94 % respecto al metal. El ánodo, según realizaciones particulares adicionales, es de, o comprende (níquel óxido/oxihidróxido) /semiconductor, tal como alótropo de C. En este caso la proporción de (níquel óxido/oxihidróxido) en el ánodo puede ser cualquiera respecto al peso del semiconductor, y en particular, por ejemplo, de 2 a 95% (níquel óxido/oxihidróxido) respecto al peso del semiconductor. Una alternativa particular es una realización en la que el ánodo comprende un metal que comprende Ni (OH) 2/ Pt o NiOOH/Pt en cualquier proporción, entre los componentes del metal (Ni (OH) 2 y Pt, o NiOOH y Pt, ) , y pueden estar depositados sobre, o mezclados con, un material semiconductor, por ejemplo, cualquier alótropo del carbono y más específicamente, grafito o grafeno, nanotubos o fullerenos. Según realizaciones particulares el ánodo comprende una mezcla de metales y material semiconductor, por ejemplo Ni (OH) 2/Pt/alótropo de C o NiOOH/Pt/alótropo de C, en cualquier proporción entre el metal y componente semiconductor, preferentemente con intervalos del metal entre 6-99% respecto al alótropo de carbono y alótropo de carbono 1-94 % con respecto al metal. El ánodo puede comprender, además, material fotovoltaico, término que se debe entender como una sustancia capaz de generar la electrolisis aplicando luz de cualquier longitud de onda sobre ella. Ejemplos de material fotovoltaico son un metal, o un óxido de metal, tal como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2. Según realizaciones particulares adicionales, el ánodo comprende un material formado por una mezcla de metal y material fotovoltaico en cualquier proporción entre el metal respecto al material fotovoltaico y de material fotovoltaico con respecto el metal. Según realizaciones particulares el ánodo es de, o comprende, metal/material fotovoltaico por ejemplo (níquel óxido/oxihidróxido) /material fotovoltaico, tal como (níquel óxido/oxihidróxido) /TiO2. En este caso la proporción del metal (tal como níquel óxido/oxihidróxido) en el ánodo puede ser cualquiera, y en particular, por ejemplo, de 5 a 98% respecto al peso del material fotovoltaico. Según realizaciones particulares el ánodo es de, o comprende (níquel óxido/oxihidróxido) /material fotovoltaico/semiconductor, por ejemplo de (níquel óxido/oxihidróxido) /TiO2/alótropo de C. En este caso la proporción del metal níquel óxido/oxihidróxido en el ánodo puede ser cualquiera, y en particular, por ejemplo, de 5 a 98% respecto al peso del conjunto del material semiconductor y fotovoltaico. Una alternativa preferente adicional es una realización en la que el ánodo comprende un metal de Ni (OH) 2/ Pt o NiOOH/Pt en cualquier proporción entre los componentes del metal, depositado o mezclado con un material fotovoltaico como TiO2 , WO3, ZnO, CdS, Fe2O3 y SnO2, específicamente TiO2, en un rango de proporciones del metal comprendidas entre 1-94% con respecto al material fotovoltaico. "Entre los componentes del metal" significa entre Ni (OH) 2 y Pt o entre NiOOH y Pt. Según realizaciones particulares adicionales, el ánodo comprende Ni (OH) 2/Pt/TiO2 o NiOOH/Pt/TiO2 depositado sobre, o mezclado con, un material semiconductor, preferentemente, cualquier alótropo de carbono, como grafito, grafeno, nanotubos o fullerenos. En el caso de incluir TiO2, Ni (OH) 2 o NiOOH y Pt y TiO2 están mezclados y aglomerados estando la granulometría del aglomerado en torno a los micrometros o inferior. Según realizaciones particulares adicionales, el ánodo comprende un material formado por una mezcla de Ni (OH) 2/Pt/TiO2 o NiOOH/Pt/TiO2 en cualquier proporción entre la mezcla de Ni (OH) 2 o NiOOH y Pt, y el TiO2, por ejemplo, de 5-50% la mezcla de Ni (OH) 2 o NiOOH y Pt, y el TiO2, respecto al material fotovoltaico y una proporción de 50-95 %de TiO2 con respecto al metal. Según realizaciones particulares adicionales, el ánodo comprende una mezcla Ni (OH) 2/Pt/TiO2/alótropo de carbono en todas sus formas o NiOOH/Pt/TiO2/alótropo de carbono en todas sus formas y en cualquier proporción entre Ni y Pt, preferentemente Ni (OH) 2 o NiOOH (5-97%) , Pt (1-93%) y T O (1-93 %) , Carbono (1-93%) . En el contexto de la invención "níquel" se debe entender que puede ser el metal elemental, el óxido de níquel, el oxihidróxido de níquel o la mezcla del óxido y del oxihidróxido de níquel. Una alternativa preferente adicional, es una realización en la que el ánodo comprende - Ni (OH) 2/Pt/material fotovoltaico/material semiconductor en cualquier proporción entre Ni y Pt - o NiOOH/Pt/ material fotovolatico /material semiconductor en cualquier proporción entre Ni y Pt preferentemente en las proporciones siguientes de los componentes del metal: Ni (OH) 2 o NiOOH de Ni, Pt en un 7-98% del metal respecto a los otros componentes, material fotovolatico 1-93 % y material semiconductor (1-93%) , respecto al metal. Una alternativa adicional, es una realización en la que el ánodo comprende Ni (OH) 2/Pt o NiOOH/Pt en cualquier proporción entre Ni y Pt, depositado o mezclado sobre un material fotovoltaico como, TiO2, WO3, ZnO, CdS, Fe2O3 y son2, específicamente TiO2 y a su vez depositado o mezclado sobre un material semiconductor, más específicamente grafito, grafeno, nanotubos o fullerenos. El ánodo de la presente invención puede tener cualquier forma, tales como laminar o cilíndrica. Según realizaciones particulares, el ánodo comprende un compuesto de níquel depositado sobre titanio poroso, preferentemente, hidróxido de níquel depositado sobre titanio poroso. Para la obtención del ánodo, concretamente, de hidróxido de níquel depositado sobre colectores de corriente de titanio poroso, se pueden utilizar métodos convencionales de aplicación con Pistola de Aerografía y colaje en cinta. Según realizaciones particulares, un primer procedimiento de obtención del ánodo comprende la deposición de hidróxido de níquel sobre colectores de corriente de titanio poroso mediante aerografía. Según realizaciones particulares, un segundo procedimiento de obtención del ánodo comprende la deposición de hidróxido de níquel sobre colectores de corriente de titanio poroso mediante colaje en cinta, siendo esta técnica la que ha permitido fabricar electrodos estables y reproducibles. El cátodo puede comprender cualquier metal, o mezclas de metales. Ejemplos preferentes de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido como europio o terbio y mezclas y aleaciones de los mismos, por ejemplo y más preferentemente, platino (Pt) . Cualquier cátodo según la invención se puede combinar con cualquier ánodo según la invención. Una alternativa particular es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción entre ellos, soportado o mezclado sobre un material semiconductor. Ejemplos de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido como europio o terbio y mezclas y aleaciones de los mismos, depositados o mezclados sobre un material semiconductor, como cualquier alótropo de carbono, preferentemente grafito, grafeno, anotubos y fullerenos. Según realizaciones particulares el metal es Pt soportado o mezclado sobre un material semiconductor, preferentemente, alótropo de carbono, preferentemente grafito, grafeno, nanotubos y fullerenos. Una alternativa adicional es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción entre ellos, depositados o mezclados con un material fotovoltaico. Ejemplos preferentes de metales son cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido, como europio o terbio, y mezclas y aleaciones de los mismos, soportados sobre o mezclados con un material fotovoltaico, preferentemente, Pt depositado o mezclado con un material fotovoltaico, como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2, preferentemente, TiO2. Una alternativa adicional es una realización en la que el cátodo comprende cualquier metal o mezcla de metales en cualquier proporción, tales como cobalto, cobre, iridio, hierro, níquel, platino, paladio, rutenio, rodio o cualquier lantánido, como europio o terbio, y mezclas y aleaciones de los mismos, que puede ir depositado mezclado sobre un material semiconductor, específicamente grafito en todas sus formas o grafeno en todas sus formas y a su vez soportado o mezclado sobre un material fotovoltaico como TiO2, WO3, ZnO, CdS, Fe2O3 y SnO2. Según realizaciones particulares, el cátodo es de platino. La presente invención se refiere además a una celda electrolítica o conjunto de celdas que comprende uno o varios ánodos tal como el ánodo que se ha definido anteriormente. Dicha celda, o conjunto de celdas, puede comprender además uno o varios cátodos, electrolitos, separadores y diversos catalizadores, como bases, por ejemplo KOH, cromóforos como aquellos derivados rutenio o iridio o compuestos orgánicos como tiourea para mejorar la velocidad de la reacción con concentraciones de éstos dependiendo del tamaño de la celda y del volumen y concentración de electrolito. La celda electrolítica puede estar constituida por cualquier material normalmente utilizado en la técnica, con las particularidades que pueda imponer una realización concreta, por ejemplo, en el caso de la celda cuyos electrodos utilicen materiales fotovoltaicos se utilizan mezclas de materiales o un solo material que permita el paso de la luz en cualquier intervalo del espectro electromagnético, específicamente cuarzo. Según realizaciones particulares, la presente invención se refiere también a una celda electrolítica que comprende el ánodo que se ha definido anteriormente para pilas de combustible de electrolito polimérico. La forma tanto del ánodo y del cátodo podrá ser cualquier estructura geométrica o amoría, específicamente laminar, rectangular o cilíndrica. La absorción de los compuestos nitrogenados tiene lugar en el ánodo. Por lo tanto, el componente conductor del ánodo es uno o más metales activos que permiten la transformación electroquímica de los compuestos nitrogenados. En cuanto a los elementos pasivos incluyendo como tales agentes conductores, aglomerantes y colectores de corriente, se pueden usar aquellos que están comercialmente disponibles. Cuando la electrolisis se realiza en medio básico, el medio básico se puede generar con compuestos como hidróxidos de metal, carbonatos, fosfatos, hidrógeno fosfatos, , donde el metal puede ser cualquier elemento químico alcalino (por ejemplo, K2HPO4, KH2PO4, ) , alcalinotérreo, metales de transición, lantánidos, actínidos, metales del bloque p, o no metales. Según realizaciones particulares el medio básico es generado con KOH. Los electrolitos utilizados pueden ser derivados de urea según la fórmula I indicada, tales como, tiourea, polímeros de tiourea o mezclas de cualquiera de ellos, guanidina, polímeros de guanidina. Cualquiera de ellos o sus mezclas se puede utilizar para cualquier alternativa de la invención. Dichos electrolitos podrán encontrarse disueltos, en estado líquido o sólido. Dichos electrolitos podrán actuar en la producción de hidrógeno y nitrógeno directamente o como catalizadores. Por ejemplo, la tiourea puede ser el electrolito de donde se obtiene el hidrógeno y el nitrógeno, pero también puede mezclarse en pequeñas proporciones con otro derivado de urea para facilitar la eletrooxidación del mismo, actuando en ese caso como un catalizador. Se podrán utilizar como catalizadores de la reacción cualquier cromóforo, y de forma más específica, derivados de rutenio y de iridio. De manera preferente, la celda electrolítica comprende un cátodo de platino y un ánodo de un compuesto de níquel, y de forma más preferente, el compuesto de níquel está depositado sobre titanio poroso. Según realizaciones particulares la celda electrolítica para realizar electrolisis de un derivado de urea en medio básico, comprende: - un cátodo de hidróxido de níquel depositado sobre titanio poroso, - un ánodo unido al cátodo de Pt, mediante un agente conductor, - una disolución de KOH acuoso como base. Según realizaciones particulares adicionales la celda contiene electrodos de los siguientes materiales: • Cátodo: Lámina de Platino. • Ánodo: material que comprende una mezcla Ni (OH) 2/Pt/material fotovoltaico o NiOOH/Pt/material fotovoltaico en cualquier proporción entre Ni y Pt. Según realizaciones particulares adicionales, la celda contiene electrodos de los siguientes materiales: • Cátodo: Lámina de Platino • Ánodo: material que comprende por una mezcla Ni (OH) 2/Pt/material fotovoltáico/alotropo de C en todas sus formas o NiOOH/Pt/ material fotovoltáico/alótropo de C en todas sus formas y en cualquier proporción entre Ni y Pt. La celda puede tener electrodos separados en dos compartimentos. También puede ser una celda de tres o más electrodos. Según una realización particular, durante la aplicación de corriente a la celda electroquímica, el derivado de urea, preferentemente tiourea o guanidina, contenido en una disolución de hidróxido potásico (KOH) se oxida en el ánodo, que consiste en un electrodo poroso de hidróxido de níquel (positivo) , y al mismo tiempo, en el mismo electrodo tiene lugar la reacción de oxidación de Ni (OH) 2 a NiOOH que sirve de catalizador de la descomposición del derivado de urea. El electrodo negativo, consistente en una malla de platino es donde ocurre la reacción de reducción alcalina de agua con producción de hidrógeno. La presente invención demuestra que la guanidina y la tiourea representan una alternativa a la urea por sus similares prestaciones de eliminación de contaminantes nitrogenados y mejores valores de consumo de energía. Por lo tanto, representan una ventaja sobre el estado de la técnica conocido. Se ha conseguido gracias a la presente invención mejorar los cátodos a fin de evitar interferencias debidas a la presencia de compuestos nitrogenados que pueden provocan reacciones secundarias. Una ventaja de usar como compuesto nitrogenado tiourea o guanidina, es que comprenden 4 o 5 átomos de hidrógeno respectivamente y sumadas a las moléculas de agua que contienen 2 átomos de hidrógeno el proceso de electrolisis se obtiene con mayor eficiencia, con menor utilización de energía y mayor generación de hidrógeno que la electrolisis del agua (usada en otras celdas de combustible) que contiene solo 2 átomos de hidrógeno. Los compuestos nitrogenados como tiourea o guanidina se oxidan en el ánodo, mientras que la reducción (por ejemplo, alcalina) del agua se produce en el cátodo. Reacción para la tiourea en el caso particular de electrolisis alcalina: (1) Ánodo: CS (NHz) z (aq) + 6OH- N2 (g ) + 5H20 + CO (aq) +S (aq) + 6e - (2) Cátodo: 6H20 + 6e - 3 H 2 (g) + 60H- (3) Reacción global: CS (NH2) 2 (aq) + H2O N2 (g) + 3H2 + CO (aq) +S (aq) Reacción global para la guanidina. Reacción global: CNH (NH2) 2 (aq) + H2O 1, N2 (g) + 3+ H2 + CO (aq) BREVE DESCRIPCIÓN DE LAS FIGURAS La figura 1 muestra una representación esquemática de un electrolizador para descomponer derivados nitrogenados. Donde N-BCs significa "derivados nitrogenados" La figura 2 muestra una curva de potencial - tiempo y a la derecha una curva de corriente frente a potencial. Figura 3. Electrodos de Ni (OH) 2 conformados mediante colaje en cinta. En base a estos resultados se prepararon electrodos mediante colaje en cinta para las pruebas de caracterización electroquímica. La Figura 4. Electrodos de Ni (OH) 2 conformados mediante pistola de aerografía. Muestra el aspecto de los electrodos, después de la aplicación de la tinta y de las pruebas de adherencia. Figura 5a. Voltametrías cíclicas de las disoluciones de KOH 5 M en distintas condiciones y utilizando hidróxido de Ni como ánodo: a) sin ureavelocidad de barrido 10 mV/s (curva 1) y 20 mV/s (curva 2) , T= 25°C en ambas curvas. Figura 5b. Voltametrías cíclicas de las disoluciones de KOH 5 M en distintas condiciones y utilizando hidróxido de Ni como ánodo: b) con urea (0, 33M) ; velocidad de barrido 10 mV/s (curva 1) y 20 mV/s (curva 2) , T= 25°C en ambas curvas. Figura 6a. Ciclovoltametrías (25° C) (10mV/s) con diferentes electrolitos: a) KOH 5 M -blanco b) urea Figura 6b. Ciclovoltametrías (25° C) (10mV/s) con diferentes electrolitos: c) nitrato de guanidina d) tiourea. Figura 6c. superposición de los voltagramas de todos los solutos individualmente ensayados y mostrados en las figuras 5a y 5b. Figura 7a a 7 d. Ciclovoltametrías (10mV/s) con diferentes electrolitos ensayados a diferentes temperaturas (25°C, 40°C, 60°C y 80°C) : a) urea; b) tiourea; c) guanidina. Figura 8. Ensayo de polarización con hidróxido potásico 5M, y con urea 0.33M en KOH 5M. Figura 9. Cronopotenciometrías realizadas en celda completa. Disoluciones 0, 33 M de cada compuesto en KOH 5 M, a 10 mA y 25 °C. Figura 10. Cronopotenciometrías realizadas en celda completa a 2 Ma y a 25°C. El análisis energético se realizó cuando el sistema era estable, en concreto se hicieron medidas de producción de hidrógeno y de consumos entre los minutos 100 y 150 de operación. (1: KOH 5M, 2: urea 0, 33M en KOH 5M, 3: tiourea 0, 33 M en KOH 5 M, y 4: nitrato de guanidina 0, 33 M en KOH 5M) . EJEMPLOS Se realizaron pruebas de los materiales de ánodo más adecuados para la electrooxidación en celda electroquímica con configuración de tres electrodos, y una segunda parte de ensayos de producción de hidrógeno en celda completa con los electrodos seleccionados y con diferentes disoluciones de urea - para comparación - y derivados. Se investigaron características de formulados de electrodos de níquel (NiOOH) con diferentes modos de preparación, y se investigó el comportamiento electroquímico de los mismos en semicelda y en condiciones operativas de electrolisis en una celda completa. La preparación de los formulados de hidróxido de níquel se hizo mediante 2 procedimientos fundamentalmente; colaje en tinta y aplicación de tinta con pistola de aerografía, seleccionando este último método como el más adecuado. Adicionalmente, se llevaron a cabo pruebas de estabilidad térmica y eléctrica de las disoluciones con guanidina y tiourea en las que simulan las condiciones operativas del proceso de electrolisis. Los formulados son soluciones/suspensiones con el material activo (hidróxido de Ni, por ejemplo) mezclado con disolvente acuoso, agente conductor y aglomerante que le den a la mezcla unas condiciones reológicas que permitan su manejo y posterior dispersión sobre un soporte metálico, de modo que permitan su aplicación sobre el ánodo. Se estudiaron las prestaciones electroquímicas de los ánodos de NiOOH, primero en celda electroquímica de tres electrodos y posteriormente en una celda completa que emula un electrolizador, con análisis de producciones de hidrógeno, eliminación de contaminantes y consumos. Preparación de Ánodos Se prepararon ejemplos de formulados de hidróxido de níquel siguiendo diferentes metodologías para obtener electrodos con el material disperso y estabilizado homogéneamente sobre un soporte metálico de titanio poroso. Colaje en cinta La preparación del formulado de hidróxido de níquel mediante el colaje en cinta se fundamenta en la preparación de una suspensión del material activo de interés, es decir, hidróxido de níquel en un medio compuesto por disolvente, por ejemplo (N-metil-2-pirrolidina (NMP) , agente conductor, tal como negro de humo o negro de acetileno, y aglomerante, tal como fluoruro de polivinilideno, PVDF que se cuela sobre una superficie plana deslizante que actúa de soporte, como por ejemplo titanio poroso, por la que se pasa una cuchilla que nivela la suspensión, dando lugar a una película de anchura y espesor controlados, por ejemplo 2-3 cm de anchura y 50-100 ^m de espesor. Posteriormente, cuando se evapora el disolvente, las partículas se consolidan para dar ugar a una pieza que adaptada mecánicamente puede ser usada como electrodo. Para aplicar el proceso de colaje de cinta a la preparación de electrodos se usó un equipo COATMASTER Mod 510, Erichsen, Alemania. Las muestras (aquellos electrodos con consistencia adecuada y cargas másicas en torno a 10-15 mgNi (OH) 2/cm2 que son las óptimas para la aplicación deseada (composición: 7:1:2 de hidróxido de níquel, negro de humo y PVDF) ) del formulado de hidróxido de níquel mediante el colaje en cinta se prepararon en forma de tinta del siguiente modo Una vez pesados todos los componentes, se echan en un vaso de precipitados de 250 mL y se va añadiendo poco a poco el disolvente N-Metil-2-pirrolidina (NMP) mientras se va realizando la agitación vigorosa de la mezcla usando una varilla de vidrio. El objetivo final es obtener una pulpa adecuada. Se estudiaron diferentes composiciones esencialmente modificando el contenido (8:1:1, 6:2:2, 7:2:1 y 7:1:2, de hidróxido de níquel, negro de humo y PVDF) de aglomerante. Las tintas que mejor resultado dieron se prepararon dispersando en un homogeneizadordispersor una mezcla que contiene 1.6 g de hidróxido de níquel, 0.2 g de negro de humo y 0.5 g de PVDF en 10 mL de N-Metil-2-pirrolidina (NMP) , todos ellos reactivos suministrados por Alfa Aesar. Posteriormente se dejaron secar a 110°C a vacío, de forma que se evaporó el disolvente y quedó el material puro consistente en hidróxido de níquel y negro de humo. Los electrodos obtenidos por este procedimiento mostraron consistencia y cargas másicas en torno a 10-15 mgNi (OH) 2/cm2 que son adecuadas para la aplicación deseada. En la figura 3 se muestra el aspecto de los electrodos. Ensayos de estabilidad térm ica de los e lectro litos Para estudiar la estabilidad de las disoluciones con contaminantes nitrogenados se diseñaron ensayos térmicos en los que se sometieron las diferentes muestras; disolución 0.33 M de tiourea en hidróxido potásico 5M, disolución 0.33 M de nitrato de guanidina en hidróxido potásico 5M, y disolución 0.33 M de urea en hidróxido potásico 5M, a varias temperaturas en presencia y en ausencia de electrodos de Ni (OH) 2 preparados por colaje en cinta. Se usaron vasos de vidrio y baños termostatados. Las muestras se sometieron a diferentes temperaturas 40, 60 y 80° C durante varios periodos de tiempo (1, 5 y 10 horas) , y se efectuaron inspecciones visuales del electrolito. Se evaluaron las características de estabilidad térmica de los derivados de nitrógeno mencionados con dos enfoques; estabilidad de las disoluciones de componentes con 0.33 M de concentración en vasos termostatados, y estabilidad con la misma configuración añadiendo dos electrodos conectados entre sí y sin aplicación de corriente. El calentamiento se realizó por etapas (40-60-80°C) , una vez alcanzada la temperatura se mantuvo durante un tiempo determinado observando posibles cambios en la coloración de la disolución o en la aparición de precipitados. La Tabla 1 recoge el esquema del ensayo realizado y los resultados sin electrodos y con electrodos sumergidos y conectados entre sí después de 5 horas a 80°C. Tabla 1. Etapas del ensayo de estabilidad térmica y observaciones registradas para cada disolución. Los resultados indican que el aumento de temperatura por sí solo no produce cambios significativos en la disolución (salvo en el caso de la tiourea, donde la coloración se intensifica a 80° C) . Sin embargo, cuando se introducen electrodos y se cortocircuitan se observa la aparición de sólidos en suspensión, siendo esta presencia más claramente observada en la disolución de tiourea. También, en la disolución de guanidina se observan ciertas partículas en suspensión. Caracterización de las reacciones de los electrolitos en semicelda Para estudiar los procesos electroquímicos de los diferentes ánodos preparados se realizaron experimentos de voltametría cíclica. El procedimiento consiste en aplicar un sobrepotencial al electrodo de estudio, también llamado de trabajo (WE) , frente a un electrodo de referencia (RE) desde un voltaje inicial hasta un potencial límite, lo que se conoce como ventana de potencial que debe cubrir las zonas en las que ocurren las reacciones de interés, para posteriormente realizar el barrido inverso mientras se registra la señal de intensidad que se experimenta en el electrodo de trabajo en lo que sería equivalente a electrones liberados (reacciones de oxidación) y que tienen que ser consumidos en un electrodo de auxiliar llamado contraelectrodo (CE) en el que tiene lugar una reacción de reducción, todo ello a una velocidad de barrido definida. Este procedimiento genera una curva triangular de potencial-tiempo y otra que corresponde con la intensidad de corriente medida como respuesta a la aplicación del sobrepotencial, tal como se puede observar en las imágenes izquierda y derecha de la Figura 2, respectivamente. Respecto a la interpretación de esta última, al aplicar una diferencia de voltaje al electrodo de trabajo se promueve que el potencial supere al potencial termodinámico de las posibles reacciones redox que pueden tener lugar en la interfase disolución-electrodo en función de especies contenidas en la misma. Esencialmente se promueven dichas reacciones bajando su energía de activación. Esto se observa claramente en la curva intensidad-voltaje de la Figura 2 llamada Voltametría Cíclica, hacia potenciales negativos (a la izquierda) , región en la que la intensidad de corriente medida como respuesta a la aplicación de voltaje modifica de tal manera las energías de activación de las reacciones redox que hace que, cuando se llega a ese tramo de la curva la corriente sea creciente en magnitud con valores negativos indicativos de que están teniendo lugar reacciones de reducción en el electrodo de trabajo. Este fenómeno se intensifica a medida que se desplaza el potencial a valores todavía más negativos porque la energía de activación de la reacción se hace cada vez menor y se produce por tanto un aumento de la velocidad de la reacción, provocando un aumento súbito de la corriente que da forma al inicio de un pico apuntando hacia corrientes negativas. Sin embargo, en ese punto como consecuencia de la alta velocidad, la especie oxidada, que es el reactivo que protagoniza la reacción de reducción, comienza a escasear en las inmediaciones de la interfase disolución-electrodo. Cuando la velocidad es moderada hay especies disponibles en la superficie del electrodo que van reponiendo a las que habían reaccionado, pero cuando la velocidad es elevada, no es posible acceder a las especies reaccionantes a la misma velocidad que éstas desaparecen, por lo que, una ez alcanzado el máximo, la corriente decrece de forma súbita dando la forma de pico que se ve en la Figura 2. Posteriormente cuando el barrido de potencial se acerca a la misma región, pero en el barrido de voltaje a valores positivos, se observa el mismo comportamiento con el reactivo en forma reducida que procede a oxidarse y aparece una señal de corriente, esta vez de valores positivos, con forma de onda. La combinación del pico de oxidación y el de reducción se conoce como picos de reacción redox y se puede asociar a las reacciones redox de interés. Atendiendo a la forma de estos picos se pueden interpretar los fenómenos redox que ocurren en el sistema, específicamente porque presentan una densidad de corriente y una separación entre los picos de oxidación y de reducción cuya magnitud es indicativa de la reversibilidad electroquímica y de la cinética de las reacciones de estas especies. En la caracterización de ánodos, se utilizaron celdas comerciales de vidrio en configuración de tres electrodos. El electrodo de trabajo consistía en una lámina de titanio poroso (grado 2 >99% Titanium Metals UK Limited (TML) ) con un área efectiva de entre 2 y 5 cm2, controlada mediante un recubrimiento de teflón y adhesivo termofusible en la superficie lateral y posterior del electrodo. Como electrodo de referencia se utilizó Hg/HgO (1M NaOH) y como contraelectrodo, una malla de platino de área considerablemente superior a la del electrodo de trabajo (12.5 cm2) . La distancia entre el electrodo de trabajo y el de referencia era de unos 2 cm aproximadamente, por lo que se asumió cierta imprecisión en las medidas debido al efecto de las pérdidas Óhmicas. Para llevar a cabo los experimentos a diferentes temperaturas se usaron baños termostáticos que permitieron operar en un intervalo de entre 25 y 80°C. Resultados Se prepararon electrodos mediante colaje en cinta para las pruebas de caracterización electroquímica. Para estudiar las prestaciones electroquímicas de los electrodos, se llevaron a cabo ensayos de voltametrías cíclicas en celdas de tres electrodos: Las celdas se rellenaron con 75 mL de disolución de los electrolitos en agua (las concentraciones se muestran más abajo) , urea, tiourea y guanidina en cada caso y la temperatura se controló mediante la utilización de un baño termostático. Se realizaron experimentos a distintas temperaturas, obteniendo los mejores resultados a temperatura ambiente. Después se investigó la actividad catalítica de los materiales de hidróxido de níquel mediante voltametrías cíclicas entre 0.0 y 0.8 VHg/HgO en disoluciones de KOH 5 M en presencia y ausencia de urea, tiourea y nitrato de guanidina a una concentración de electrolito (tiourea, guanidina) de 0.33 M. Ensayos con urea a 25°C Se llevó a cabo un estudio de las propiedades electroquímicas de las disoluciones de urea en condiciones de temperatura ambiente a fin de validar el sistema experimental y disponer de valores de referencia con los que poder comparar. En la Figura 5 se muestran las voltametrías cíclicas de disoluciones en presencia y en ausencia de urea, en base KOH 5 M. En el sistema sin urea (Figura 5a) se pueden observar claramente los picos tanto de la oxidación de Ni (OH) 2 a NiOOH como su reducción en potenciales de 0.52 y 0.20 VHg/HgO siendo de mayor densidad de corriente y con mayor separación entre picos cuando la velocidad de barrido es más rápida. Estas reacciones son bien conocidas en medio alcalino y responden a la siguiente ecuación: Si el barrido se extiende a valores de potencial ligeramente más positivos en torno a 0.70 VHg/HgO, puede observarse el incremento en corriente asociado a la evolución de oxígeno debido a la descomposición del agua que, en medio alcalino, progresa según la siguiente ecuación: Si se está rompiendo la molécula de agua de la disolución, en el electrodo auxiliar (CE) deben estar ocurriendo las reacciones asociadas a la generación de hidrógeno (Ecuación 3) , y así quedó constatado con la visualización de burbujeo en la malla de platino usada como electrodo auxiliar durante los experimentos. Además, aunque no se muestra en el voltamograma, el voltaje en el electrodo auxiliar fue registrado y se observó estable en valores próximos a -1.15 VHg/HgO. Con estos valores de potencial, tanto de la evolución de oxígeno como de generación de hidrógeno es posible estimar que, en una celda de electrolisis con electrodos de platino e hidróxido de níquel en los electrodos negativo y positivo respectivamente, en una disolución de 5 M KOH en ausencia de urea, pueden esperarse tensiones de celda quivalentes a la diferencia entre las reacciones del electrodo positivo menos el negativo, es decir alrededor de 1.85 V. La reacción global se describe a continuación, con producción del doble de hidrógeno que de oxígeno: Cuando se utilizan disoluciones con urea (¡Error! No se encuentra el origen de la referencia.b) , no fue posible observar el pico de oxidación a NiOOH con claridad. La forma de las voltametrías indica una transición directa a la descomposición de urea sin la formación de NiOOH. Sin embargo, a la oxidación de Ni (OH) 2 a NiOOH se le atribuyen propiedades catalíticas para descomponer la urea, que es el proceso que se observa si el barrido se extiende a valores de potencial ligeramente más positivos en valores próximos a 0.55 VHg/HgO con burbujeo intensivo en el electrodo, que puede atribuirse a la formación de nitrógeno mientras se reduce el agua en el contra electrodo que produce hidrógeno, igual que en el proceso sin urea. Por lo tanto, durante el barrido anódico, la urea contenida en la disolución se oxida según la reacción que se detalla a continuación: Después, en el barrido catódico, puede observarse un bucle que suele asociarse a procesos de nucleación relacionados con la electrodeposición de alguna especie. Además, se observa la reducción de NiOOH a Ni (OH) 2. Igual que anteriormente, el voltaje en el electrodo auxiliar se registró y se observó la reducción del agua estable en valores próximos a -1.20 VHg/HgO, por tanto, con potenciales de descomposición de urea en torno a 0.50 VHg/HgO es posible estimar el voltaje de la siguiente reacción global en 1.70 V: Estos valores de voltaje son orientativos ya que indican esencialmente el potencial mínimo que habrá que comunicar para que la electrolisis tenga lugar, En la realidad la diferencia de potencial necesaria para la electrolisis puede ser mayor, debido a la aparición de sobretensiones, especialmente importantes cuando se desprenden gases o cuando se depositan sustancias sobre el electrodo. Ensayos con derivados de urea La reacción global con la urea es: Una vez que la instalación experimental y las condiciones de ensayo fueron validadas con disoluciones de urea se evaluó el comportamiento electroquímico de tiourea, y la guanidina. Ésta última fue preparada en forma de su sal de nitrato porque la sal pura era poco soluble. Aunque se evaluaron diferentes velocidades de barrido, en la figura 6se muestra la recopilación de voltametrías cíclicas de estas disoluciones a 10 mV/s. Se incluyen también como blanco las voltametrías de disoluciones en ausencia de compuestos nitrogenados, en base KOH 5 M. En todas las configuraciones con derivados de urea se observa el mismo comportamiento que en las muestras con la disolución problema de urea, el pico de reducción de NiOOH, ausencia del pico de oxidación probablemente superpuesto con las reacciones de descomposición de compuestos más allá de valores de 0.55 VHg/HgO zona en la que se observa un crecimiento de la curva probablemente por formación de nitrógeno siguiendo la reacción (5) descrita anteriormente. Para la tiourea y guanidina se observan diferencias con la urea, y es que sus potenciales de reducción de NiOOH son más positivos que los observados con urea, alrededor de 0.30 VHg/HgO, frente a la urea (0.25 VHg/HgO) . En términos prácticos esto implica que la polarización del electrodo para que las reacciones de reducción de NiOOH a Ni (OH) 2 tengan lugar requiere que el potencial se alcance a valores menos catódicos, lo cual genera procesos más eficientes energéticamente. Ensayos de los reactivos urea, tiourea, guanidina, a diferentes temperaturas Para estudiar la electrolisis de las disoluciones de urea y sus derivados, se llevaron a cabo voltametrías cíclicas en celda de tres electrodos (en la misma configuración que anteriormente) con una velocidad de barrido de 10 mV/s. En cada ensayo se utilizaron electrolitos y electrodos nuevos, de forma que el efecto de la posible degradación del material y/o del medio no condiciona los siguientes ensayos. Se ensayaron cuatro temperaturas: 25, 40, 60 y 80° C. En la figura 7 se muestran las voltametrías con disoluciones de urea, tiourea y la guanidina. Los resultados indican que, en términos generales las temperaturas más elevadas son más desfavorables para la evolución de las reacciones electroquímicas que las ondiciones de temperatura ambiente. Esto se deduce de la baja densidad de corriente obtenida al aumentar la temperatura, siendo especialmente remarcable a 80° C ya que en todos los electrolitos se reduce la densidad de corriente. Con la guanidina no se aprecian diferencias significativas entre 40 y 60° C, siendo la temperatura ambiente la que muestra mayor intensidad en el voltamograma. En el caso de la tiourea, se aprecia una inestabilidad con el aumento de la temperatura. Caracterización de los e lectro litos y del com portam iento de los e lectrodos en celda com pleta Se realizaron experimentos en una celda completa emulando un electrolizador. La celda, tiene ubicados electrodos en cada uno de los lados, una malla de platino en el compartimento catódico para la producción de hidrógeno y los electrodos preparados con hidróxido de níquel en el compartimento anódico, la celda se llenó con una disolución de urea, o tiourea o guanidina, a través del depósito de alimentación (con las mismas concentraciones que se indicaron en la voltametría) . También se comparó con la electrolisis del agua. El procedimiento consistió en aplicar corriente al sistema formado por los dos electrodos con un potenciostato registrando la evolución del voltaje. Los gases generados en cada compartimento fueron cuantificados en volumen y acumulados para, en momentos puntuales, realizar análisis por cromatografía de gases con diferentes detectores: de conductividad térmica (TCD) y de masas (MS) . Además, se registró la carga aplicada al sistema para correlacionarla con el volumen de hidrógeno generado y calcular así la eficiencia del sistema para la producción de hidrógeno: siendo P la presión del sistema, V el volumen de gas generado, R la constante de los gases, T la temperatura del sistema, Q la carga eléctrica aplicada, N el número de equivalentes y F la constante de Faraday. Con este procedimiento, en el cátodo se producirá hidrógeno y en el ánodo los gases correspondientes dependiendo de la disolución, con KOH se producirá oxígeno y con la urea, la tiourea o la guanidina la ruta principal debe conducir principalmente a formar itrógeno por lo que se propone la siguiente ecuación para estimar la degradación del contaminante. donde Prodgas es el caudal de gas anódico (se estima como nitrógeno puro en el caso de los derivados nitrogenados) en mL/h; meq son el número de moles producidos por la descomposición del derivado nitrogenado; masamat.act. es la cantidad en gramos de material activo presente en el electrodo. Para la aplicación de este estudio se utilizaron electrodos con la misma composición que anteriormente (Nil) H/NiOOH en el ánodo y platino en el cátodo) esta vez con un área efectiva de 5 cm2, controlada mediante un recubrimiento de teflón y adhesivo termofusible en las aristas y el reverso del electrodo. Como cátodo se utilizó una malla de platino de área considerablemente superior a la del electrodo de trabajo (12.5 cm2) . La distancia entre electrodos era de unos 10 cm aproximadamente, por lo que se asumió cierta imprecisión en las medidas debido al efecto de las pérdidas Óhmicas. Para llevar a cabo el estudio en celda completa de las distintas disoluciones de urea, tiourea y guanidina, se utilizó la celda descrita en la sección "caracterización de los electrolitos y del comportamiento de los electrodos en celda completa" con capacidad para 90 mL de disolución. Con ella, se realizaron primero ensayos a corriente constante a una intensidad de corriente, de 2 mA y temperatura ambiente (20-25°C) , y registrando tanto el voltaje de la celda y la carga eléctrica aplicada, como la producción de gases, y posteriormente se llevaron cabo ensayos a en los que se hizo un seguimiento del volumen de producción de hidrógeno para correlacionarlo con la carga eléctrica aplicada. A esta intensidad de corriente la tiourea y la guanidina dan mejores resultados que la urea. Ensayos de polarización Inicialmente, con el objetivo de determinar los sobrevoltajes de las reacciones en unas condiciones de referencia, se realizaron ensayos de polarización sobre disoluciones de KOH 5 M en presencia y en ausencia de disolución de urea que es la base nitrogenada usada de referencia, en los que tras aplicar una determinada corriente durante un corto período de tiempo se registra el voltaje alcanzado. Los resultados se muestran en la Figura 8 y permiten relacionar linealmente el voltaje de la celda con la corriente aplicada, y decidir las intensidades de corriente que se pueden aplicar en la celda completa dispuesta para emular un electrolizador. Los valores de potencial medidos en estos experimentos son elevados comparado con el potencial estándar de electrolisis. Eso es debido a que las semirreacciones que tienen lugar en una celda de electrolisis no son espontáneas y por tanto hay que comunicar, como mínimo, una diferencia de potencial mayor al potencial estándar de la celda para llevarla a cabo. Sin embargo, cuando se realiza electrolisis de sustancias en disolución acuosa resulta difícil de prever el voltaje operativo, ya que pueden existir reacciones en competencia a las principales en ambos electrodos. El que suceda una u otra dependerá de varios factores, como la concentración de la sustancia disuelta, o las características físicas de los electrodos, pero en general la diferencia de potencial necesaria para la electrolisis puede ser bastante mayor que el potencial estándar, debido a la aparición de sobretensiones, especialmente importantes cuando se desprenden gases o cuando se depositan sustancias sobre el electrodo. Como consecuencia, se puede establecer que los potenciales de celda obtenidos en estos experimentos son adecuados para disoluciones con tiourea y guanidina. A la vista de estos resultados, se seleccionó una corriente de 2 mA, para la realización de los ensayos en celda completa. Ensayos en celda com pleta En los experimentos se usaron disoluciones de 90 mL de electrolito aplicando 2 mA de intensidad de corriente. Como ánodo se utilizaron electrodos de 5 cm2 con cargas másicas de material activo [Ni (OH) 2] de 3.5-4.5 mgMNcm2. Se utilizaron electrodos nuevos en cada ensayo. El tiempo de duración del ensayo vino determinado por la producción del volumen mínimo de gas anódico medible en la celda, siendo al menos una hora. En la Figura 10 se muestra la evolución del voltaje con los 3 compuestos estudiados, todos ellos a una concentración de 0, 33 M (0, 33 M en KOH 5M cada uno de ellos) y su comparativa con KOH 5 M que equivaldría a un electrolizador alcalino. El resultado es que el sistema con electrolito de hidróxido potásico conduce al voltaje más alto, mientras que la guanidina y la tiourea, que favorecerían reacciones de oxidación a potenciales menos positivos que la evolución de oxígeno, operan a menos tensión. Esto resulta consistente con los resultados del estudio electroquímico realizado a nivel de celda de tres electrodos En la Figura 10 se muestran las curvas potencial vs. tiempo y en la Tabla 4 se recopilan los valores de voltaje promedio durante el experimento, la producción de hidrógeno en el cátodo, los consumos y la eficiencia, para las 4 disoluciones estudiadas. Se ha simplificado el ensayo atendiendo solamente a la producción de hidrógeno, a la carga aplicada y a la energía consumida. Tabla 1. Cálculos de eficiencias y producciones para los ensayos en celda completa en condiciones a 2 mA. El análisis energético se realizó cuando el sistema era estable, en concreto se hicieron medidas de producción de hidrógeno y de consumos entre los minutos 100 y 150 de operación. Por esta razón, para el análisis comparativo de consumos se tomaron 50 minutos pasado ese momento inicial de estabilización para cada experimento. Los resultados indican que, cuando se compara la ausencia de derivados nitrogenados con su presencia, la producción de hidrógeno transcurre a voltajes significativamente inferiores cuando la disolución contiene derivados nitrogenados, en torno a 1.42-1.45 V, mientras que con KOH 5 M se obtienen valores de 1.63 V. En estas condiciones, produciendo aproximadamente la misma cantidad de hidrógeno, se obtienen diferencias en el consumo energético por kilogramo de hidrógeno producido que muestran que la electrolisis utilizando disoluciones con derivados de nitrógeno y particularmente basados en guanidina y tiourea transcurre con un importante menor consumo energético.
Publicaciones:
ES2957422 (18/01/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 06/06/2022 se realizó Registro Instancia de Solicitud
En fecha 07/06/2022 se realizó Admisión a Trámite
En fecha 07/06/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 15/06/2022 se realizó Superado examen de oficio
En fecha 14/03/2023 se realizó Realizado IET
En fecha 17/03/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 18/01/2024 se realizó Publicación Solicitud
En fecha 18/01/2024 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 28/03/2024 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
Pagos:
06/06/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 27/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493
El registro de patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493 fue solicitada el 06/06/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493 fue solicitada por HYDROGEN & INNOVATION, S.L. mediante los servicios del agente Sénida Remedios Cueto Priede. El registro [modality] por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493 está clasificado como C25B 1/04,C01B 3/02,C02F 1/461 según la clasificación internacional de patentes.
Otras invenciones solicitadas por HYDROGEN & INNOVATION, S.L.
Es posible conocer todas las invenciones solicitadas por HYDROGEN & INNOVATION, S.L. entre las que se encuentra el registro de patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Si se desean conocer más invenciones solicitadas por HYDROGEN & INNOVATION, S.L. clicar aquí.Otras invenciones solicitadas en la clasificación internacional de patentes C25B 1/04,C01B 3/02,C02F 1/461.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493 está clasificado con la clasificación C25B 1/04,C01B 3/02,C02F 1/461 por lo que si se desea conocer más registros con la clasificación C25B 1/04,C01B 3/02,C02F 1/461 clicar aquí.Otras invenciones solicitadas a través del representante SÉNIDA REMEDIOS CUETO PRIEDE
Es posible conocer todas las invenciones solicitadas a través del agente SÉNIDA REMEDIOS CUETO PRIEDE entre las que se encuentra el registro patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Si se desean conocer más invenciones solicitadas a través del agente SÉNIDA REMEDIOS CUETO PRIEDE clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C25
Es posible conocer todas las patentes registradas en la clase C25 (PROCESOS ELECTROLITICOS O ELECTROFORETICOS; SUS APARATOS) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C25B
Es posible conocer todas las patentes registradas en la clase C25B (PROCESOS ELECTROLITICOS O ELECTROFORETICOS PARA LA PRODUCCION DE COMPUESTOS ORGANICOS O INORGANICOS,) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C01
Es posible conocer todas las patentes registradas en la clase C01 (QUIMICA INORGANICA) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C01B
Es posible conocer todas las patentes registradas en la clase C01B (ELEMENTOS NO METALICOS; SUS COMPUESTOS) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C02
Es posible conocer todas las patentes registradas en la clase C02 (TRATAMIENTO DEL AGUA, AGUA RESIDUAL, DE ALCANTARILLA O FANGOS) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C02F
Es posible conocer todas las patentes registradas en la clase C02F (TRATAMIENTO DEL AGUA, AGUA RESIDUAL, DE ALCANTARILLA O FANGOS) entre las que se encuentra la patente PROCEDIMIENTO DE ELIMINACIÓN DE COMPUESTOS NITROGENADOS con el número P202230493. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.


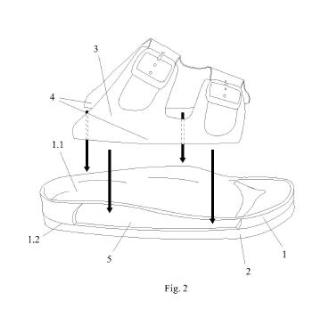
 P202230489
P202230489