- Home /
- Publicaciones de patentes /
- DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO
Patente nacional por "DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO"
Este registro ha sido solicitado por
Persona física
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 22/07/2022
- Número solicitud:
-
P202230679
- Número publicación:
-
ES2959128
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
- Clasificación Internacional de Patentes:
- A61B 5/1482,A61B 5/1486
- Clasificación Internacional de Patentes de la publicación:
- A61B 5/1482,A61B 5/1486
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2959128_A11. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, caracterizado por que su funcionamiento se basa en la determinación continua y en tiempo real de los niveles intersticiales de lactato y del pH. 2. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 1, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción del fluido corporal intersticial, que comprende: - un biosensor de lactato, - un sensor de pH, - circuitos y componentes electrónicos para realizar la adquisición, adecuación y transmisión de las señales de los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos. 3. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 2, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción del fluido corporal intersticial, que comprende: - un biosensor de lactato, que consiste en un mediador redox (Azul de Prusia) sobre un sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion, - un sensor de pH, que consiste en un electrodo de carbono electrodepositado con polianilina, - circuitos y componentes electrónicos para realizar la adquisición, adecuación y transmisión de las señales de los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos. 4. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 3, que consiste en un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, y que comprende un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de H, y que además incorpora la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenan temporal o permanentemente y desde el cual el facultativo puede visualizarlos. 5. Biosensor electroquímico amperométrico de lactato optimizado para su uso en dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, que consiste en un mediador redox (Azul de Prusia) sobre un sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion. 6. Procedimiento de fabricación del biosensor de lactato, según reivindicación 5, caracterizado por que partiendo de un transductor de C (previamente polarizado en una disolución tampón de fosfato de concentración en el intervalo 0, 01-0, 1 M, a un pH comprendido entre 7 y 7.6 y a un potencial entre 1.6-1.8 V, durante un tiempo de polarización próximo a 200 s) , que actúa como electrodo de trabajo, se realizan las siguientes etapas: a) Deposición de dos gotas de un volumen comprendido entre 10-20 microlitros de FeCl3 (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) a /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja aproximadamente 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con HCl (0, 01M) y se introduce en una estufa a una temperatura comprendida entre 90 y 120°C durante aproximadamente una hora. b) Deposición de una gota de 15-25 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (6-10 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 20-40 microlitros de quitosano 1% (m/V) en ácido acético (0, 1M) (pH en torno a 4.25-4.75) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. d) Deposición de una gota de 4-5 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso de una a tres veces más para obtener capas poliméricas adicionales. e) Deposición de una gota de 10-13 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7-8) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. 7. Procedimiento de fabricación del biosensor de lactato, según reivindicación 5, caracterizado por que partiendo de un transductor de C (previamente polarizado en una disolución tampón de fosfato 0, 1 M en pH 7.4 a un potencial 1.7 V durante 180 s) , que actúa como electrodo de trabajo, se realizan las siguientes etapas: a) Deposición de dos gotas de 12 microlitros de FeCh (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) 6 /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con 40 microlitros de HCl (0, 01M) y se introduce en una estufa a 100°C durante una hora. b) Deposición de una gota de 20 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (7, 7 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 30 microlitros de quitosano 1% (m/V) en ácido acético (0, 1M) (pH alrededor de 4.5) . Esta gota se seca mediante un rotor giratorio a 1000 rpm. d) Deposición de una gota de 4, 2 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso dos veces más para obtener una capa polimérica adicional. e) Deposición de una gota de 11, 5 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7) . Esta gota se seca mediante un rotor giratorio a 1000 rpm. 8. Dispositivo, según reivindicaciones 1 a 4, para su uso como generador de alertas en un receptor inalámbrico externo en situaciones compatibles con acidosis láctica. 9. Dispositivo, según reivindicaciones 1 a 4, para su uso en cualquier situación clínica que precise la monitorización continua del pH y lactato. 10. Dispositivo, según reivindicaciones 1 a 4, para su uso sobre recién nacidos en UCI neonatales para el diagnóstico de sepsis neonatales. 11. Dispositivo, según reivindicaciones 1 a 4, para su uso realización de un seguimiento estrecho de los niveles de pH y lactato en sujetos adultos con cetoacidosis diabética o sepsis. 12. Dispositivo, según reivindicaciones 1 a 4, para su uso en el ámbito de la medicina del deporte para la monitorización en tiempo real de los niveles de lactato y pH en entrenamientos deportivos.
Los productos y servicios protegidos por este registro son:
A61B 5/1482 - A61B 5/1486
Descripciones:
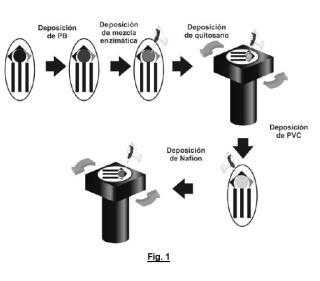
+ ES-2959128_A1 DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO SECTOR DE LA TÉCNICA La presente invención describe un dispositivo que permite realizar una adecuada monitorización en remoto del bienestar fetal intraparto, basado en la determinación continua y en tiempo real de los niveles de lactato intersticial y del pH. Más específicamente, la presente invención consiste en un dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, que incorpora un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de pH, y que cuenta con la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenarán temporal o permanentemente y desde el cual el facultativo podrá visualizarlos. Un segundo aspecto de la invención consiste en el diseño y procedimiento de fabricación de un biosensor electroquímico amperométrico de lactato microinvasivo, cuya configuración ha sido optimizada para su empleo en el dispositivo de monitorización objeto de la invención. Más específicamente este biosensor de lactato presenta una configuración de mediador redox Azul de Prusia encima del sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion. ANTECEDENTES DE LA INVENCIÓN El lactato, la forma ionizada del ácido láctico, es el producto final del metabolismo anaeróbico de la glucosa en los músculos. En algas, microoganismos y plantas predomina el enantiómero D-lactato, mientras que en mamíferos es más frecuente encontrarlo como enantiómero L-lactato. Los biosensores basados en la medición de este metabolito han experimentado un gran avance, sobre todo en el campo de la medicina deportiva, para la monitorización de la homeostasis del deportista y la evaluación de su nivel de resistencia. En reposo, la concentración de L-lactato en sangre oscila entre 0, 5 y 2, 0 mM [Chan D, Barsan MM, Korpan Y, Brett CMA. L-lactate selective impedimetric bienzymatic biosensor based on lactate dehydrogenase and pyruvate oxidase. Electrochim Acta. 2017;231:209-15. http://dx.doi.org/10.1016/j.electacta.2017.02.050] y entre 8-10 mM durante el ejercicio, pudiendo aumentar durante un ejercicio físico extenuante desde 15 a 25 mM [Goodwin, M. L., Harris, J. E., Hernández, A., & Gladden, L. B. (2007) . Blood Lactate Measurements and Analysis during Exercise: A Guide for Clinicians. Journal of Diabetes Science and Technology, 1 (4) , 558-569. https://doi.org/10.1177/193229680700100414]. A medida que aumenta la concentración de lactato, disminuye el pH celular, debido a la acumulación de protones dentro de la célula, lo que podría conducir a la aparición de acidosis en sangre si los niveles sobrepasan los 25 mM. Cuando se alcanza este nivel de lactato, conocido como umbral de lactato, se pueden producir dolencias de diferente índole, desde ligera fatiga hasta dolor muscular agudo, por lo que es recomendable que el atleta pare la actividad física. Además del ejercicio físico, cualquier condición fisiológica que active las rutas metabólicas anaeróbicas y provoque un desequilibrio en los niveles de lactato, podría conducir a una acidosis láctica. Estados fisiológicos o trastornos tales como el shock hemorrágico, la insuficiencia respiratoria, la insuficiencia renal o la hipoxia en los tejidos, pueden aumentar la producción de este metabolito. Por ello, el aumento en la concentración de lactato se utiliza habitualmente como señal de alarma para la intervención del equipo médico en los pacientes hospitalizados [Seheult J, Fitzpatrick G, Boran G. Lactic acidosis: An update. Clin Chem Lab Med. 2017;55 (3) :322-33, https://doi.org: 10.1515/cclm-2016-0438]. De forma análoga a la actividad física del deportista, el feto se ve sometido a un esfuerzo extenuante durante el parto, por lo que monitorizar el bienestar fetal se vuelve una necesidad clave. Esta práctica tiene como objetivo la detección de hipoxia o acidosis en fetos, para evitar las secuelas asociadas a estos estados, como la encefalopatía hipóxico-isquémica, la parálisis cerebral e incluso la muerte. La acidosis respiratoria debido a la acumulación de dióxido de carbono (hipercapnia) es frecuente durante el metabolismo normal, por lo que, aunque la concentración de iones H+ aumenta, este tipo de acidosis transitoria no está asociada con resultados negativos. Sin embargo, cuando el feto recibe oxígeno de forma insuficiente durante el parto, no tiene la capacidad para mantener el metabolismo normal, lo que obliga a cambiar al metabolismo anaeróbico. Como resultado, se genera y acumula ácido láctico y, en consecuencia, disminuye el pH. En este tipo de acidosis, conocida como acidosis metabólica, la falta de oxígeno de forma prolongada puede conducir a la asfixia durante el parto, complicaciones neurológicas postnatales como la encefalopatía hipóxico-isquémica o discapacidades a largo plazo [Cummins, G., Kremer, J., Bernassau, A., Brown, A., Bridle, H., Schulze, H., Bachmann, T., Crichton, M., Denison, F., & Desmulliez, M. (2018) . Sensors for Fetal Hypoxia and Metabolic Acidosis: A Review. Sensors, 18 (8) , 2648. https://doi.org/10.3390/s18082648]. La hipoxia metabólica severa con acumulación de lactato se considera un buen indicador de mal resultado perinatal [Wiberg, N., & Kallén, K. (2017) . Fetal scalp blood lactate during second stage of labor: determination of reference values and impact of obstetrical interventions. Journal of Maternal-Fetal and Neonatal Medicine, 30 (5) , 612 617. https://doi.org/10.1080/14767058.2016.1181167], con la consiguiente pérdida del bienestar fetal. El método clínico actual utilizado para el control del bienestar fetal se basa en el registro cardiotocográfico, en el que se registra de forma continua la frecuencia cardíaca fetal y la intensidad de las contracciones uterinas. Sin embargo, la especificidad de esta técnica para la detección del síndrome hipóxico-isquémico neonatal (falta de oxígeno) es tan baja que a veces conduce a realizar intervenciones urgentes (cesáreas) de forma innecesaria, con el riesgo que ello conlleva para la madre y el feto, además, del coste asociado a dicha práctica. Por este motivo, cuando en el registro cardiotocográfico se observan resultados inadecuados, antes de la toma de decisiones, la posible alteración de la homeostasis fetal debe ser constatada mediante una segunda prueba diagnóstica. Actualmente, dicha prueba consiste en la obtención de una muestra de sangre del cuero cabelludo fetal para la posterior determinación de los niveles de lactato en sangre y pH, ya que ambos son indicativos de acidosis metabólica. Cuando el lactato fetal supera los 5, 2 mmol/L está indicado finalizar el parto por la vía más rápida (habitualmente, la realización de una cesárea urgente por pérdida de bienestar fetal [Wiberg, N., & Kallén, K. (2017) . Fetal scalp blood lactate during second stage of labor: determination of reference values and impact of obstetrical interventions. Journal of Maternal-Fetal and Neonatal Medicine, 30 (5) , 612-617. https://doi.org/10.1080/14767058.2016.1181167; Rorbye, C., Perslev, A., & Nickelsen, C., (2016) . Lactate versus pH levels in fetal scalp blood during labor - using the Lactate Scout System. Journal of Maternal-Fetal and Neonatal Medicine, 29, 1200-1204. https://doi.org/10.3109/14767058.2015.1045863; Ramanah, R., Martin, A., Riethmuller, D., Maillet, R., & Schaal, J.P. (2005) . Value of fetal scalp lactate sampling during labour: a comparative study with scalp pH. Gynécologie Obstétrique & Fertilité, 33, 107-112. https://doi.org/10.10167j.gyobfe.2005.01.004; Birgisdottir, B.T., Holzmann, M., Varli, I.H., Graner, S., Saltvedt, S., & Nordstrom, L. (2017) . Reference values for Lactate Pro 2TM in fetal blood sampling during labor: a cross-sectional study. Journal of Perinatal Medicine, 45, 321-325. https://doi.org/10.1515/jm-2016-0027]) . La técnica para la obtención de este tipo de muestras de sangre (en modo puntual o discontinuo, no aconsejándose más de 2 tomas de sangre) es bastante cruenta, compleja y no exenta de complicaciones, tanto para la madre como para el feto, por lo que no se realiza en todos los hospitales. En este escenario la decisión final de efectuar una intervención urgente (cesárea) por riesgo de pérdida de bienestar fetal se basa exclusivamente en el registro cardiotocográfico, aun conociéndose su escasa fiabilidad. Los estudios realizados demuestran que, del total de cesáreas realizadas por resultados no satisfactorios en el registro cardiotocográfico, sólo el 36% de los recién nacidos presentaban secuelas. El 64% restante, correspondían a recién nacidos sanos, en los que la realización de una intervención urgente, junto con los riesgos que ello conlleva, podrían haberse evitado [Gluhovschi, A., luriciuc, M., Anastasiu, D., Cimpeanu, L., & Nyiredi, A. (2012) . A retrospective analysis over the emergency Cesarean section performed due to cardio-tocographic modifications. Timisoara Medical Journal, 62 (1-2) , 20-23]. Esto demuestra claramente que el registro cardiotocográfico como tal no pueda ser considerado como una prueba diagnóstica definitiva. En España, la magnitud del problema implica a unos 25.000 casos al año, considerando las 100.000 cesáreas realizadas en 2016 según el INE, de las que el 25% se realizaron por sospecha de pérdida de bienestar fetal intraparto. La gran diferencia entre el número de cesáreas realizadas por pérdida de bienestar fetal según el registro cardiotocográfico y el número real de casos que desarrollan encefalopatía hipóxico-isquémica neonatal pone de manifiesto la elevada proporción de falsos positivos de las técnicas actuales y, en consecuencia, la necesidad de desarrollar una alternativa diagnóstica que contribuya a disminuir el número de intervenciones urgentes que se realizan de forma innecesaria. De entre las opciones disponibles, se propone la medición de lactato mediante el uso de un biosensor electroquímico, que va asociado a una técnica simple, rápida, incruenta (pues no implica incisiones en el cuero cabelludo fetal) , fiable y microinvasiva que permite evaluar los niveles de lactato en tiempo real y de forma continua con la simple colocación del dispositivo sobre el cuero cabelludo del feto. El dispositivo propuesto combinaría un elemento de reconocimiento biológico, que de forma sensible y específica monitorizaría los niveles de lactato durante el parto, con un sistema de transducción electroquímico amperométrico, debido a la sensibilidad, simplicidad y rapidez de respuesta de este tipo de transductores, frente a otros biosensores de tipo óptico o térmico [Kucherenko IS, Topolnikova Y V., Soldatkin OO. Advances in the biosensors for lactate and pyruvate detection for medical applications: A review. TrAC - Trends Anal Chem. 2019;110:160-72. https://doi.org/10.1016yj.trac.2018.11.004]. Dicha monitorización se llevaría a cabo de forma remota (wireless) , en continuo (on line) y en tiempo real, por medio de un dispositivo móvil del tipo teléfono inteligente (smartphone) o tableta. La idea en la que se basa esta propuesta es que dicho biosensor proporcionará medidas en continuo y cambios de tendencia en los valores a tiempo real, aportando información mucho más significativa que las medidas puntuales en sangre, mejorando otablemente la estimación de lactato en comparación con los métodos discontinuos y cruentos utilizados actualmente en la práctica clínica. Aunque en la actualidad, existen biosensores tanto bienzimáticos, con dos enzimas [Pundir, C.S., Narwal, V., & Batra, B. (2016) . Determination of lactic acid with special emphasis on biosensing methods: A review. Biosensors and Bioelectronics, 86, 777 790. https://doi.org/10.10167j.bios.2016.07.076; Andersson, A., Chen, Q., Groop, L., Bülow, L., & Xie, B. (2017) . Continuous and simultaneous determination of venous blood metabolites. Talanta, 171, 270-274. https://doi.org/10.10167j.talanta.2017.05.010; Kotanen, C.N., Karunwi, O., Alam, F., Uyehara, C.F.T., & Guiseppi-Elie, A. (2018) . Fabrication and in vitro performance of a dual responsive lactate and glucose biosensor. Electrochimica Acta, 267, 71-79. https://doi.org/10.1016/j.electacta.2018.02.042; Tsuruoka, N., Ishii, K., Matsunaga, T., Nagatomi, R., & Haga, Y. (2016) . Lactate and glucose measurement in subepidermal tissue using minimally invasive microperfusion needle. Biomedical Microdevices, 18 (1) , 19. https://doi.org/10.1007/s10544-016-0049-z], como individuales [Cunha-Silva, H., & Arcos-Martínez, M.J. (2018) . Dual range lactate oxidase based screen printed amperometric biosensorfor analysis of lactate in diverisified samples. Talanta, 188, 779-787. https://doi.org/10.1016/j.talanta.2018.06.054; Lamas-Ardisana, P.J., Loaiza, O.A., Añorga, L., Jubete, E., Borghei, M., Ruiz, V., Ochoteco, E., Cabañero, G., & Grande, H.J. (2014) . Disposable amperometric biosensor based on lactate oxidase immobilised on platinum nanoparticle-decorated carbon nanofiber and poly (diallyldimethylammonium chloride) films. Biosensors and Bioelectronics, 56, 345 51. https://doi.org/10.1016/j.bios.2014.01.047; Andrus, L.P., Unruh, R., Wisnieweski, N.A., & McShane, M.J. (2015) . Characterization of lactate sensors based on lactate oxidase and palladium benzoporphyrin immobilized in hidrogels. Biosensors, 5, 398 416. https://doi.org/10.3390/bios5030398; Poscia, A., Messeria, D., Moscone, D., Ricci, F., & Valgimiglia, F. (2005) . A novel continuous subcutaneous lactate monitoring system. Biosensors and Bioelectronics, 20, 2244-2250. https://doi.org/10.1016/j.bios.2004.10.031], capaces, en algunos casos, de cuantificar lactato en tejido intersticial mediante técnicas microinvasivas [Rassaei, L., Olthuis, W., Tsujimura, S., Sudholter, E.J.R., & van den Berg, A. (2014) . Lactate biosensors: current status and outlook. Analytical and Bioanalytical Chemistr y , 406, 123-137. https://doi.org/10.1007/s00216-013-7307-1; Weltin, A., Kieninger, J., & Urban, G.A. (2016) . Microfabricated, amperometric, enzyme-based biosensors for in vivo pplications. Analytical and Bioanalytical Chemistr y , 408 (17) , 4503-4521. https://doi.org/10.1007/s00216-016-9420-4; Pundir, C.S., Narwal, V., & Batra, B. (2016) . Determination of lactic acid with special emphasis on biosensing methods: A review. Biosensors and Bioelectronics, 86, 777-790. https://doi.org/10.1016/j.bios.2016.07.076], no obstante, ninguno de ellos aplica el biosensor a la determinación del lactato en el tejido intersticial en fetos. Adicionalmente se propone el uso de un sensor de pH que registre de manera similar este parámetro de manera continua. Se ha demostrado que el conjunto de valores de lactato y pH permite un diagnóstico más conciso y fiable de diversas patologías y síndromes [Marsilea A. Booth, Sally A. N. Gowers, Melinda Hersey, Isabelle C. Samper, Seongjun Park, Polina Anikeeva, Parastoo Hashemi, Molly M. Stevens, and Martyn G. Boutelle. (2021) . Fiber-Based Electrochemical Biosensors for Monitoring pH and Transient Neurometabolic Lactate. Anal. Chem. https://doi.org/10.1021/acs.analchem.0c05108]. EXPLICACIÓN DE LA INVENCIÓN Como se ha indicado en el apartado anterior, los métodos de monitorización del bienestar fetal intraparto, empleados en la actualidad en los hospitales adolecen de falta de especificidad (método cardiotocográfico) , siendo necesario recurrir en determinadas circunstancias a pruebas diagnósticas adicionales (toma de sangre de la calota fetal) , que además de cruentas son inviables para la monitorización en continuo y en tiempo real. Para resolver esta carencia, se propone un dispositivo que pueda realizar una adecuada monitorización del bienestar fetal intraparto, que aporte información, suficiente, continua y en tiempo real, que favorezca la toma de decisiones y la gestión y el correcto manejo del parto en gestantes de parto con riesgo de pérdida del bienestar fetal, que a su vez sea mínimamente invasivo y que posea la capacidad de transmitir dicha información a un receptor remoto (teléfono móvil, tableta, ordenador portátil, etc.) , dotando a los facultativos de una herramienta objetiva, simple y sencilla de usar, que les aporte un diagnóstico más conciso y fiable que los sistemas empleados en la actualidad. El dispositivo propuesto basa su funcionamiento en la determinación continua y en tiempo real de los niveles de lactato y del pH intersticial. El lactato constituye un buen indicador perinatal o de hipoxia metabólica severa en la piel de la cabeza del feto. Cuando el lactato fetal supera los 5, 2 mmol/L está indicado finalizar el parto por la vía más rápida. Así, se dispondría de una herramienta objetiva que facilitaría la toma de decisiones a los facultativos y contribuiría a disminuir la tasa de falsos positivos derivada del uso de las actuales herramientas diagnósticas y la tasa de cesáreas (global en torno al 5% y urgentes hasta el 25%) por sospecha de pérdida de bienestar fetal, aumentando al mismo tiempo la sensibilidad y especificidad en la detección de la hipoxia fetal intraparto. Asimismo, la identificación del valor de pH en tiempo real ayuda enormemente al diagnóstico de acidosis láctica, entre otros, incrementando la fiabilidad del dispositivo de manera inequívoca. El objeto de la invención, por tanto, consiste en un dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, que incorpora un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de pH, y que cuenta con la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenarán temporal o permanentemente y desde el cual el facultativo podrá visualizarlos. El parche incluirá una o varias agujas introductoras que permitirían la extracción del líquido intersticial. En su colocación inicial se realizará la perforación inicial en la capa de piel, para que los sensores puedan comenzar a funcionar. El biosensor de lactato que incorpora la invención consta de un mediador redox (Azul de Prusia) encima del sustrato de carbono con las siguientes capas cubriéndolo: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) Nafion, mientras que el sensor de pH que incorpora la invención, por su parte, es un electrodo de carbono electrodepositado con polianilina. Un segundo aspecto de la invención lo constituye precisamente la configuración de las capas utilizadas en la fabricación del biosensor de lactato optimizado, que incorpora la presente invención. A continuación, se aporta el razonamiento por el cual dicha configuración constituye un segundo aspecto de la invención. En primer lugar, es importante recalcar que la medida de la concentración de lactato se lleva a cabo de una manera indirecta, monitorizando la especie de peróxido de hidrógeno generada como subproducto en la reacción enzimática del lactato con la Lactato Oxidasa. La primera capa de Azul de Prusia posibilita la detección del peróxido de hidrógeno a un potencial eléctrico mucho más bajo que los clásicos sensores basados en Pt, por lo que reduce de manera considerable la influencia de interferentes. En segundo lugar, la capa enzimática proporciona la selectividad necesaria para detectar exclusivamente el lactato aún en matrices tan complejas como las fisiológicas. Además, sobre la capa anterior se añaden nanopartículas de oro, obtenidas mediante síntesis verde, con el fin de mejorar la sensibilidad, aumentando la superficie específica del biosensor resultante, así como favoreciendo el desplazamiento de la señal hacia potenciales menos positivos gracias a su efecto electrocatalítico. Por otro lado, aunque en bibliografía pueden encontrarse biosensores que, a priori, pueden parecer similares, no hay precedentes de un biosensor que englobe el uso de éstas capas poliméricas diferentes y en conjunto como se describe en este texto. Específicamente, la capa de quitosano se emplaza como una capa de cobertura a la capa de enzima para encapsularla y favorecer la funcionalidad de la misma; además, este biopolímero es altamente compatible lo que proporciona un ambiente óptimo para que se lleven a cabo las reacciones enzimáticas pertinentes. Por otro lado, las capas de PVC y Nafion permiten extender de manera significativa el rango lineal de concentración del sensor, ya sea como membrana de difusión en el primer caso o como retícula aniónica en el segundo. Merece la pena destacar que la última posee un doble rol, su carácter aniónico permite la repulsión de especies interferentes cargadas egativamente (e.j. ácido ascórbico, ácido úrico, etc.) y también ralentiza la difusión del lactato al interior del biosensor evitando una saturación enzimática temprana. Además, las membranas de quitosano y Nafion se han depositado mediante el método conocido en literatura como "spin coating", no utilizado para el desarrollo de este tipo de biosensores de lactato hasta la fecha. Este enfoque proporciona membranas mucho más compactas y sobre todo menos porosas que las resultantes por deposición por gota tradicional. Esto contribuye a la robustez y a una mejora adicional del rango lineal de concentración útil del dispositivo, tan necesario para las aplicaciones propuestas. La unidad biosensor de lactato está provista de cuatro contactos, tres de los cuales son electrodos: electrodos de trabajo, de referencia, contraelectrodo y contacto eléctrico. Por otro lado, la unidad sensor de pH está provista de tres contactos: electrodos de trabajo, de referencia y contacto eléctrico. Estos electrodos se pueden fabricar usando un material conductor que esté impreso o grabado, por ejemplo, tal como el carbono que puede estar impreso o una lámina metálica que puede grabarse. El dispositivo objeto de la invención cuenta además con la electrónica necesaria para hacer posible la adquisición, adecuación y transmisión de los valores de los analitos registrados por los sensores a un dispositivo receptor inalámbrico externo con capacidad de procesamiento de datos. Entre los componentes electrónicos que incorpora el dispositivo se encuentran los pines de conexión, un conversor digital-analógico, un amplificador, un conversor analógico-digital, un microcontrolador, un transceptor Bluetooth y una fuente de alimentación. Gracias a estos componentes electrónicos es posible establecer el potencial necesario en cada pin para el correcto funcionamiento de los sensores electroquímicos, así como adquirir, adecuar y transmitir las señales procedentes de los sensores obtenidas a través de los pines conectados a las microagujas. Para establecer el potencial necesario en los pines del sensor, se dispone de un conversor Digital a Analógico de 12 bits conectados a los pines de referencia que estarán directamente conectados mediante las pistas del circuito impreso a los pines e conexión de las microagujas. Esta etapa dispone también de sensores de temperatura necesario para la calibración de las medidas. La etapa del acondicionamiento de la señal consiste en el filtrado y la amplificación de las señales procedentes de los diferentes sensores: - Para el filtrado se dispone de filtros paso bajo antes de atacar a la etapa de amplificación de la señal. - Para la amplificación de la señal se incorporan amplificadores de transimpedancia que convierte la señal en corriente a una señal en voltaje que se conecta directamente al conversor analógico digital. Posteriormente es necesario realizar la conversión de la señal analógica a una señal digital que pueda ser tratada por el microcontrolador. Para ello se incorpora conversor Analógico a Digital que disponga de salida en formato SPI (Interfaz de comunicación Serie) para su conexión a la entrada del Microcontrolador. El microcontrolador, además de proporcionar las señales necesarias para el control de cada etapa anterior, recibe de la etapa de conversión analógico digital los datos de la lectura de los sensores. Para transmisión de los datos de las medidas al dispositivo receptor, así como para la recepción de los diferentes comandos de configuración de los sensores, el dispositivo incorpora un transceptor Bluetooth de baja energía. Finalmente, para la alimentación de todos los componentes el dispositivo incorpora una fuente de alimentación. Esta arquitectura conforma un esquema electrónico, diseñado en un circuito impreso, donde se ensamblan también los elementos electromecánicos y la propia fuente de alimentación. En lo concerniente a la exposición de los datos estos se recogerán y mostrarán en un receptor remoto (teléfono móvil, tableta, ordenador portátil, etc.) , por medio de una plicación informática que habrá de estar instalada en el mismo, de manera que el facultativo médico pueda interpretar fácilmente su evolución, así como extraer conclusiones relevantes a través de su histórico, si fuera necesario. Esta aplicación será susceptible de futuras mejoras a través de parches informáticos o actualizaciones de firmware. Además de las ventajas evidentes, derivadas de contar con un dispositivo que, además de ser mínimamente invasivo, pueda realizar una adecuada monitorización del bienestar fetal intraparto, aportando de manera continua y en tiempo real, la información suficiente para la toma adecuada de decisiones y el correcto manejo del parto en gestantes de parto con riesgo de pérdida del bienestar fetal, a continuación, se mencionan otras ventajas relacionadas: - Disminución de la tasa de falsos positivos derivada del uso de las actuales herramientas diagnósticas (mayoritariamente basadas en la interpretación del registro cardiotocográfico) . - Reducción de la tasa de cesáreas (global en torno al 5% y urgentes hasta el 25%, según el INE (2016) ) por sospecha de pérdida de bienestar fetal, reduciendo también los costes asociados a esta práctica (a nivel nacional, de aproximadamente 44M? anuales) y, además, se reducen en un 10% los recursos materiales y humanos para atención al parto, aumentando al mismo tiempo la sensibilidad y especificidad en la detección de la hipoxia fetal intraparto. - Mejora del desempeño de la labor asistencial por parte del personal sanitario, facilitando el seguimiento de estos parámetros de una manera sencilla y eficaz. - Disminución del número de demandas por negligencia del personal sanitario dedicado a la asistencia de partos. - Incremento de la práctica piel con piel en el momento del nacimiento (no llevada a cabo con las cesáreas) , cuyos beneficios ya han sido demostrados durante las horas posteriores al parto. En definitiva, el control intensivo mediante la monitorización continua del metabolismo del feto basado en nivel de lactato y el pH, que permite realizar el dispositivo objeto de la invención, supondrá un cambio paradigmático en el control del bienestar fetal intraparto. Adicionalmente, el dispositivo objeto de la invención puede tener aplicación en cualquier situación que precise la monitorización continua de los valores de pH y lactato de un sujeto. A continuación, se mencionan algunos de estos usos posibles: - En cualquier situación clínica que precise la monitorización continua del pH y lactato. - Como generador de alertas en un receptor inalámbrico externo en situaciones compatibles con acidosis láctica. - Para su uso sobre recién nacidos en UCI neonatales para el diagnóstico de sepsis neonatales. - Para la realización de un seguimiento estrecho de los niveles de pH y lactato en sujetos adultos con cetoacidosis diabética o sepsis. - Para su uso en el ámbito de la medicina del deporte para la monitorización en tiempo real de los niveles de lactato y pH en entrenamientos deportivos. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Procedimiento de fabricación del biosensor de lactato. Figura 2. Procedimiento de fabricación del sensor de pH. Figura 3. Esquema de la reacción llevada a cabo durante la determinación del lactato por el biosensor desarrollado. Figura 4. Esquema de la arquitectura del sistema electrónico que conforma el sistema de medida y que está compuesta por diferentes bloques. En esta figura se distinguen: - Pines de conexión (PC) . - Conversor digital-analógico (DAC) , - Amplificador (A) . - Conversor analógico-digital (ADC) . - Microcontrolador (uC) . - Antena bluetooh (BLE) . - Fuente de alimentación (PS) . REALIZACIÓN PREFERENTE DE LA INVENCIÓN A continuación, se recogen ejemplos de realización de los elementos que componen el dispositivo objeto de la invención: Ejemplo 1: Fabricación de biosensor de lactato a) Materiales y reactivos: Se utilizaron los siguientes reactivos para la fabricación del biosensor: • Transductor de C. • Solución de FeCh y KíFe (CN) 6 (Merck-Sigma Aldrich) • Lactato oxidasa (Merck-Sigma Aldrich) . • Quitosano (Merck-Sigma Aldrich) . • Cloruro de polivinilo (Merck-Sigma Aldrich) • Disolución coloidal de nanopartículas de oro obtenidas siguiendo el procedimiento descrito en la patente ES-2364914. b) Procedimiento de fabricación del biosensor de lactato: El procedimiento para la fabricación del biosensor de lactato es el siguiente: 1. Se parte de un transductor de C (previamente polarizado en una disolución tampón de fosfato de concentración en el intervalo 0, 01-0, 1 M, a un pH comprendido entre 7 y 7.6 y a un potencial entre 1.6-1.8 V, durante un tiempo de polarización próximo a 200 s) , que actúa como electrodo de trabajo. A continuación, se procede a depositar las siguientes capas: a) Deposición de dos gotas de un volumen comprendido entre 10-20 microlitros de FeCl3 (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) 6 /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja aproximadamente 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con HCl (0, 01M) y se introduce en una estufa a una temperatura comprendida entre 90 y 120°C durante aproximadamente una hora. b) Deposición de una gota de 15-25 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (6-10 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 20-40 microlitros de quitosano 1% (m/V) en ácido cético (0, 1M) (pH en torno a 4.25-4.75) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. d) Deposición de una gota de 4-5 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso de una a tres veces más para obtener capas poliméricas adicionales. e) Deposición de una gota de 10-13 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7-8) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. 2. La medición se realiza aplicando una corriente eléctrica necesaria para generar un potencial (E) entre 0.00 y +0.06 V, en el cual el Fe3+ de la superficie del azul de Prusia se reduce a Fe2+ el cual reacciona con el peróxido de hidrógeno producido en la reacción enzimática que convierte al lactato en piruvato. El peróxido de hidrógeno reoxida el Fe2+ a Fe3+ lo que resulta en una nueva corriente de electrones que reduce de nuevo el hierro en la superficie. El esquema de la reacción que se lleva a cabo, se muestra en la Figura 3. Por tanto, la corriente producida puede relacionarse con el peróxido de hidrógeno generado y, por ende, con el lactato nativo en la muestra. Ejemplo 2: Fabricación de sensor de pH a) Materiales y reactivos: Se utilizaron los siguientes reactivos para la fabricación del biosensor: • Transductor de C. • Solución de HCl y Anilina (Merck-Sigma Aldrich) • Polivinil Butiral (PVB) (Merck-Sigma Aldrich) . • Poliuretano (PU) (Merck-Sigma Aldrich) . b) Procedimiento de fabricación del sensor de pH: 1. Se parte de un transductor de C (previamente acondicionado mediante voltamperometría cíclica, 10 barridos de -0, 3 a 1, 1V en una disolución de 0, 5 M HCl) . A continuación, se procede a depositar la capa de polianilina de la siguiente manera: -Se realizan 12 barridos en voltamperometría cíclica en un rango de potencial entre -0, 2 y 1, 0 V en una disolución de 1 M HCl y 0, 1 M Anilina: Para mejorar la estabilidad de la medida de pH se modifica el electrodo de referencia on capas adicionales de polivinil butiral y poliuretano mediante: a) Deposición por gota de 2, 5L de una disolución PVB (74, 8 mg PVB, 50mg NaCl en 1mL metanol) . Esta capa se deja secar durante 1 hora y media al aire y se repite el proceso dos veces más. Al terminar se deja secar de nuevo todas las capas 12 horas. b) Deposición por gota de 2, 5L disolución PU (30mg PU en 1ml THF) . Esta capa se seca al aire durante 24 horas. 2. La medición se realiza registrando el potencial entre los electrodos de trabajo y de referencia a través del tiempo. El fundamento se basa en la modificación espontánea de fase de la polianilina según el pH de la disolución con la que se encuentra en contacto. Este cambio de fase va asociado con un cambio de potencial eléctrico que se puede monitorizar. Ejemplo 3: Fabricación de circuito impreso que incorpora los componentes electrónicos para la lectura adaptación y transmisión de señales. a) Materiales: Se emplearon los siguientes componentes para la fabricación del circuito impreso: • Microcontrolador de 32 bits y doble núcleo. • Alimentación del sistema basado en uno o varios reguladores LDO de 3.3V. • Sistema Bluetooth Low Energy (BLE) . • Sistema de adaptación de entrada de sensores formado por elementos semiconductores y elementos pasivos. • Tarjeta PCB de cuatro capas diseñada para ser inmune a los campos electromagnéticos. b) Procedimiento de fabricación de circuito impreso La principal función de este bloque es la adquisición de las señales que provienen de los sensores a través de los pines conectados a las microagujas. También se encarga de establecer el potencial necesario en cada pin para el correcto funcionamiento de los sensores electroquímicos. La primera etapa del acondicionamiento de la señal consiste en el filtrado de las señales de los diferentes sensores, para ello se dispone de filtros paso bajo antes de atacar a la etapa de amplificación de la señal. Para ello se dispone de amplificadores de transimpedancia de manera que la señal pueda ser eída por el siguiente bloque. El amplificador de transimpedancia convierte la señal en corriente a una señal en voltaje que se conecta directamente a la etapa del conversor analógico digital. Para establecer el potencial necesario en los pines del sensor, se dispone de un conversor Digital a Analógico de 12 bits conectados a los pines de referencia que estarán directamente conectados mediante las pistas del circuito impreso a los pines de conexión de las microagujas. Esta etapa dispone también de sensores de temperatura necesario para la calibración de las medidas. Conversor Analógico a Digital: Se dispone de un conversor Analógico a Digital tipo Sigma - Delta de 16 bits necesario para que la señal analógica pueda ser convertida a digital y ser tratada por el microcontrolador. Este conversor dispone de salida en formato SPI (Interfaz de comunicación Serie) que se conecta a la entrada del Microcontrolador Microcontrolador / Transceptor Bluetooth de baja energía: El microcontrolador, además de proporcionar las señales de control necesarias para el control de cada etapa anterior, recibe de la etapa de conversión analógico digital los datos de la lectura de los sensores. Esta etapa dispone también del transceptor Bluetooth de baja energía para transmisión de los datos de las medidas al dispositivo receptor y para la recepción de los diferentes comandos de configuración de los sensores. Bloque de Alimentación: El bloque de alimentación provee de energía a todo el sistema. Está compuesto por una pila de 3V tipo CR2032, así como reguladores LDO de baja caída de tensión y los filtros y componentes necesarios para su correcta polarización y reducción de rizado en las diferentes tensiones de alimentación. Esta arquitectura conforma un esquema electrónico que está diseñado en un circuito impreso donde se ensamblan también los elementos electromecánicos y la propia pila. Todos los componentes irán en una envolvente IP68, y será adherido al cuero cabelludo del neonato mediante un apósito adhesivo neutro. Debe entenderse que esta descripción no pretende limitarse a las realizaciones particulares descritas ya que pueden variar. Asimismo, debe entenderse que la terminología usada solo tiene la finalidad de describir formas de realización particulares y no pretende ser limitativa.
Publicaciones:
ES2959128 (20/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 22/07/2022 se realizó Registro Instancia de Solicitud
En fecha 26/07/2022 se realizó Admisión a Trámite
En fecha 26/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 27/07/2022 se realizó Superado examen de oficio
En fecha 01/06/2023 se realizó Realizado IET
En fecha 02/06/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 12/09/2023 se realizó PETEX_Petición de examen sustantivo
En fecha 20/02/2024 se realizó Publicación Solicitud
En fecha 20/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
22/07/2022 - Pago Tasas IET
+ ES-2959128_A11. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, caracterizado por que su funcionamiento se basa en la determinación continua y en tiempo real de los niveles intersticiales de lactato y del pH. 2. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 1, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción del fluido corporal intersticial, que comprende: - un biosensor de lactato, - un sensor de pH, - circuitos y componentes electrónicos para realizar la adquisición, adecuación y transmisión de las señales de los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos. 3. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 2, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción del fluido corporal intersticial, que comprende: - un biosensor de lactato, que consiste en un mediador redox (Azul de Prusia) sobre un sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion, - un sensor de pH, que consiste en un electrodo de carbono electrodepositado con polianilina, - circuitos y componentes electrónicos para realizar la adquisición, adecuación y transmisión de las señales de los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos. 4. Dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, según reivindicación 3, que consiste en un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, y que comprende un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de H, y que además incorpora la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenan temporal o permanentemente y desde el cual el facultativo puede visualizarlos. 5. Biosensor electroquímico amperométrico de lactato optimizado para su uso en dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, que consiste en un mediador redox (Azul de Prusia) sobre un sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion. 6. Procedimiento de fabricación del biosensor de lactato, según reivindicación 5, caracterizado por que partiendo de un transductor de C (previamente polarizado en una disolución tampón de fosfato de concentración en el intervalo 0, 01-0, 1 M, a un pH comprendido entre 7 y 7.6 y a un potencial entre 1.6-1.8 V, durante un tiempo de polarización próximo a 200 s) , que actúa como electrodo de trabajo, se realizan las siguientes etapas: a) Deposición de dos gotas de un volumen comprendido entre 10-20 microlitros de FeCl3 (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) a /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja aproximadamente 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con HCl (0, 01M) y se introduce en una estufa a una temperatura comprendida entre 90 y 120°C durante aproximadamente una hora. b) Deposición de una gota de 15-25 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (6-10 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 20-40 microlitros de quitosano 1% (m/V) en ácido acético (0, 1M) (pH en torno a 4.25-4.75) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. d) Deposición de una gota de 4-5 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso de una a tres veces más para obtener capas poliméricas adicionales. e) Deposición de una gota de 10-13 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7-8) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. 7. Procedimiento de fabricación del biosensor de lactato, según reivindicación 5, caracterizado por que partiendo de un transductor de C (previamente polarizado en una disolución tampón de fosfato 0, 1 M en pH 7.4 a un potencial 1.7 V durante 180 s) , que actúa como electrodo de trabajo, se realizan las siguientes etapas: a) Deposición de dos gotas de 12 microlitros de FeCh (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) 6 /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con 40 microlitros de HCl (0, 01M) y se introduce en una estufa a 100°C durante una hora. b) Deposición de una gota de 20 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (7, 7 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 30 microlitros de quitosano 1% (m/V) en ácido acético (0, 1M) (pH alrededor de 4.5) . Esta gota se seca mediante un rotor giratorio a 1000 rpm. d) Deposición de una gota de 4, 2 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso dos veces más para obtener una capa polimérica adicional. e) Deposición de una gota de 11, 5 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7) . Esta gota se seca mediante un rotor giratorio a 1000 rpm. 8. Dispositivo, según reivindicaciones 1 a 4, para su uso como generador de alertas en un receptor inalámbrico externo en situaciones compatibles con acidosis láctica. 9. Dispositivo, según reivindicaciones 1 a 4, para su uso en cualquier situación clínica que precise la monitorización continua del pH y lactato. 10. Dispositivo, según reivindicaciones 1 a 4, para su uso sobre recién nacidos en UCI neonatales para el diagnóstico de sepsis neonatales. 11. Dispositivo, según reivindicaciones 1 a 4, para su uso realización de un seguimiento estrecho de los niveles de pH y lactato en sujetos adultos con cetoacidosis diabética o sepsis. 12. Dispositivo, según reivindicaciones 1 a 4, para su uso en el ámbito de la medicina del deporte para la monitorización en tiempo real de los niveles de lactato y pH en entrenamientos deportivos.
Los productos y servicios protegidos por este registro son:
A61B 5/1482 - A61B 5/1486
Descripciones:
+ ES-2959128_A1 DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO SECTOR DE LA TÉCNICA La presente invención describe un dispositivo que permite realizar una adecuada monitorización en remoto del bienestar fetal intraparto, basado en la determinación continua y en tiempo real de los niveles de lactato intersticial y del pH. Más específicamente, la presente invención consiste en un dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, que incorpora un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de pH, y que cuenta con la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenarán temporal o permanentemente y desde el cual el facultativo podrá visualizarlos. Un segundo aspecto de la invención consiste en el diseño y procedimiento de fabricación de un biosensor electroquímico amperométrico de lactato microinvasivo, cuya configuración ha sido optimizada para su empleo en el dispositivo de monitorización objeto de la invención. Más específicamente este biosensor de lactato presenta una configuración de mediador redox Azul de Prusia encima del sustrato de carbono cubierto con las siguientes capas: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) y Nafion. ANTECEDENTES DE LA INVENCIÓN El lactato, la forma ionizada del ácido láctico, es el producto final del metabolismo anaeróbico de la glucosa en los músculos. En algas, microoganismos y plantas predomina el enantiómero D-lactato, mientras que en mamíferos es más frecuente encontrarlo como enantiómero L-lactato. Los biosensores basados en la medición de este metabolito han experimentado un gran avance, sobre todo en el campo de la medicina deportiva, para la monitorización de la homeostasis del deportista y la evaluación de su nivel de resistencia. En reposo, la concentración de L-lactato en sangre oscila entre 0, 5 y 2, 0 mM [Chan D, Barsan MM, Korpan Y, Brett CMA. L-lactate selective impedimetric bienzymatic biosensor based on lactate dehydrogenase and pyruvate oxidase. Electrochim Acta. 2017;231:209-15. http://dx.doi.org/10.1016/j.electacta.2017.02.050] y entre 8-10 mM durante el ejercicio, pudiendo aumentar durante un ejercicio físico extenuante desde 15 a 25 mM [Goodwin, M. L., Harris, J. E., Hernández, A., & Gladden, L. B. (2007) . Blood Lactate Measurements and Analysis during Exercise: A Guide for Clinicians. Journal of Diabetes Science and Technology, 1 (4) , 558-569. https://doi.org/10.1177/193229680700100414]. A medida que aumenta la concentración de lactato, disminuye el pH celular, debido a la acumulación de protones dentro de la célula, lo que podría conducir a la aparición de acidosis en sangre si los niveles sobrepasan los 25 mM. Cuando se alcanza este nivel de lactato, conocido como umbral de lactato, se pueden producir dolencias de diferente índole, desde ligera fatiga hasta dolor muscular agudo, por lo que es recomendable que el atleta pare la actividad física. Además del ejercicio físico, cualquier condición fisiológica que active las rutas metabólicas anaeróbicas y provoque un desequilibrio en los niveles de lactato, podría conducir a una acidosis láctica. Estados fisiológicos o trastornos tales como el shock hemorrágico, la insuficiencia respiratoria, la insuficiencia renal o la hipoxia en los tejidos, pueden aumentar la producción de este metabolito. Por ello, el aumento en la concentración de lactato se utiliza habitualmente como señal de alarma para la intervención del equipo médico en los pacientes hospitalizados [Seheult J, Fitzpatrick G, Boran G. Lactic acidosis: An update. Clin Chem Lab Med. 2017;55 (3) :322-33, https://doi.org: 10.1515/cclm-2016-0438]. De forma análoga a la actividad física del deportista, el feto se ve sometido a un esfuerzo extenuante durante el parto, por lo que monitorizar el bienestar fetal se vuelve una necesidad clave. Esta práctica tiene como objetivo la detección de hipoxia o acidosis en fetos, para evitar las secuelas asociadas a estos estados, como la encefalopatía hipóxico-isquémica, la parálisis cerebral e incluso la muerte. La acidosis respiratoria debido a la acumulación de dióxido de carbono (hipercapnia) es frecuente durante el metabolismo normal, por lo que, aunque la concentración de iones H+ aumenta, este tipo de acidosis transitoria no está asociada con resultados negativos. Sin embargo, cuando el feto recibe oxígeno de forma insuficiente durante el parto, no tiene la capacidad para mantener el metabolismo normal, lo que obliga a cambiar al metabolismo anaeróbico. Como resultado, se genera y acumula ácido láctico y, en consecuencia, disminuye el pH. En este tipo de acidosis, conocida como acidosis metabólica, la falta de oxígeno de forma prolongada puede conducir a la asfixia durante el parto, complicaciones neurológicas postnatales como la encefalopatía hipóxico-isquémica o discapacidades a largo plazo [Cummins, G., Kremer, J., Bernassau, A., Brown, A., Bridle, H., Schulze, H., Bachmann, T., Crichton, M., Denison, F., & Desmulliez, M. (2018) . Sensors for Fetal Hypoxia and Metabolic Acidosis: A Review. Sensors, 18 (8) , 2648. https://doi.org/10.3390/s18082648]. La hipoxia metabólica severa con acumulación de lactato se considera un buen indicador de mal resultado perinatal [Wiberg, N., & Kallén, K. (2017) . Fetal scalp blood lactate during second stage of labor: determination of reference values and impact of obstetrical interventions. Journal of Maternal-Fetal and Neonatal Medicine, 30 (5) , 612 617. https://doi.org/10.1080/14767058.2016.1181167], con la consiguiente pérdida del bienestar fetal. El método clínico actual utilizado para el control del bienestar fetal se basa en el registro cardiotocográfico, en el que se registra de forma continua la frecuencia cardíaca fetal y la intensidad de las contracciones uterinas. Sin embargo, la especificidad de esta técnica para la detección del síndrome hipóxico-isquémico neonatal (falta de oxígeno) es tan baja que a veces conduce a realizar intervenciones urgentes (cesáreas) de forma innecesaria, con el riesgo que ello conlleva para la madre y el feto, además, del coste asociado a dicha práctica. Por este motivo, cuando en el registro cardiotocográfico se observan resultados inadecuados, antes de la toma de decisiones, la posible alteración de la homeostasis fetal debe ser constatada mediante una segunda prueba diagnóstica. Actualmente, dicha prueba consiste en la obtención de una muestra de sangre del cuero cabelludo fetal para la posterior determinación de los niveles de lactato en sangre y pH, ya que ambos son indicativos de acidosis metabólica. Cuando el lactato fetal supera los 5, 2 mmol/L está indicado finalizar el parto por la vía más rápida (habitualmente, la realización de una cesárea urgente por pérdida de bienestar fetal [Wiberg, N., & Kallén, K. (2017) . Fetal scalp blood lactate during second stage of labor: determination of reference values and impact of obstetrical interventions. Journal of Maternal-Fetal and Neonatal Medicine, 30 (5) , 612-617. https://doi.org/10.1080/14767058.2016.1181167; Rorbye, C., Perslev, A., & Nickelsen, C., (2016) . Lactate versus pH levels in fetal scalp blood during labor - using the Lactate Scout System. Journal of Maternal-Fetal and Neonatal Medicine, 29, 1200-1204. https://doi.org/10.3109/14767058.2015.1045863; Ramanah, R., Martin, A., Riethmuller, D., Maillet, R., & Schaal, J.P. (2005) . Value of fetal scalp lactate sampling during labour: a comparative study with scalp pH. Gynécologie Obstétrique & Fertilité, 33, 107-112. https://doi.org/10.10167j.gyobfe.2005.01.004; Birgisdottir, B.T., Holzmann, M., Varli, I.H., Graner, S., Saltvedt, S., & Nordstrom, L. (2017) . Reference values for Lactate Pro 2TM in fetal blood sampling during labor: a cross-sectional study. Journal of Perinatal Medicine, 45, 321-325. https://doi.org/10.1515/jm-2016-0027]) . La técnica para la obtención de este tipo de muestras de sangre (en modo puntual o discontinuo, no aconsejándose más de 2 tomas de sangre) es bastante cruenta, compleja y no exenta de complicaciones, tanto para la madre como para el feto, por lo que no se realiza en todos los hospitales. En este escenario la decisión final de efectuar una intervención urgente (cesárea) por riesgo de pérdida de bienestar fetal se basa exclusivamente en el registro cardiotocográfico, aun conociéndose su escasa fiabilidad. Los estudios realizados demuestran que, del total de cesáreas realizadas por resultados no satisfactorios en el registro cardiotocográfico, sólo el 36% de los recién nacidos presentaban secuelas. El 64% restante, correspondían a recién nacidos sanos, en los que la realización de una intervención urgente, junto con los riesgos que ello conlleva, podrían haberse evitado [Gluhovschi, A., luriciuc, M., Anastasiu, D., Cimpeanu, L., & Nyiredi, A. (2012) . A retrospective analysis over the emergency Cesarean section performed due to cardio-tocographic modifications. Timisoara Medical Journal, 62 (1-2) , 20-23]. Esto demuestra claramente que el registro cardiotocográfico como tal no pueda ser considerado como una prueba diagnóstica definitiva. En España, la magnitud del problema implica a unos 25.000 casos al año, considerando las 100.000 cesáreas realizadas en 2016 según el INE, de las que el 25% se realizaron por sospecha de pérdida de bienestar fetal intraparto. La gran diferencia entre el número de cesáreas realizadas por pérdida de bienestar fetal según el registro cardiotocográfico y el número real de casos que desarrollan encefalopatía hipóxico-isquémica neonatal pone de manifiesto la elevada proporción de falsos positivos de las técnicas actuales y, en consecuencia, la necesidad de desarrollar una alternativa diagnóstica que contribuya a disminuir el número de intervenciones urgentes que se realizan de forma innecesaria. De entre las opciones disponibles, se propone la medición de lactato mediante el uso de un biosensor electroquímico, que va asociado a una técnica simple, rápida, incruenta (pues no implica incisiones en el cuero cabelludo fetal) , fiable y microinvasiva que permite evaluar los niveles de lactato en tiempo real y de forma continua con la simple colocación del dispositivo sobre el cuero cabelludo del feto. El dispositivo propuesto combinaría un elemento de reconocimiento biológico, que de forma sensible y específica monitorizaría los niveles de lactato durante el parto, con un sistema de transducción electroquímico amperométrico, debido a la sensibilidad, simplicidad y rapidez de respuesta de este tipo de transductores, frente a otros biosensores de tipo óptico o térmico [Kucherenko IS, Topolnikova Y V., Soldatkin OO. Advances in the biosensors for lactate and pyruvate detection for medical applications: A review. TrAC - Trends Anal Chem. 2019;110:160-72. https://doi.org/10.1016yj.trac.2018.11.004]. Dicha monitorización se llevaría a cabo de forma remota (wireless) , en continuo (on line) y en tiempo real, por medio de un dispositivo móvil del tipo teléfono inteligente (smartphone) o tableta. La idea en la que se basa esta propuesta es que dicho biosensor proporcionará medidas en continuo y cambios de tendencia en los valores a tiempo real, aportando información mucho más significativa que las medidas puntuales en sangre, mejorando otablemente la estimación de lactato en comparación con los métodos discontinuos y cruentos utilizados actualmente en la práctica clínica. Aunque en la actualidad, existen biosensores tanto bienzimáticos, con dos enzimas [Pundir, C.S., Narwal, V., & Batra, B. (2016) . Determination of lactic acid with special emphasis on biosensing methods: A review. Biosensors and Bioelectronics, 86, 777 790. https://doi.org/10.10167j.bios.2016.07.076; Andersson, A., Chen, Q., Groop, L., Bülow, L., & Xie, B. (2017) . Continuous and simultaneous determination of venous blood metabolites. Talanta, 171, 270-274. https://doi.org/10.10167j.talanta.2017.05.010; Kotanen, C.N., Karunwi, O., Alam, F., Uyehara, C.F.T., & Guiseppi-Elie, A. (2018) . Fabrication and in vitro performance of a dual responsive lactate and glucose biosensor. Electrochimica Acta, 267, 71-79. https://doi.org/10.1016/j.electacta.2018.02.042; Tsuruoka, N., Ishii, K., Matsunaga, T., Nagatomi, R., & Haga, Y. (2016) . Lactate and glucose measurement in subepidermal tissue using minimally invasive microperfusion needle. Biomedical Microdevices, 18 (1) , 19. https://doi.org/10.1007/s10544-016-0049-z], como individuales [Cunha-Silva, H., & Arcos-Martínez, M.J. (2018) . Dual range lactate oxidase based screen printed amperometric biosensorfor analysis of lactate in diverisified samples. Talanta, 188, 779-787. https://doi.org/10.1016/j.talanta.2018.06.054; Lamas-Ardisana, P.J., Loaiza, O.A., Añorga, L., Jubete, E., Borghei, M., Ruiz, V., Ochoteco, E., Cabañero, G., & Grande, H.J. (2014) . Disposable amperometric biosensor based on lactate oxidase immobilised on platinum nanoparticle-decorated carbon nanofiber and poly (diallyldimethylammonium chloride) films. Biosensors and Bioelectronics, 56, 345 51. https://doi.org/10.1016/j.bios.2014.01.047; Andrus, L.P., Unruh, R., Wisnieweski, N.A., & McShane, M.J. (2015) . Characterization of lactate sensors based on lactate oxidase and palladium benzoporphyrin immobilized in hidrogels. Biosensors, 5, 398 416. https://doi.org/10.3390/bios5030398; Poscia, A., Messeria, D., Moscone, D., Ricci, F., & Valgimiglia, F. (2005) . A novel continuous subcutaneous lactate monitoring system. Biosensors and Bioelectronics, 20, 2244-2250. https://doi.org/10.1016/j.bios.2004.10.031], capaces, en algunos casos, de cuantificar lactato en tejido intersticial mediante técnicas microinvasivas [Rassaei, L., Olthuis, W., Tsujimura, S., Sudholter, E.J.R., & van den Berg, A. (2014) . Lactate biosensors: current status and outlook. Analytical and Bioanalytical Chemistr y , 406, 123-137. https://doi.org/10.1007/s00216-013-7307-1; Weltin, A., Kieninger, J., & Urban, G.A. (2016) . Microfabricated, amperometric, enzyme-based biosensors for in vivo pplications. Analytical and Bioanalytical Chemistr y , 408 (17) , 4503-4521. https://doi.org/10.1007/s00216-016-9420-4; Pundir, C.S., Narwal, V., & Batra, B. (2016) . Determination of lactic acid with special emphasis on biosensing methods: A review. Biosensors and Bioelectronics, 86, 777-790. https://doi.org/10.1016/j.bios.2016.07.076], no obstante, ninguno de ellos aplica el biosensor a la determinación del lactato en el tejido intersticial en fetos. Adicionalmente se propone el uso de un sensor de pH que registre de manera similar este parámetro de manera continua. Se ha demostrado que el conjunto de valores de lactato y pH permite un diagnóstico más conciso y fiable de diversas patologías y síndromes [Marsilea A. Booth, Sally A. N. Gowers, Melinda Hersey, Isabelle C. Samper, Seongjun Park, Polina Anikeeva, Parastoo Hashemi, Molly M. Stevens, and Martyn G. Boutelle. (2021) . Fiber-Based Electrochemical Biosensors for Monitoring pH and Transient Neurometabolic Lactate. Anal. Chem. https://doi.org/10.1021/acs.analchem.0c05108]. EXPLICACIÓN DE LA INVENCIÓN Como se ha indicado en el apartado anterior, los métodos de monitorización del bienestar fetal intraparto, empleados en la actualidad en los hospitales adolecen de falta de especificidad (método cardiotocográfico) , siendo necesario recurrir en determinadas circunstancias a pruebas diagnósticas adicionales (toma de sangre de la calota fetal) , que además de cruentas son inviables para la monitorización en continuo y en tiempo real. Para resolver esta carencia, se propone un dispositivo que pueda realizar una adecuada monitorización del bienestar fetal intraparto, que aporte información, suficiente, continua y en tiempo real, que favorezca la toma de decisiones y la gestión y el correcto manejo del parto en gestantes de parto con riesgo de pérdida del bienestar fetal, que a su vez sea mínimamente invasivo y que posea la capacidad de transmitir dicha información a un receptor remoto (teléfono móvil, tableta, ordenador portátil, etc.) , dotando a los facultativos de una herramienta objetiva, simple y sencilla de usar, que les aporte un diagnóstico más conciso y fiable que los sistemas empleados en la actualidad. El dispositivo propuesto basa su funcionamiento en la determinación continua y en tiempo real de los niveles de lactato y del pH intersticial. El lactato constituye un buen indicador perinatal o de hipoxia metabólica severa en la piel de la cabeza del feto. Cuando el lactato fetal supera los 5, 2 mmol/L está indicado finalizar el parto por la vía más rápida. Así, se dispondría de una herramienta objetiva que facilitaría la toma de decisiones a los facultativos y contribuiría a disminuir la tasa de falsos positivos derivada del uso de las actuales herramientas diagnósticas y la tasa de cesáreas (global en torno al 5% y urgentes hasta el 25%) por sospecha de pérdida de bienestar fetal, aumentando al mismo tiempo la sensibilidad y especificidad en la detección de la hipoxia fetal intraparto. Asimismo, la identificación del valor de pH en tiempo real ayuda enormemente al diagnóstico de acidosis láctica, entre otros, incrementando la fiabilidad del dispositivo de manera inequívoca. El objeto de la invención, por tanto, consiste en un dispositivo microinvasivo para la monitorización remota, continua y en tiempo real del bienestar fetal intraparto, basado en el empleo de un parche corporal que pueda adherirse a la piel de la cabeza del feto, dotado de una o varias agujas que permitan la extracción de fluido corporal intersticial, que incorpora un biosensor electroquímico amperométrico de lactato y un sensor potenciométrico de pH, y que cuenta con la electrónica necesaria para la adquisición, adecuación y transmisión de la señal que incorpora los valores de los analitos registrados por los sensores a un dispositivo inalámbrico con capacidad de procesamiento de datos, donde se almacenarán temporal o permanentemente y desde el cual el facultativo podrá visualizarlos. El parche incluirá una o varias agujas introductoras que permitirían la extracción del líquido intersticial. En su colocación inicial se realizará la perforación inicial en la capa de piel, para que los sensores puedan comenzar a funcionar. El biosensor de lactato que incorpora la invención consta de un mediador redox (Azul de Prusia) encima del sustrato de carbono con las siguientes capas cubriéndolo: enzima lactato oxidasa y nanopartículas de oro, quitosano, cloruro de polivinilo (PVC) Nafion, mientras que el sensor de pH que incorpora la invención, por su parte, es un electrodo de carbono electrodepositado con polianilina. Un segundo aspecto de la invención lo constituye precisamente la configuración de las capas utilizadas en la fabricación del biosensor de lactato optimizado, que incorpora la presente invención. A continuación, se aporta el razonamiento por el cual dicha configuración constituye un segundo aspecto de la invención. En primer lugar, es importante recalcar que la medida de la concentración de lactato se lleva a cabo de una manera indirecta, monitorizando la especie de peróxido de hidrógeno generada como subproducto en la reacción enzimática del lactato con la Lactato Oxidasa. La primera capa de Azul de Prusia posibilita la detección del peróxido de hidrógeno a un potencial eléctrico mucho más bajo que los clásicos sensores basados en Pt, por lo que reduce de manera considerable la influencia de interferentes. En segundo lugar, la capa enzimática proporciona la selectividad necesaria para detectar exclusivamente el lactato aún en matrices tan complejas como las fisiológicas. Además, sobre la capa anterior se añaden nanopartículas de oro, obtenidas mediante síntesis verde, con el fin de mejorar la sensibilidad, aumentando la superficie específica del biosensor resultante, así como favoreciendo el desplazamiento de la señal hacia potenciales menos positivos gracias a su efecto electrocatalítico. Por otro lado, aunque en bibliografía pueden encontrarse biosensores que, a priori, pueden parecer similares, no hay precedentes de un biosensor que englobe el uso de éstas capas poliméricas diferentes y en conjunto como se describe en este texto. Específicamente, la capa de quitosano se emplaza como una capa de cobertura a la capa de enzima para encapsularla y favorecer la funcionalidad de la misma; además, este biopolímero es altamente compatible lo que proporciona un ambiente óptimo para que se lleven a cabo las reacciones enzimáticas pertinentes. Por otro lado, las capas de PVC y Nafion permiten extender de manera significativa el rango lineal de concentración del sensor, ya sea como membrana de difusión en el primer caso o como retícula aniónica en el segundo. Merece la pena destacar que la última posee un doble rol, su carácter aniónico permite la repulsión de especies interferentes cargadas egativamente (e.j. ácido ascórbico, ácido úrico, etc.) y también ralentiza la difusión del lactato al interior del biosensor evitando una saturación enzimática temprana. Además, las membranas de quitosano y Nafion se han depositado mediante el método conocido en literatura como "spin coating", no utilizado para el desarrollo de este tipo de biosensores de lactato hasta la fecha. Este enfoque proporciona membranas mucho más compactas y sobre todo menos porosas que las resultantes por deposición por gota tradicional. Esto contribuye a la robustez y a una mejora adicional del rango lineal de concentración útil del dispositivo, tan necesario para las aplicaciones propuestas. La unidad biosensor de lactato está provista de cuatro contactos, tres de los cuales son electrodos: electrodos de trabajo, de referencia, contraelectrodo y contacto eléctrico. Por otro lado, la unidad sensor de pH está provista de tres contactos: electrodos de trabajo, de referencia y contacto eléctrico. Estos electrodos se pueden fabricar usando un material conductor que esté impreso o grabado, por ejemplo, tal como el carbono que puede estar impreso o una lámina metálica que puede grabarse. El dispositivo objeto de la invención cuenta además con la electrónica necesaria para hacer posible la adquisición, adecuación y transmisión de los valores de los analitos registrados por los sensores a un dispositivo receptor inalámbrico externo con capacidad de procesamiento de datos. Entre los componentes electrónicos que incorpora el dispositivo se encuentran los pines de conexión, un conversor digital-analógico, un amplificador, un conversor analógico-digital, un microcontrolador, un transceptor Bluetooth y una fuente de alimentación. Gracias a estos componentes electrónicos es posible establecer el potencial necesario en cada pin para el correcto funcionamiento de los sensores electroquímicos, así como adquirir, adecuar y transmitir las señales procedentes de los sensores obtenidas a través de los pines conectados a las microagujas. Para establecer el potencial necesario en los pines del sensor, se dispone de un conversor Digital a Analógico de 12 bits conectados a los pines de referencia que estarán directamente conectados mediante las pistas del circuito impreso a los pines e conexión de las microagujas. Esta etapa dispone también de sensores de temperatura necesario para la calibración de las medidas. La etapa del acondicionamiento de la señal consiste en el filtrado y la amplificación de las señales procedentes de los diferentes sensores: - Para el filtrado se dispone de filtros paso bajo antes de atacar a la etapa de amplificación de la señal. - Para la amplificación de la señal se incorporan amplificadores de transimpedancia que convierte la señal en corriente a una señal en voltaje que se conecta directamente al conversor analógico digital. Posteriormente es necesario realizar la conversión de la señal analógica a una señal digital que pueda ser tratada por el microcontrolador. Para ello se incorpora conversor Analógico a Digital que disponga de salida en formato SPI (Interfaz de comunicación Serie) para su conexión a la entrada del Microcontrolador. El microcontrolador, además de proporcionar las señales necesarias para el control de cada etapa anterior, recibe de la etapa de conversión analógico digital los datos de la lectura de los sensores. Para transmisión de los datos de las medidas al dispositivo receptor, así como para la recepción de los diferentes comandos de configuración de los sensores, el dispositivo incorpora un transceptor Bluetooth de baja energía. Finalmente, para la alimentación de todos los componentes el dispositivo incorpora una fuente de alimentación. Esta arquitectura conforma un esquema electrónico, diseñado en un circuito impreso, donde se ensamblan también los elementos electromecánicos y la propia fuente de alimentación. En lo concerniente a la exposición de los datos estos se recogerán y mostrarán en un receptor remoto (teléfono móvil, tableta, ordenador portátil, etc.) , por medio de una plicación informática que habrá de estar instalada en el mismo, de manera que el facultativo médico pueda interpretar fácilmente su evolución, así como extraer conclusiones relevantes a través de su histórico, si fuera necesario. Esta aplicación será susceptible de futuras mejoras a través de parches informáticos o actualizaciones de firmware. Además de las ventajas evidentes, derivadas de contar con un dispositivo que, además de ser mínimamente invasivo, pueda realizar una adecuada monitorización del bienestar fetal intraparto, aportando de manera continua y en tiempo real, la información suficiente para la toma adecuada de decisiones y el correcto manejo del parto en gestantes de parto con riesgo de pérdida del bienestar fetal, a continuación, se mencionan otras ventajas relacionadas: - Disminución de la tasa de falsos positivos derivada del uso de las actuales herramientas diagnósticas (mayoritariamente basadas en la interpretación del registro cardiotocográfico) . - Reducción de la tasa de cesáreas (global en torno al 5% y urgentes hasta el 25%, según el INE (2016) ) por sospecha de pérdida de bienestar fetal, reduciendo también los costes asociados a esta práctica (a nivel nacional, de aproximadamente 44M? anuales) y, además, se reducen en un 10% los recursos materiales y humanos para atención al parto, aumentando al mismo tiempo la sensibilidad y especificidad en la detección de la hipoxia fetal intraparto. - Mejora del desempeño de la labor asistencial por parte del personal sanitario, facilitando el seguimiento de estos parámetros de una manera sencilla y eficaz. - Disminución del número de demandas por negligencia del personal sanitario dedicado a la asistencia de partos. - Incremento de la práctica piel con piel en el momento del nacimiento (no llevada a cabo con las cesáreas) , cuyos beneficios ya han sido demostrados durante las horas posteriores al parto. En definitiva, el control intensivo mediante la monitorización continua del metabolismo del feto basado en nivel de lactato y el pH, que permite realizar el dispositivo objeto de la invención, supondrá un cambio paradigmático en el control del bienestar fetal intraparto. Adicionalmente, el dispositivo objeto de la invención puede tener aplicación en cualquier situación que precise la monitorización continua de los valores de pH y lactato de un sujeto. A continuación, se mencionan algunos de estos usos posibles: - En cualquier situación clínica que precise la monitorización continua del pH y lactato. - Como generador de alertas en un receptor inalámbrico externo en situaciones compatibles con acidosis láctica. - Para su uso sobre recién nacidos en UCI neonatales para el diagnóstico de sepsis neonatales. - Para la realización de un seguimiento estrecho de los niveles de pH y lactato en sujetos adultos con cetoacidosis diabética o sepsis. - Para su uso en el ámbito de la medicina del deporte para la monitorización en tiempo real de los niveles de lactato y pH en entrenamientos deportivos. BREVE DESCRIPCIÓN DE LOS DIBUJOS Figura 1. Procedimiento de fabricación del biosensor de lactato. Figura 2. Procedimiento de fabricación del sensor de pH. Figura 3. Esquema de la reacción llevada a cabo durante la determinación del lactato por el biosensor desarrollado. Figura 4. Esquema de la arquitectura del sistema electrónico que conforma el sistema de medida y que está compuesta por diferentes bloques. En esta figura se distinguen: - Pines de conexión (PC) . - Conversor digital-analógico (DAC) , - Amplificador (A) . - Conversor analógico-digital (ADC) . - Microcontrolador (uC) . - Antena bluetooh (BLE) . - Fuente de alimentación (PS) . REALIZACIÓN PREFERENTE DE LA INVENCIÓN A continuación, se recogen ejemplos de realización de los elementos que componen el dispositivo objeto de la invención: Ejemplo 1: Fabricación de biosensor de lactato a) Materiales y reactivos: Se utilizaron los siguientes reactivos para la fabricación del biosensor: • Transductor de C. • Solución de FeCh y KíFe (CN) 6 (Merck-Sigma Aldrich) • Lactato oxidasa (Merck-Sigma Aldrich) . • Quitosano (Merck-Sigma Aldrich) . • Cloruro de polivinilo (Merck-Sigma Aldrich) • Disolución coloidal de nanopartículas de oro obtenidas siguiendo el procedimiento descrito en la patente ES-2364914. b) Procedimiento de fabricación del biosensor de lactato: El procedimiento para la fabricación del biosensor de lactato es el siguiente: 1. Se parte de un transductor de C (previamente polarizado en una disolución tampón de fosfato de concentración en el intervalo 0, 01-0, 1 M, a un pH comprendido entre 7 y 7.6 y a un potencial entre 1.6-1.8 V, durante un tiempo de polarización próximo a 200 s) , que actúa como electrodo de trabajo. A continuación, se procede a depositar las siguientes capas: a) Deposición de dos gotas de un volumen comprendido entre 10-20 microlitros de FeCl3 (0, 1M) /HCl (0, 01M) /KCl (0, 1M) y K3Fe (CN) 6 /HCl (0, 01M) /KCl (0, 1M) , respectivamente. Esta mezcla se deja aproximadamente 20 min como tiempo de reacción y posteriormente se retira todo el volumen. A continuación, se lava el electrodo con HCl (0, 01M) y se introduce en una estufa a una temperatura comprendida entre 90 y 120°C durante aproximadamente una hora. b) Deposición de una gota de 15-25 microlitros de una disolución compuesta de 260 microlitros de Lactato Oxidasa (6-10 U enzimáticas) y nanopartículas de oro 1, 5 mM aproximadamente. Esta disolución se deja secar a vacío a una presión de -200 mbar durante 2-3 horas. c) Deposición de una gota de 20-40 microlitros de quitosano 1% (m/V) en ácido cético (0, 1M) (pH en torno a 4.25-4.75) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. d) Deposición de una gota de 4-5 microlitros de cloruro de ponivinilo 1% (m/V) en tetrahidrofurano (99, 5%) . Esta gota se seca a temperatura ambiente. Se repite el proceso de una a tres veces más para obtener capas poliméricas adicionales. e) Deposición de una gota de 10-13 microlitros de Nafion 1% (m/V) en etanol con pH neutralizado mediante amoniaco (pH alrededor de 7-8) . Esta gota se seca mediante un rotor giratorio a al menos 1000 rpm. 2. La medición se realiza aplicando una corriente eléctrica necesaria para generar un potencial (E) entre 0.00 y +0.06 V, en el cual el Fe3+ de la superficie del azul de Prusia se reduce a Fe2+ el cual reacciona con el peróxido de hidrógeno producido en la reacción enzimática que convierte al lactato en piruvato. El peróxido de hidrógeno reoxida el Fe2+ a Fe3+ lo que resulta en una nueva corriente de electrones que reduce de nuevo el hierro en la superficie. El esquema de la reacción que se lleva a cabo, se muestra en la Figura 3. Por tanto, la corriente producida puede relacionarse con el peróxido de hidrógeno generado y, por ende, con el lactato nativo en la muestra. Ejemplo 2: Fabricación de sensor de pH a) Materiales y reactivos: Se utilizaron los siguientes reactivos para la fabricación del biosensor: • Transductor de C. • Solución de HCl y Anilina (Merck-Sigma Aldrich) • Polivinil Butiral (PVB) (Merck-Sigma Aldrich) . • Poliuretano (PU) (Merck-Sigma Aldrich) . b) Procedimiento de fabricación del sensor de pH: 1. Se parte de un transductor de C (previamente acondicionado mediante voltamperometría cíclica, 10 barridos de -0, 3 a 1, 1V en una disolución de 0, 5 M HCl) . A continuación, se procede a depositar la capa de polianilina de la siguiente manera: -Se realizan 12 barridos en voltamperometría cíclica en un rango de potencial entre -0, 2 y 1, 0 V en una disolución de 1 M HCl y 0, 1 M Anilina: Para mejorar la estabilidad de la medida de pH se modifica el electrodo de referencia on capas adicionales de polivinil butiral y poliuretano mediante: a) Deposición por gota de 2, 5L de una disolución PVB (74, 8 mg PVB, 50mg NaCl en 1mL metanol) . Esta capa se deja secar durante 1 hora y media al aire y se repite el proceso dos veces más. Al terminar se deja secar de nuevo todas las capas 12 horas. b) Deposición por gota de 2, 5L disolución PU (30mg PU en 1ml THF) . Esta capa se seca al aire durante 24 horas. 2. La medición se realiza registrando el potencial entre los electrodos de trabajo y de referencia a través del tiempo. El fundamento se basa en la modificación espontánea de fase de la polianilina según el pH de la disolución con la que se encuentra en contacto. Este cambio de fase va asociado con un cambio de potencial eléctrico que se puede monitorizar. Ejemplo 3: Fabricación de circuito impreso que incorpora los componentes electrónicos para la lectura adaptación y transmisión de señales. a) Materiales: Se emplearon los siguientes componentes para la fabricación del circuito impreso: • Microcontrolador de 32 bits y doble núcleo. • Alimentación del sistema basado en uno o varios reguladores LDO de 3.3V. • Sistema Bluetooth Low Energy (BLE) . • Sistema de adaptación de entrada de sensores formado por elementos semiconductores y elementos pasivos. • Tarjeta PCB de cuatro capas diseñada para ser inmune a los campos electromagnéticos. b) Procedimiento de fabricación de circuito impreso La principal función de este bloque es la adquisición de las señales que provienen de los sensores a través de los pines conectados a las microagujas. También se encarga de establecer el potencial necesario en cada pin para el correcto funcionamiento de los sensores electroquímicos. La primera etapa del acondicionamiento de la señal consiste en el filtrado de las señales de los diferentes sensores, para ello se dispone de filtros paso bajo antes de atacar a la etapa de amplificación de la señal. Para ello se dispone de amplificadores de transimpedancia de manera que la señal pueda ser eída por el siguiente bloque. El amplificador de transimpedancia convierte la señal en corriente a una señal en voltaje que se conecta directamente a la etapa del conversor analógico digital. Para establecer el potencial necesario en los pines del sensor, se dispone de un conversor Digital a Analógico de 12 bits conectados a los pines de referencia que estarán directamente conectados mediante las pistas del circuito impreso a los pines de conexión de las microagujas. Esta etapa dispone también de sensores de temperatura necesario para la calibración de las medidas. Conversor Analógico a Digital: Se dispone de un conversor Analógico a Digital tipo Sigma - Delta de 16 bits necesario para que la señal analógica pueda ser convertida a digital y ser tratada por el microcontrolador. Este conversor dispone de salida en formato SPI (Interfaz de comunicación Serie) que se conecta a la entrada del Microcontrolador Microcontrolador / Transceptor Bluetooth de baja energía: El microcontrolador, además de proporcionar las señales de control necesarias para el control de cada etapa anterior, recibe de la etapa de conversión analógico digital los datos de la lectura de los sensores. Esta etapa dispone también del transceptor Bluetooth de baja energía para transmisión de los datos de las medidas al dispositivo receptor y para la recepción de los diferentes comandos de configuración de los sensores. Bloque de Alimentación: El bloque de alimentación provee de energía a todo el sistema. Está compuesto por una pila de 3V tipo CR2032, así como reguladores LDO de baja caída de tensión y los filtros y componentes necesarios para su correcta polarización y reducción de rizado en las diferentes tensiones de alimentación. Esta arquitectura conforma un esquema electrónico que está diseñado en un circuito impreso donde se ensamblan también los elementos electromecánicos y la propia pila. Todos los componentes irán en una envolvente IP68, y será adherido al cuero cabelludo del neonato mediante un apósito adhesivo neutro. Debe entenderse que esta descripción no pretende limitarse a las realizaciones particulares descritas ya que pueden variar. Asimismo, debe entenderse que la terminología usada solo tiene la finalidad de describir formas de realización particulares y no pretende ser limitativa.
Publicaciones:
ES2959128 (20/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 22/07/2022 se realizó Registro Instancia de Solicitud
En fecha 26/07/2022 se realizó Admisión a Trámite
En fecha 26/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 27/07/2022 se realizó Superado examen de oficio
En fecha 01/06/2023 se realizó Realizado IET
En fecha 02/06/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 12/09/2023 se realizó PETEX_Petición de examen sustantivo
En fecha 20/02/2024 se realizó Publicación Solicitud
En fecha 20/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
22/07/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 29/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679
El registro de patente nacional por DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679 fue solicitada el 22/07/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679 fue solicitada por UNIVERSIDAD DE CÁDIZ. El registro [modality] por DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679 está clasificado como A61B 5/1482,A61B 5/1486 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes A61B 5/1482,A61B 5/1486.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679 está clasificado con la clasificación A61B 5/1482,A61B 5/1486 por lo que si se desea conocer más registros con la clasificación A61B 5/1482,A61B 5/1486 clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61
Es posible conocer todas las patentes registradas en la clase A61 (CIENCIAS MEDICAS O VETERINARIAS; HIGIENE) entre las que se encuentra la patente DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61B
Es posible conocer todas las patentes registradas en la clase A61B (DIAGNOSTICO; CIRUGIA; IDENTIFICACION) entre las que se encuentra la patente DISPOSITIVO MICROINVASIVO PARA LA MONITORIZACIÓN REMOTA, CONTINUA Y EN TIEMPO REAL DEL BIENESTAR FETAL INTRAPARTO con el número P202230679. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.


 P202230677
P202230677