- Home /
- Publicaciones de patentes /
- USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO
USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO
Patente nacional por "USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO"
Este registro ha sido solicitado por
Persona física
a través del representanteÁNGEL PONS ARIÑO
Contacto
- Estado: A punto de caducar
- País:
- España
- Fecha solicitud:
- 29/04/2022
- Número solicitud:
-
P202230395
- Número publicación:
-
ES2955613
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
Ángel Pons Ariño
- Clasificación Internacional de Patentes:
- C12N 7/02,C07J 1/00
- Clasificación Internacional de Patentes de la publicación:
- C12N 7/02,C07J 1/00
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2955613_A11. Uso del etinilestradiol para incrementar el crecimiento in vitro de un virus que comprende una envoltura lipídica. 2. Uso del etinilestradiol según la reivindicación 1 donde el virus además comprende al menos una proteína de fusión vírica de tipo I. 3. Uso del etinilestradiol según la reivindicación 1 o 2 donde el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. 4. Uso del etinilestradiol según la reivindicación 3 donde el virus es SARS-CoV-2, NiV o IAV. 5. Uso del etinilestradiol según cualquiera de las reivindicaciones 1 a 4 donde la concentración de etinilestradiol es de entre 0, 1 y 100^M. 6. Uso del etinilestradiol según la reivindicación 5 donde la concentración de etinilestradiol es de entre 5 y 55^M. 7. Un método para incrementar el crecimiento in vitro de un virus que comprende una envoltura lipídica, donde el método comprende: (i) infectar una célula o línea celular con dicho virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula, e (ii) incubar la célula o línea celular infectada de la etapa (i) en un medio de cultivo caracterizado porque comprende etinilestradiol a una temperatura entre 30 y 40 °C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. 8. El método según la reivindicación 7 donde la línea celular es Vero, A549, HEK 293T o MDCK. 9. El método según la reivindicación 8 donde la línea celular es Vero E6. 10. El método según cualquiera de las reivindicaciones 7 a 9 donde el virus además comprende al menos una proteína de fusión vírica de tipo I. 11. El método según la reivindicación 10 donde el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. 12. El método según la reivindicación 11 donde el virus es SARS-CoV-2, NiV o IAV. 13. El método según cualquiera de las reivindicaciones 7 a 12 donde la concentración de etinilestradiol es de entre 0, 1 y 100^M. 14. El método según la reivindicación 13 donde la concentración de etinilestradiol es de entre 5 y 55^M.
Los productos y servicios protegidos por este registro son:
C12N 7/02 - C07J 1/00
Descripciones:
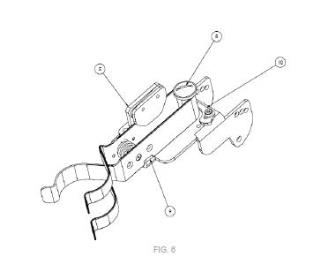
+ ES-2955613_A1 Uso in vitro del etinilestradiol para incrementar el crecimiento vírico La presente invención se refiere al uso in vitro del etinilestradiol para incrementar el crecimiento de virus con envoltura lipídica, particularmente del coronavirus tipo 2 causante del síndrome respiratorio agudo severo, virus Nipah y virus de la influenza A. ANTECEDENTES DE LA INVENCIÓN El genoma del coronavirus tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) codifica para 29 proteínas, entre las cuales, la proteína S (Spike protein en inglés) participa en el proceso de entrada del virus a la célula hospedadora. La proteína S, una glicoproteína de fusión de tipo I, es traducida en la célula infectada en una conformación no activa (S0) . La activación proteolítica de S0 por las proteasas celulares TMPRSS2 (localizadas en la superficie celular) y catepsina (proteína lisosomal) provocan la transformación de S0 a la forma madura (Wrapp D, et al 2020, Science; 367:1260-3) . El proceso de infección comienza con la unión de la forma madura de la proteína S a la proteína celular de la enzima convertidora de angiotensina 2 (Angiotensin-converting enzyme 2 o ACE2 en inglés) , la cual actúa como receptor en la superficie de la célula. La unión al receptor provoca un cambio conformacional que resulta en la exposición del péptido de fusión, el cual interaccionará con la membrana del huésped e iniciará la fusión de las membranas celulares y virales (Wang Q., et al, 2020, Cell; 181:894-904.e9) . Por tanto, para controlar la infección viral, es importante conocer todos los procesos que sufre la proteína S antes y durante la fusión de membranas. El SARS-CoV-2 ha tenido un enorme impacto en la salud, así como en la economía global, por lo que además de las vacunas es necesario el desarrollo de medidas, tanto profilácticas como terapéuticas, que reduzcan la mortalidad y morbilidad asociadas con la enfermedad COVID-19 y mejoren la atención sanitaria de aquellos enfermos que estén afectados por el virus. Para ello, es necesario la implementación de herramientas y técnicas in vitro que permitan fortalecer y acelerar los múltiples estudios del SARS-CoV-2, particularmente encontrar compuestos o fármacos que puedan incrementar y acelerar el crecimiento in vitro del SARS-CoV-2. Compuestos como el polibreno se emplean para mejorar infecciones de retrovirus al facilitar la adhesión de los viriones a la superficie de las células, ya que la adición de policationes cargados positivamente; tanto polibreno como DEAE-dextrano, sulfato de protamina, poli-l-lisina o liposomas catiónicos, reducen las fuerzas de repulsión entre la célula y el virus mejorando la eficiencia de transducción (Cometía K, Anderson WF. J Viro! Methods. 1989 Feb;23 (2) :187-94) . Sin embargo, no existen compuestos que mejoren la fusión de membranas en los procesos de infección de los virus con envuelta lipídica, como por ejemplo el SARS-CoV-2, y que incrementen y aceleren su crecimiento in vitro. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere al uso de un estrógeno derivado del estradiol, el etinilestradiol, para incrementar y acelerar el crecimiento vírico in vitro, particularmente del SARS-CoV-2, del virus Nipah (NIV) y del virus de la Influenza A (IAV) . Los inventores han demostrado que el etinilestradiol es capaz de mejorar la fusión de las membranas y, por tanto, aumentar la infección vírica e incrementar el crecimiento in vitro de SARS-CoV-2 (Figura 6) . Además, los inventores han demostrado que el uso del etinilestradiol también potencia el mecanismo de fusión celular del NIV (Figura 7) y el crecimiento del IAV (Figura 8) . Dichos virus no pertenecen a la misma familia viral, sin embargo, son virus con envuelta lipídica y presentan un mecanismo de infección y entrada en la célula huésped similar. Consecuentemente, el uso del etinilestradiol puede mejorar los rendimientos en la producción de estos virus y reducir los costes de producción asociados, por ejemplo, a la producción de vacunas. En un primer aspecto, la presente invención se refiere al uso del etinilestradiol para incrementar el crecimiento in vitro de virus que comprenden una envoltura lipídica, de aquí en adelante el "uso de la invención". El "etinilestradiol" o "17a-etinilestradiol" o "17-alfa-etiniM7-beta-estradiol", tal como se usa en la presente invención se refiere a un estrógeno derivado del estradiol, particularmente un estrógeno esteroídico sintético, con la formula química C20H24O2 y número CAS 57-63-6, usado comúnmente para el tratamiento del hipogonadismo femenino, para prevenir o reducir los síntomas asociados a la menopausia y, en combinación con gestágenos, forma parte de los anticonceptivos orales. El etinilestradiol del uso de la invención presenta la siguiente estructura química: En la presente invención, el etinilestradiol se usa para incrementar el crecimiento viral in vitro. La expresión "incrementar el crecimiento in vitro", tal como se usa en el presente documento, se refiere a aumentar, potenciar, incrementar o mejorar el crecimiento, la reproducción viral o el número de partículas virales producidas en el proceso de infección de un virus, así como fomentar o incrementar el porcentaje o rendimiento de la infección y acelerar el proceso de infección viral. Mediante el uso del etinilestradiol se incrementa el crecimiento in vitro de un virus, particularmente un virus que comprende una envoltura lipídica. Los términos "envoltura lipídica", "membrana lipídica", "membrana viral" o "envoltura vírica", usados indistintamente en la presente invención, se refieren a la membrana, envoltura, envuelta o bicapa lipídica que rodea la cápside vírica de algunos virus, tanto virus de animales, de plantas y bacteriófagos. Dicha envoltura lipídica comprende glucoproteínas o glicoproteínas que están codificadas en el genoma vírico y que ayudan al virus a entrar en la célula huésped mediante la identificación y unión a los receptores en la membrana de dicha célula huésped. Además, es conocido por el experto en la materia que la envoltura lipídica de los virus omprende proteínas de fusión que actúan como catalizadores. El término "proteína de fusión vírica" usado en la presente invención se refiere a una proteína o proteínas vírica/s, dispuestas en la envoltura o membrana vírica, implicadas en la fusión viruscélula con la célula huésped y en el mecanismo de infección vírico. Tras la unión de la glucoproteína o glicoproteína de la envoltura lipídica viral a los receptores de la célula huésped, las proteínas de fusión de la membrana viral experimentan un cambio en la conformación de su estructura. Este cambio en la conformación facilita la desestabilización y fusión de la envoltura vírica con la membrana de la célula diana, lo que le permite entrar a la cápside y al genoma vírico. Las proteínas de fusión de la membrana viral se seleccionan de cuatro clases diferentes, en donde cada clase o tipo se identifica por conformaciones estructurales característica, que consisten en: (1) clase o tipo I en donde la conformación posterior a la fusión tiene una estructura central en espiral compuesta de trímero característico de horquillas a-helicoidales, (2) clase o tipo II en donde la proteína tiene una estructura de ectodominio de hoja p alargada que se pliega para dar un trímero de horquillas, (3) clase o tipo III en donde la conformación es una combinación de características de las proteínas de fusión de membrana viral de clase I y clase II y (4) clase o tipo IV que son proteínas transmembrana pequeñas (FAST) asociadas a la fusión. Particularmente, los virus del uso de la invención comprenden una envoltura lipídica y además al menos una proteína de fusión vírica de clase o tipo I. Ejemplos de virus que comprenden envoltura lipídica, y preferiblemente al menos una proteína de fusión de clase o tipo I, incluyen las familias, sin limitar, Coronaviridae, Filoviridae, Arenaviridae, Orthomyxoviridae, Retroviridae o Paramyxoviridae. En una realización preferida del uso de la invención, los virus pertenecen a las familias Coronaviridae, Paramyxoviridae o Orthomyxoviridae. En otra realización preferida el virus que pertenece a la familia de Coronaviridae es SARS-CoV-2, el coronavirus causante del síndrome respiratorio agudo severo (SARS-CoV) , el coronavirus causante del síndrome respiratorio de oriente medio (MERS) o los coronavirus causantes del resfriado común 229E, NL63, OC43 y HKU1. En otra realización preferida el virus que pertenece a la familia de Paramyxoviridae es l virus Nipah (NIV) , el virus Hendra (HeV) , el virus Cedar (CedV) o el virus causante del crup (laringotraqueobronquitis) . En otra realización preferida el virus que pertenece a la familia de Orthomyxovirídae es el virus de la Influenza A (IAV) , el virus de la influenza B (IBV) , influenza C (ICV) , influenza D (IDV) o los Thogotovirus. Como se ha descrito anteriormente, el virus relativo al uso de la invención comprende una envoltura lipídica y, además, al menos una proteína de fusión vírica de clase o tipo I. Ejemplos de proteínas de fusión de clase o tipo I incluyen, sin limitar, a la proteína S de coronavirus, la proteína F del NIV, la proteína Env del virus de inmunodeficiencia humana, la proteína HA del IAV, la proteína GP del Ébola y la proteína GP del virus Lassa. Los inventores de la presente invención han aplicado el etinilestradiol a diferentes concentraciones incrementando el crecimiento vírico in vitro, particularmente de virus que comprenden envoltura lipídica. Es práctica de rutina para el experto en la materia calcular la concentración de etinilestradiol, sin superar los límites o cantidades a las que el etinilestradiol pueda ser tóxico, teniendo en cuenta tanto las características del virus como la tolerancia de la línea celular en la que este crezca. En otra realización preferida relativa al uso de la invención, la concentración de etinilestradiol es 0, 1 a 100^M. En otra realización más preferida del uso de la invención, la concentración de etinilestradiol es entre 1 a 60^M, preferiblemente es entre 5 y 55^M. En otra realización más preferida, la concentración de etinilestradiol es 10^M, 15^M, 20^M, 25^M, 30^M, 35^M, 40^M, 45^M o 50^M. Mediante la administración de etinilestradiol, los inventores han conseguido incrementar el crecimiento vírico in vitro, particularmente de virus que comprenden envoltura lipídica. Así, un segundo aspecto de la presente invención se refiere a un método para incrementar el crecimiento in vitro de un virus que comprende una envuelta lipídica, de aquí en adelante el "método de la invención", donde el método comprende: (i) infectar una célula o línea celular con dicho virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula, e (ii) incubar la célula o línea celular infectada de la etapa (i) en un medio de cultivo que comprende etinilestradiol a una temperatura entre 30 y 40 °C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. Los términos o expresiones "etinilestradiol", "incrementar el crecimiento in vitro" y "envoltura lipídica" han sido descritos previamente en otros aspectos de la invención y aplican de igual modo a este aspecto inventivo, así como a todas sus realizaciones preferidas. El término "línea celular" tal como se usan en la presente invención, se refieren a células o una población de células de un único tipo de un organismo multicelular (humano, animal o vegetal) que normalmente no proliferaría indefinidamente pero que se han adaptado para crecer continuamente (indefinidamente) y evadir la senescencia celular que permiten ser cultivadas in vitro durante periodos prolongados. Es práctica de rutina para un experto en la materia elegir el tipo de línea celular dependiendo del virus en crecimiento. Ejemplos de líneas celulares incluyen, sin limitar a, Vero, HeLa, HEK 293T, MDCK, A549, Caco, HCT116, Huh7, Phoenix-Ampho, C6/36, SF268, RD, BHK-21 CEFo DF-1. En una realización preferida del método de la invención, la línea celular es Vero, A549, HEK 293T o MDCK, así como todas las variantes de dichas lineas celulares. En otra realización preferida del método de la invención, la línea celular Vero es la línea celular Vero E6. Particularmente, en la etapa (i) del método de la invención se infecta la célula o línea celular con un virus que comprende una envoltura lipídica, preferiblemente coronavirus. Así, en otra realización preferida del método de la invención el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. En otra realización más preferida del método de la invención el virus es SARS-CoV-2, NIV o IAV. Particularmente, en la etapa (i) del método de la invención se infecta la célula o línea celular con el virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula. El término "multiplicidad de infección" o "MOI (en inglés Multiplicity Of Infection) " es la relación entre los agentes infecciosos (por ejemplo, fagos o, más generalmente, virus o bacterias) y los objetivos de la infección (por ejemplo, células) . Al referirse a un grupo de células inoculadas con partículas de virus, la multiplicidad de infección o MOI es la relación entre el número de partículas de virus y el número de células diana presentes en un espacio definido. El término "pfu (en inglés, plaque-forming unit) " o "unidad formadora de placas" se refiere a la medida utilizada en virología para describir el número de partículas de virus capaces de formar placas por unidad de volumen. En otra realización preferida del método de la invención, se infecta la célula o línea celular con el virus a una multiplicidad de infección (MOI) de entre 0, 001 a 0, 1 pfu/célula, más preferiblemente es 0, 01pfu/célula. Tal como sabe el experto en la materia, las condiciones de cultivo de la etapa (ii) del método dependerá del virus y tipo celular infectado. Particularmente, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo que comprende etinilestradiol a una temperatura entre 30 y 40°C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. En otra realización preferida del método de la invención, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo que comprende etinilestradiol a una temperatura entre 32 y 38°C, preferiblemente a una temperatura de 33°C, 34°C, 35°C, 36°C o 37°C, más preferiblemente a 37°C. En otra realización más preferida del método de la invención, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo con un porcentaje (%) de CO2 de entre un 3 a 7%, más preferiblemente con 4%, 5% o 6 % de CO2. En otra realización más preferida del método de la invención, la línea celular infectada e la etapa (i) se incubará durante entre 20 a 50 horas, preferiblemente a 24 o 48 horas. Tal como se ha descrito anteriormente, los inventores han aplicado el etinilestradiol a diferentes concentraciones incrementando el crecimiento vírico in vitro. Así, en otra realización preferida del método de la invención, la concentración de etinilestradiol es 0, 1 a 100 j M . En otra realización más preferida del método de la invención, la concentración de etinilestradiol es entre 1 a 60 |jM, preferiblemente es entre 5 y 55 j M . En otra realización más preferida, la concentración de etinilestradiol es 10 j M, 15 j M, 2 0 j M, 25 j M, 30 j M, 35 j M, 4 0 j M, 4 5 j M o 50 j M . DESCRIPCIÓN DE LAS FIGURAS Figura 1. Representación esquemática del ensayo BiMuC. A) Representación de la reconstitución de VFP dividida. Cuando se fusiona con dos proteínas que interactúan, como c-Jun y c-Fos, los dos fragmentos de una VFP (VN N-terminal, y VC C-terminal) pueden reconstituir la estructura de la proteína nativa y sus propiedades fluorescentes. B) El ensayo BiMuC se basa en las propiedades de complementación bimolecular de la fluorescencia de la proteína fluorescente Venus (VFP) . Figura 2. Ensayo BiMuC de SARS-CoV-2. Gráfico de barras que muestra las Unidades de Fluorescencia Relativa (RFU) 48 horas después de que se mezclaron los grupos de células transfectadas con Jun-S, Jun-ACE2, Jun-Fos, Jun, S, Fos-ACE2, Fos-S, plásmido vacío (empty) , Fos o ACE2. Figura 3. Ensayo de fusión viral y toxicidad del etinilestradiol. A) La fusión de membranas provocada por la proteína S fue testada en presencia de etinilestradiol a 6, 25, 12, 5 y 25 ^M tras 48 horas de tratamiento con el compuesto. Los resultados obtenidos en ausencia de etinilestradiol (línea de puntos) se emplearon para normalizar los resultados (100%) . B) Análisis de la toxicidad del compuesto a 6, 25, 12, 5 y 25 ^M (% de viabilidad) . En ambos casos se muestra la media y desviación típica de tres experimentos independientes. Figura 4. Efecto del etinilestradiol sobre la fusión de membranas de la proteína S del SARS-CoV-2 empleando la técnica de BiMuC. Se emplearon diferentes concentraciones del compuesto (6, 25, 12, 5, 25 y 50 ^M) y su actividad fue testada tras 24, 48 y 72 horas. Los resultados muestran la media de tres experimentos. Medias relativizadas al tratamiento exclusivamente con solvente (100%, línea de puntos) . Figura 5. Toxicidad asociada al etinilestradiol en células Vero E6. La viabilidad celular en presencia de etinilestradiol fue testada a 24, 48 y 72 horas tras el tratamiento a 1, 10, 100 y 1000 ^M. Se muestra la media de tres experimentos independientes. Figura 6. Análisis del efecto del etinilestradiol sobre el crecimiento SARS-CoV-2. Se trataron células Vero-E6 con etinilestradiol a 1 ^M y 10 ^M seguido de la infección con SARS-CoV-2. La carga viral se midió 48h después de la infección. El gráfico de barras representa la media y desviación estándar del porcentaje de infección sobre las muestras tratadas con exclusivamente con vehículo (100%) de tres experimentos independientes. Figura 7. Efecto del etinilestradiol a 12, 5 ^M, 25 ^M y 50 ^M en la fusión inducida por las proteínas F y G de Nipah. Se muestra la media y desviación típica de tres experimentos independientes. Figura 8. Análisis del efecto del etinilestradiol sobre el crecimiento del IAV. Células MDCks fueron infectadas con el IAV a una multiplicidad de infección baja. A continuación, las células fueron tratadas con etinilestradiol a las concentraciones indicadas 3, 125^M, 6, 25^M, 12^M y 25^M La carga viral se midió 48h después de la infección empleando un ensayo se TCID50 (del inglés, Tissue Culture Infection Dose 50%) . El gráfico de barras representa la media y desviación de tres experimentos independientes. EJEMPLOS MATERIALES Y MÉTODOS Plásmidos y líneas celulares Las células HEK 293T se obtuvieron del "American Type Culture Collection o ATCC (número de depósito CRL-11268) " y se mantuvieron en medio Eagle modificado de Dulbecco (DMEM) (Gibco) suplementado con suero bovino fetal al 10% (FBS, Gibco) . El plásmido SARS-CoV-2:S fue obtenido del "Icahn School of Medicine at Mount Sinai, Nueva York. Este plásmido incluye la secuencia S de longitud completa en el plásmido (vector) pCAGGS. Los plásmidos que expresan las proteínas: Jun fusionada al extremo Nt de la proteína de la fluorescencia Venus (Jun-Nt VFP) , la Fos fusionada al extremo Ct de la proteína de fluorescencia Venus (Fos-Ct VFP) así como ACE2 humano, se obtuvieron de Addgene (referencias: n° 22012, n° 22013 y n° 1786, respectivamente) . Los plásmidos de luciferasa Jun-Nt y luciferasa Fos-Ct se obtuvieron como se describió en García-Murria M.J., et al 2019, Viruses; 11 (3) :229. Ensayo de fusión célula-célula Para el ensayo de fusión célula-célula, los inventores sembraron células HEK 293T en placas de 24 pocillos (2x106 células/placa) el día 1 en medio DMEM suplementado con FBS al 10%. Después de 24 horas (día 2) , las células fueron transfectadas, usando polietilenimina (PEI) como reactivo de transfección, con Jun-Nt, Fos-Ct, SARS-CoV-2:S, ACE2 humano y pRL Renilla Luciferase (Promega) (usando las combinaciones de plásmidos indicadas) o simuladas de transfección (controles negativos) . El día 3, las células se contaron, se mezclaron y se sembraron en placa de 24 pocillos (1x105 células/pocillo en 500^L de medio) o en placas de 96 pocillos (3x104 células/pocillo en 100 ^L de medio) . El día 5, se midió la fluorescencia en placas de 96 pocillos mediante un lector de placas Victor X (PerkinElmer) con agitación y empleando los filtros de 485nm y 535nm. Cuando se usaron las placas de 24 pocillos, las células se recogieron y se transfirieron a una placa negra de 96 pocillos antes de la medición de la fluorescencia. Cada experimento se realizó tres veces y por triplicado. Infección con SARS-CoV-2 Las infecciones con SARS-CoV-2 se realizaron en células Vero E6 (ATCC-CRL/1586) a una multiplicidad de infección baja (0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 tras la infección, se recogieron los sobrenadantes, se colocaron en tubos sellados y se aclararon mediante centrifugación durante 10 minutos a 2000rpm en una centrífuga Eppendorf 5810 refrigerada. El stock de virus se almacenó a -80°C para su conservación. Las células Vero E6 se mantuvieron de forma rutinaria en medio de cultivo Eagle modificado de Dulbecco (DMEM) (Biowest) que contenía suplementos: suero bovino fetal al 5%, glutamina 2mM, penicilina 100U/mL y estreptomicina 100^g/mL. Los matraces de células se incubaron de forma rutinaria a 37°C en una atmósfera de 5% de CO2. El título de SARS-CoV-2 se determinó en células Vero-E6 mediante ensayo de placa. Las muestras se sometieron a diluciones seriadas de 3 o 10 veces y se agregaron a cada pocillo. Después de 1h de adsorción del inóculo a 37°C, las células se lavaron con medio DMEM y se añadió a cada pocillo una mezcla semisólida de carboximetilcelulosa (CMC) al 1% en DMEM suplementado con suero. Tras el período de incubación de 3 días después de la infección, se examinaron los pocillos para detectar la presencia de placas de lisis inducidas por virus. Las células se fijaron durante la noche con una solución de formaldehído al 10%, se eliminó el medio semisólido y los cultivos fijados se tiñeron adicionalmente durante 10 minutos con una solución filtrada de violeta cristal al 2%. Después de lavar la solución de tinción, se contaron en aquellas diluciones que mostraban más de 30 placas de lisis. El título se estimó mediante la siguiente fórmula: (número de placas * factor de dilución de la muestra) / volumen de la muestra (en mL) . Todos los procedimientos de cultivo de SARS-CoV-2 se llevaron a cabo en un laboratorio de nivel 3 de bioseguridad mejorado (BSL3+) y todo el personal usó respiradores purificadores de aire motorizados (3M) incorporados en los trajes Prochem. La manipulación de virus infecciosos vivos se completó dentro de una cabina de bioseguridad de clase II. Infección con IAV En los ensayos de infección con el virus de la influenza o gripe A (IAV) se empleó la cepa WSN en células MDCK del inglés "Madin-Darby Canine Kidney cells" (https://www.atcc.org/products/ccl-34) a una multiplicidad de infección baja (0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes, se colocaron en tubos sellados y se aclararon mediante centrifugación durante 10 minutos a 2000rpm en una centrífuga Eppendorf 5810 refrigerada. El stock de virus se almacenó a -80°C para su conservación. Las células MDCK se mantuvieron de forma rutinaria en medio de cultivo Eagle modificado de Dulbecco (DMEM) (Biowest) que contenía suplementos: suero bovino fetal al 5%, glutamina 2mM, penicilina 100U/mL y estreptomicina 100^g/mL. Los matraces de células se incubaron de forma rutinaria a 37°C en una atmósfera de 5% de CO2. El título de IAV se determinó en células MDCK mediante un ensayo de TCID50. Las muestras se sometieron a diluciones seriadas y se emplearon para infectar células en placas de 96 pocillos. Tras el período de incubación de 3 días después de la infección, se examinaron los pocillos. La presencia de virus en cada uno de ellos se puede detectar por la ausencia de células debido al efecto citopático del virus. La no infección provoca la aparición de una monocapa de células. Las células se fijaron con formaldehído al 4% (20min) , y se tiñeron adicionalmente durante 20 minutos con una solución filtrada de violeta cristal al 1%. Después de lavar la solución de tinción, se contaron en aquellas diluciones que mostraban efecto citopático. El título se estimó mediante el método de Reed y Muench (LJ, MUENCH H. American Journal of Epidemiology. 1938 May 1;27 (3) :493-7) . Todos los procedimientos de cultivo de IAV se llevaron a cabo en un laboratorio de nivel 2 de bioseguridad. RESULTADOS El ensayo BiMuC se basa en las propiedades de complementación de algunas enzimas y proteínas fluorescentes como la proteína fluorescente Venus (VFP) . La VFP se puede dividir en dos fragmentos (VN y VC respectivamente) , ninguno de los cuales es fluorescente por sí mismo. Sin embargo, cuando estos dos fragmentos se fusionan con un par de proteínas que interactúan las dos mitades de la VFP se aproximan, reconstituyéndose la estructura nativa de la VFP y recuperándose sus propiedades fluorescentes (Figura 1A) . Para analizar y cuantificar la capacidad fusogénica de la proteína SARS-CoV-2:S, las proteínas c-Jun y c-Fos, las cuales son capaces de interaccionar entre sí, se fusionaron con los fragmentos VN y VC de la VFP, generando las quimeras c-Jun/VN y c-Fos/VC. Estas quimeras (de ahora en adelante serán presentadas como Jun y Fos respectivamente) se expresaron en dos grupos de células independientes junto con la proteína S o ACE2 (es decir, Jun-S, Jun-ACE2, Fos-S y Fos-ACE2) (Figura 1B) . Estos ultivos celulares se transfectaron por separado con plásmidos (vectores) que codifican SARS CoV-2:S, ACE2 humana, Jun, Fos, Jun y Fos simultáneamente (Jun-Fos) o un plásmido vacío. Tras 24 horas, las células se lavaron y combinaron en 5 grupos: Jun-S + Fos-ACE2, Jun-ACE2 + Fos-S, Jun-Fos + Plásmido vacío (empty) , Jun + Fos y S + ACE2 (Figura 2) y se incubaron durante 48 horas adicionales. Las muestras que contenían las poblaciones de células transfectadas con Jun-S + Fos-ACE2 y Jun-ACE2 + Fos-S mostraron una fluorescencia comparable a la del grupo Jun-Fos + Plásmido vacío (control positivo) . Por el contrario, el grupo Jun + Fos (donde los componentes para reconstituir el VFP y su fluorescencia se expresan en células separadas) y el grupo S + ACE2 (que contiene las proteínas necesarias para la formación de sincitios pero no para la reconstitución de VFP) no mostraron ninguna fluorescencia (Figura 2) . Estos resultados muestran la interacción entre las proteínas SARS-CoV-2:S y ACE2 humana y la posterior fusión de membranas que induce esta interacción. Es de destacar que la inhibición de cualquiera de los procesos celulares o virales que conducen a la fusión de la membrana, desde la síntesis y maduración de la proteína S hasta su interacción con ACE2, dará como resultado la ausencia de la señal fluorescente. Además, debe tenerse en cuenta que este ensayo se basa en células HEK 293T, que expresan niveles bajos de ACE2. El uso de una línea celular con niveles suficientes de ACE2 eliminará la necesidad de complementar esta proteína en trans (transfectada) . A continuación, se probó el efecto del etinilestradiol sobre la fusión de membrana inducida por la proteína SARS-CoV-2:S tanto en presencia como en ausencia de la proteasa activadora TMPRSS2. Para ello se co-transfectó junto a los plásmidos indicados para realizar el ensayo de BiMuC previamente descrito un plásmido con la secuencia que codifica para TMPRSS2 o un plásmido vacío en las células HEK-293T. A las 24 horas tras la transfección, las células fueron lavadas y mezcladas para llevar a cabo el ensayo de fusión BiMuC. A continuación, se añadió etinilestradiol (concentración final igual a 6, 25, 12.5 y 25 ^M) o solvente (DMSO, concentración final 1%) . Tras 48 horas a 37°C y una concentración de CO2 del 5%, se midió la fluorescencia de la proteína Venus como marcador de la fusión de membranas (Figura 3A) . Los resultados muestran un aumento en el porcentaje de fusión en las muestras tratadas con etinilestradiol (concentraciones superiores a 6, 25 |jM) en comparación con las muestras tratadas con solvente (indicado con una línea de puntos en la Figura 3) . Este aumento e la actividad, cercano al 200% en comparación con las muestras sin compuesto, se observó tanto en presencia como en ausencia de TMPRSS2. En paralelo la toxicidad del compuesto se midió incubando células HEK-293T con etinilestradiol (concentración final de etinilestradiol igual a 6, 25, 12.5 y 25 ^M en DMSO al 1%) o con solvente (DMSO, concentración final 1%) durante 48 horas a 37°C y una concentración de CO2 del 5% (Figura 3B) . A continuación, la viabilidad de las células se midió empleando el kit CellTiter-Glo de Promega siguiendo las indicaciones del fabricante. Adicionalmente, el etinilestradiol demostró ser activo (medidas realizadas con la técnica de BiMuC) con periodos de incubación es de 24, 48 o 72 horas (Figura 4) . Posteriormente, para comprobar con precisión el efecto del etinilestradiol sobre la fusión de las membranas viral y celular que se produce durante una infección, se analizó el crecimiento viral del SARS-CoV-2 en presencia y ausencia de este compuesto. Dado que el SARS-CoV-2 generalmente se cultiva en células Vero E6 y que se monitoriza el crecimiento a diferentes tiempos tras la inoculación del virus, se analizó, antes de los ensayos de infección, la toxicidad del etinilestradiol después de 24, 48 y 72 horas de tratamiento en células Vero E6 (Figura 4) . El etinilestradiol demostró no ser toxico (viabilidad por encima del 90%, CC90) a concentraciones por debajo de 20j M tras 24 y 48 horas de incubación (Figura 5) . Tras 72 horas de incubación se observó una CC90 cercana a 10j M (Figura 5) . Una vez analizada la toxicidad en células Vero E6 y confirmada la efectividad a múltiples tiempos de incubación se procedió a la realización de las infecciones en cultivos celulares en presencia de etinilestradiol a concentraciones no tóxicas (<10j M) , particularmente a 1 y a 10 |jM. Las infecciones con SARS-CoV-2 se realizaron en células Vero E6 (MOI: 0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes. Los títulos virales de estas muestras se determinaron en células Vero-E6 mediante ensayo de placa. El resultado de las infecciones de células Vero E6 confirman que el etinilestradiol potencia el crecimiento del SARS-CoV-2 (Figura 6) alcanzándose rendimientos del 180% en comparación con las células no tratadas con el compuesto (valor representado n la figura con una línea punteada) . Además, también se ha medido el efecto del etinilestradiol en la fusión de membranas inducida por otros virus con envuelta lipídica altamente patógenos como el virus Nipah utilizando el enfoque BiMuC adaptado para este virus (Figura 7) . Brevemente, dos grupos de células fueron transfectados con VN, Nipah F y Nipah G y VC respectivamente. Tras 24h ambos grupos se juntaron y las células fueron tratadas con etinilestradiol (concentración final de 12, 5, 25 o 50 ^M) . Como control una alícuota de las células fue tratada exclusivamente con el solvente (100% de fusión, indicado en la figura 7 con una línea de puntos) . Tras 48 horas de incubación se analizó la fluorescencia. Los resultados obtenidos indican que el etinilestradiol potencia la fusión de membranas biológicas iniciada por la proteína de fusión (F) y la proteína de unión (G) del virus NiV. En este caso se alcanza una señal cercana al 150%, respecto a la fusión obtenida en ausencia de compuesto. Además, podemos ver una relación directa entre la cantidad de etinilestradiol y la cantidad de fusión viral observada. Los virus NiV y SARS-CoV-2 no pertenecen a la misma familia viral, pero comparten un mecanismo común para mejorar la fusión célula-célula, tanto NiV:F como SARS-CoV-2:S son proteínas de fusión de tipo I. Por tanto, se demuestra que el etinilestradiol favorece la entrada de cualquier virus con envuelta lipídica mediante un mecanismo de fusión similar y, por tanto, que el etinilestradiol puede incrementar su el crecimiento in vitro. Además, también se ha medido el efecto del etinilestradiol sobre el crecimiento del IAV. Pare ello se procedió a la realización de las infecciones en cultivos celulares en presencia de etinilestradiol (Figura 8) . Las infecciones con IAV se realizaron en células MDCK (aproximadamente a una MOI: 0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes. Los títulos virales de estas muestras se determinaron en células MDCK mediante ensayo de TCID50. El resultado de las infecciones el IAV confirman el efecto del etinilestradiol sobre la capacidad infectiva de los virus con envuelta lipídica.
Publicaciones:
ES2955613 (04/12/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 29/04/2022 se realizó Registro Instancia de Solicitud
En fecha 29/04/2022 se realizó Admisión a Trámite
En fecha 29/04/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 11/05/2022 se realizó Suspenso en examen de oficio
En fecha 11/05/2022 se realizó 6101P_Notificación defectos en examen de oficio
En fecha 18/05/2022 se realizó Publicación Defectos en examen de oficio
En fecha 15/07/2022 se realizó 3007_Registro contestación al suspenso en examen de oficio
En fecha 15/07/2022 se realizó Superado examen de oficio
En fecha 24/02/2023 se realizó Realizado IET
En fecha 24/02/2023 se realizó Falta Unidad de Invención en Opinión Escrita
En fecha 28/02/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 06/03/2023 se realizó Publicación Falta unidad de Invencion
En fecha 04/12/2023 se realizó Publicación Solicitud
En fecha 04/12/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 28/02/2024 se realizó PETEX_Petición de examen sustantivo
En fecha 19/03/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
29/04/2022 - Pago Tasas IET
+ ES-2955613_A11. Uso del etinilestradiol para incrementar el crecimiento in vitro de un virus que comprende una envoltura lipídica. 2. Uso del etinilestradiol según la reivindicación 1 donde el virus además comprende al menos una proteína de fusión vírica de tipo I. 3. Uso del etinilestradiol según la reivindicación 1 o 2 donde el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. 4. Uso del etinilestradiol según la reivindicación 3 donde el virus es SARS-CoV-2, NiV o IAV. 5. Uso del etinilestradiol según cualquiera de las reivindicaciones 1 a 4 donde la concentración de etinilestradiol es de entre 0, 1 y 100^M. 6. Uso del etinilestradiol según la reivindicación 5 donde la concentración de etinilestradiol es de entre 5 y 55^M. 7. Un método para incrementar el crecimiento in vitro de un virus que comprende una envoltura lipídica, donde el método comprende: (i) infectar una célula o línea celular con dicho virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula, e (ii) incubar la célula o línea celular infectada de la etapa (i) en un medio de cultivo caracterizado porque comprende etinilestradiol a una temperatura entre 30 y 40 °C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. 8. El método según la reivindicación 7 donde la línea celular es Vero, A549, HEK 293T o MDCK. 9. El método según la reivindicación 8 donde la línea celular es Vero E6. 10. El método según cualquiera de las reivindicaciones 7 a 9 donde el virus además comprende al menos una proteína de fusión vírica de tipo I. 11. El método según la reivindicación 10 donde el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. 12. El método según la reivindicación 11 donde el virus es SARS-CoV-2, NiV o IAV. 13. El método según cualquiera de las reivindicaciones 7 a 12 donde la concentración de etinilestradiol es de entre 0, 1 y 100^M. 14. El método según la reivindicación 13 donde la concentración de etinilestradiol es de entre 5 y 55^M.
Los productos y servicios protegidos por este registro son:
C12N 7/02 - C07J 1/00
Descripciones:
+ ES-2955613_A1 Uso in vitro del etinilestradiol para incrementar el crecimiento vírico La presente invención se refiere al uso in vitro del etinilestradiol para incrementar el crecimiento de virus con envoltura lipídica, particularmente del coronavirus tipo 2 causante del síndrome respiratorio agudo severo, virus Nipah y virus de la influenza A. ANTECEDENTES DE LA INVENCIÓN El genoma del coronavirus tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) codifica para 29 proteínas, entre las cuales, la proteína S (Spike protein en inglés) participa en el proceso de entrada del virus a la célula hospedadora. La proteína S, una glicoproteína de fusión de tipo I, es traducida en la célula infectada en una conformación no activa (S0) . La activación proteolítica de S0 por las proteasas celulares TMPRSS2 (localizadas en la superficie celular) y catepsina (proteína lisosomal) provocan la transformación de S0 a la forma madura (Wrapp D, et al 2020, Science; 367:1260-3) . El proceso de infección comienza con la unión de la forma madura de la proteína S a la proteína celular de la enzima convertidora de angiotensina 2 (Angiotensin-converting enzyme 2 o ACE2 en inglés) , la cual actúa como receptor en la superficie de la célula. La unión al receptor provoca un cambio conformacional que resulta en la exposición del péptido de fusión, el cual interaccionará con la membrana del huésped e iniciará la fusión de las membranas celulares y virales (Wang Q., et al, 2020, Cell; 181:894-904.e9) . Por tanto, para controlar la infección viral, es importante conocer todos los procesos que sufre la proteína S antes y durante la fusión de membranas. El SARS-CoV-2 ha tenido un enorme impacto en la salud, así como en la economía global, por lo que además de las vacunas es necesario el desarrollo de medidas, tanto profilácticas como terapéuticas, que reduzcan la mortalidad y morbilidad asociadas con la enfermedad COVID-19 y mejoren la atención sanitaria de aquellos enfermos que estén afectados por el virus. Para ello, es necesario la implementación de herramientas y técnicas in vitro que permitan fortalecer y acelerar los múltiples estudios del SARS-CoV-2, particularmente encontrar compuestos o fármacos que puedan incrementar y acelerar el crecimiento in vitro del SARS-CoV-2. Compuestos como el polibreno se emplean para mejorar infecciones de retrovirus al facilitar la adhesión de los viriones a la superficie de las células, ya que la adición de policationes cargados positivamente; tanto polibreno como DEAE-dextrano, sulfato de protamina, poli-l-lisina o liposomas catiónicos, reducen las fuerzas de repulsión entre la célula y el virus mejorando la eficiencia de transducción (Cometía K, Anderson WF. J Viro! Methods. 1989 Feb;23 (2) :187-94) . Sin embargo, no existen compuestos que mejoren la fusión de membranas en los procesos de infección de los virus con envuelta lipídica, como por ejemplo el SARS-CoV-2, y que incrementen y aceleren su crecimiento in vitro. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere al uso de un estrógeno derivado del estradiol, el etinilestradiol, para incrementar y acelerar el crecimiento vírico in vitro, particularmente del SARS-CoV-2, del virus Nipah (NIV) y del virus de la Influenza A (IAV) . Los inventores han demostrado que el etinilestradiol es capaz de mejorar la fusión de las membranas y, por tanto, aumentar la infección vírica e incrementar el crecimiento in vitro de SARS-CoV-2 (Figura 6) . Además, los inventores han demostrado que el uso del etinilestradiol también potencia el mecanismo de fusión celular del NIV (Figura 7) y el crecimiento del IAV (Figura 8) . Dichos virus no pertenecen a la misma familia viral, sin embargo, son virus con envuelta lipídica y presentan un mecanismo de infección y entrada en la célula huésped similar. Consecuentemente, el uso del etinilestradiol puede mejorar los rendimientos en la producción de estos virus y reducir los costes de producción asociados, por ejemplo, a la producción de vacunas. En un primer aspecto, la presente invención se refiere al uso del etinilestradiol para incrementar el crecimiento in vitro de virus que comprenden una envoltura lipídica, de aquí en adelante el "uso de la invención". El "etinilestradiol" o "17a-etinilestradiol" o "17-alfa-etiniM7-beta-estradiol", tal como se usa en la presente invención se refiere a un estrógeno derivado del estradiol, particularmente un estrógeno esteroídico sintético, con la formula química C20H24O2 y número CAS 57-63-6, usado comúnmente para el tratamiento del hipogonadismo femenino, para prevenir o reducir los síntomas asociados a la menopausia y, en combinación con gestágenos, forma parte de los anticonceptivos orales. El etinilestradiol del uso de la invención presenta la siguiente estructura química: En la presente invención, el etinilestradiol se usa para incrementar el crecimiento viral in vitro. La expresión "incrementar el crecimiento in vitro", tal como se usa en el presente documento, se refiere a aumentar, potenciar, incrementar o mejorar el crecimiento, la reproducción viral o el número de partículas virales producidas en el proceso de infección de un virus, así como fomentar o incrementar el porcentaje o rendimiento de la infección y acelerar el proceso de infección viral. Mediante el uso del etinilestradiol se incrementa el crecimiento in vitro de un virus, particularmente un virus que comprende una envoltura lipídica. Los términos "envoltura lipídica", "membrana lipídica", "membrana viral" o "envoltura vírica", usados indistintamente en la presente invención, se refieren a la membrana, envoltura, envuelta o bicapa lipídica que rodea la cápside vírica de algunos virus, tanto virus de animales, de plantas y bacteriófagos. Dicha envoltura lipídica comprende glucoproteínas o glicoproteínas que están codificadas en el genoma vírico y que ayudan al virus a entrar en la célula huésped mediante la identificación y unión a los receptores en la membrana de dicha célula huésped. Además, es conocido por el experto en la materia que la envoltura lipídica de los virus omprende proteínas de fusión que actúan como catalizadores. El término "proteína de fusión vírica" usado en la presente invención se refiere a una proteína o proteínas vírica/s, dispuestas en la envoltura o membrana vírica, implicadas en la fusión viruscélula con la célula huésped y en el mecanismo de infección vírico. Tras la unión de la glucoproteína o glicoproteína de la envoltura lipídica viral a los receptores de la célula huésped, las proteínas de fusión de la membrana viral experimentan un cambio en la conformación de su estructura. Este cambio en la conformación facilita la desestabilización y fusión de la envoltura vírica con la membrana de la célula diana, lo que le permite entrar a la cápside y al genoma vírico. Las proteínas de fusión de la membrana viral se seleccionan de cuatro clases diferentes, en donde cada clase o tipo se identifica por conformaciones estructurales característica, que consisten en: (1) clase o tipo I en donde la conformación posterior a la fusión tiene una estructura central en espiral compuesta de trímero característico de horquillas a-helicoidales, (2) clase o tipo II en donde la proteína tiene una estructura de ectodominio de hoja p alargada que se pliega para dar un trímero de horquillas, (3) clase o tipo III en donde la conformación es una combinación de características de las proteínas de fusión de membrana viral de clase I y clase II y (4) clase o tipo IV que son proteínas transmembrana pequeñas (FAST) asociadas a la fusión. Particularmente, los virus del uso de la invención comprenden una envoltura lipídica y además al menos una proteína de fusión vírica de clase o tipo I. Ejemplos de virus que comprenden envoltura lipídica, y preferiblemente al menos una proteína de fusión de clase o tipo I, incluyen las familias, sin limitar, Coronaviridae, Filoviridae, Arenaviridae, Orthomyxoviridae, Retroviridae o Paramyxoviridae. En una realización preferida del uso de la invención, los virus pertenecen a las familias Coronaviridae, Paramyxoviridae o Orthomyxoviridae. En otra realización preferida el virus que pertenece a la familia de Coronaviridae es SARS-CoV-2, el coronavirus causante del síndrome respiratorio agudo severo (SARS-CoV) , el coronavirus causante del síndrome respiratorio de oriente medio (MERS) o los coronavirus causantes del resfriado común 229E, NL63, OC43 y HKU1. En otra realización preferida el virus que pertenece a la familia de Paramyxoviridae es l virus Nipah (NIV) , el virus Hendra (HeV) , el virus Cedar (CedV) o el virus causante del crup (laringotraqueobronquitis) . En otra realización preferida el virus que pertenece a la familia de Orthomyxovirídae es el virus de la Influenza A (IAV) , el virus de la influenza B (IBV) , influenza C (ICV) , influenza D (IDV) o los Thogotovirus. Como se ha descrito anteriormente, el virus relativo al uso de la invención comprende una envoltura lipídica y, además, al menos una proteína de fusión vírica de clase o tipo I. Ejemplos de proteínas de fusión de clase o tipo I incluyen, sin limitar, a la proteína S de coronavirus, la proteína F del NIV, la proteína Env del virus de inmunodeficiencia humana, la proteína HA del IAV, la proteína GP del Ébola y la proteína GP del virus Lassa. Los inventores de la presente invención han aplicado el etinilestradiol a diferentes concentraciones incrementando el crecimiento vírico in vitro, particularmente de virus que comprenden envoltura lipídica. Es práctica de rutina para el experto en la materia calcular la concentración de etinilestradiol, sin superar los límites o cantidades a las que el etinilestradiol pueda ser tóxico, teniendo en cuenta tanto las características del virus como la tolerancia de la línea celular en la que este crezca. En otra realización preferida relativa al uso de la invención, la concentración de etinilestradiol es 0, 1 a 100^M. En otra realización más preferida del uso de la invención, la concentración de etinilestradiol es entre 1 a 60^M, preferiblemente es entre 5 y 55^M. En otra realización más preferida, la concentración de etinilestradiol es 10^M, 15^M, 20^M, 25^M, 30^M, 35^M, 40^M, 45^M o 50^M. Mediante la administración de etinilestradiol, los inventores han conseguido incrementar el crecimiento vírico in vitro, particularmente de virus que comprenden envoltura lipídica. Así, un segundo aspecto de la presente invención se refiere a un método para incrementar el crecimiento in vitro de un virus que comprende una envuelta lipídica, de aquí en adelante el "método de la invención", donde el método comprende: (i) infectar una célula o línea celular con dicho virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula, e (ii) incubar la célula o línea celular infectada de la etapa (i) en un medio de cultivo que comprende etinilestradiol a una temperatura entre 30 y 40 °C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. Los términos o expresiones "etinilestradiol", "incrementar el crecimiento in vitro" y "envoltura lipídica" han sido descritos previamente en otros aspectos de la invención y aplican de igual modo a este aspecto inventivo, así como a todas sus realizaciones preferidas. El término "línea celular" tal como se usan en la presente invención, se refieren a células o una población de células de un único tipo de un organismo multicelular (humano, animal o vegetal) que normalmente no proliferaría indefinidamente pero que se han adaptado para crecer continuamente (indefinidamente) y evadir la senescencia celular que permiten ser cultivadas in vitro durante periodos prolongados. Es práctica de rutina para un experto en la materia elegir el tipo de línea celular dependiendo del virus en crecimiento. Ejemplos de líneas celulares incluyen, sin limitar a, Vero, HeLa, HEK 293T, MDCK, A549, Caco, HCT116, Huh7, Phoenix-Ampho, C6/36, SF268, RD, BHK-21 CEFo DF-1. En una realización preferida del método de la invención, la línea celular es Vero, A549, HEK 293T o MDCK, así como todas las variantes de dichas lineas celulares. En otra realización preferida del método de la invención, la línea celular Vero es la línea celular Vero E6. Particularmente, en la etapa (i) del método de la invención se infecta la célula o línea celular con un virus que comprende una envoltura lipídica, preferiblemente coronavirus. Así, en otra realización preferida del método de la invención el virus pertenece a la familia Coronaviridae, Paramyxoviridae o Orthomyxoviridae. En otra realización más preferida del método de la invención el virus es SARS-CoV-2, NIV o IAV. Particularmente, en la etapa (i) del método de la invención se infecta la célula o línea celular con el virus a una multiplicidad de infección (MOI) de entre 0, 00001 a 1 pfu/célula. El término "multiplicidad de infección" o "MOI (en inglés Multiplicity Of Infection) " es la relación entre los agentes infecciosos (por ejemplo, fagos o, más generalmente, virus o bacterias) y los objetivos de la infección (por ejemplo, células) . Al referirse a un grupo de células inoculadas con partículas de virus, la multiplicidad de infección o MOI es la relación entre el número de partículas de virus y el número de células diana presentes en un espacio definido. El término "pfu (en inglés, plaque-forming unit) " o "unidad formadora de placas" se refiere a la medida utilizada en virología para describir el número de partículas de virus capaces de formar placas por unidad de volumen. En otra realización preferida del método de la invención, se infecta la célula o línea celular con el virus a una multiplicidad de infección (MOI) de entre 0, 001 a 0, 1 pfu/célula, más preferiblemente es 0, 01pfu/célula. Tal como sabe el experto en la materia, las condiciones de cultivo de la etapa (ii) del método dependerá del virus y tipo celular infectado. Particularmente, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo que comprende etinilestradiol a una temperatura entre 30 y 40°C, entre un 2 y 10% de CO2 y durante un tiempo entre 18 a 72 horas. En otra realización preferida del método de la invención, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo que comprende etinilestradiol a una temperatura entre 32 y 38°C, preferiblemente a una temperatura de 33°C, 34°C, 35°C, 36°C o 37°C, más preferiblemente a 37°C. En otra realización más preferida del método de la invención, la línea celular infectada de la etapa (i) se incubará en un medio de cultivo con un porcentaje (%) de CO2 de entre un 3 a 7%, más preferiblemente con 4%, 5% o 6 % de CO2. En otra realización más preferida del método de la invención, la línea celular infectada e la etapa (i) se incubará durante entre 20 a 50 horas, preferiblemente a 24 o 48 horas. Tal como se ha descrito anteriormente, los inventores han aplicado el etinilestradiol a diferentes concentraciones incrementando el crecimiento vírico in vitro. Así, en otra realización preferida del método de la invención, la concentración de etinilestradiol es 0, 1 a 100 j M . En otra realización más preferida del método de la invención, la concentración de etinilestradiol es entre 1 a 60 |jM, preferiblemente es entre 5 y 55 j M . En otra realización más preferida, la concentración de etinilestradiol es 10 j M, 15 j M, 2 0 j M, 25 j M, 30 j M, 35 j M, 4 0 j M, 4 5 j M o 50 j M . DESCRIPCIÓN DE LAS FIGURAS Figura 1. Representación esquemática del ensayo BiMuC. A) Representación de la reconstitución de VFP dividida. Cuando se fusiona con dos proteínas que interactúan, como c-Jun y c-Fos, los dos fragmentos de una VFP (VN N-terminal, y VC C-terminal) pueden reconstituir la estructura de la proteína nativa y sus propiedades fluorescentes. B) El ensayo BiMuC se basa en las propiedades de complementación bimolecular de la fluorescencia de la proteína fluorescente Venus (VFP) . Figura 2. Ensayo BiMuC de SARS-CoV-2. Gráfico de barras que muestra las Unidades de Fluorescencia Relativa (RFU) 48 horas después de que se mezclaron los grupos de células transfectadas con Jun-S, Jun-ACE2, Jun-Fos, Jun, S, Fos-ACE2, Fos-S, plásmido vacío (empty) , Fos o ACE2. Figura 3. Ensayo de fusión viral y toxicidad del etinilestradiol. A) La fusión de membranas provocada por la proteína S fue testada en presencia de etinilestradiol a 6, 25, 12, 5 y 25 ^M tras 48 horas de tratamiento con el compuesto. Los resultados obtenidos en ausencia de etinilestradiol (línea de puntos) se emplearon para normalizar los resultados (100%) . B) Análisis de la toxicidad del compuesto a 6, 25, 12, 5 y 25 ^M (% de viabilidad) . En ambos casos se muestra la media y desviación típica de tres experimentos independientes. Figura 4. Efecto del etinilestradiol sobre la fusión de membranas de la proteína S del SARS-CoV-2 empleando la técnica de BiMuC. Se emplearon diferentes concentraciones del compuesto (6, 25, 12, 5, 25 y 50 ^M) y su actividad fue testada tras 24, 48 y 72 horas. Los resultados muestran la media de tres experimentos. Medias relativizadas al tratamiento exclusivamente con solvente (100%, línea de puntos) . Figura 5. Toxicidad asociada al etinilestradiol en células Vero E6. La viabilidad celular en presencia de etinilestradiol fue testada a 24, 48 y 72 horas tras el tratamiento a 1, 10, 100 y 1000 ^M. Se muestra la media de tres experimentos independientes. Figura 6. Análisis del efecto del etinilestradiol sobre el crecimiento SARS-CoV-2. Se trataron células Vero-E6 con etinilestradiol a 1 ^M y 10 ^M seguido de la infección con SARS-CoV-2. La carga viral se midió 48h después de la infección. El gráfico de barras representa la media y desviación estándar del porcentaje de infección sobre las muestras tratadas con exclusivamente con vehículo (100%) de tres experimentos independientes. Figura 7. Efecto del etinilestradiol a 12, 5 ^M, 25 ^M y 50 ^M en la fusión inducida por las proteínas F y G de Nipah. Se muestra la media y desviación típica de tres experimentos independientes. Figura 8. Análisis del efecto del etinilestradiol sobre el crecimiento del IAV. Células MDCks fueron infectadas con el IAV a una multiplicidad de infección baja. A continuación, las células fueron tratadas con etinilestradiol a las concentraciones indicadas 3, 125^M, 6, 25^M, 12^M y 25^M La carga viral se midió 48h después de la infección empleando un ensayo se TCID50 (del inglés, Tissue Culture Infection Dose 50%) . El gráfico de barras representa la media y desviación de tres experimentos independientes. EJEMPLOS MATERIALES Y MÉTODOS Plásmidos y líneas celulares Las células HEK 293T se obtuvieron del "American Type Culture Collection o ATCC (número de depósito CRL-11268) " y se mantuvieron en medio Eagle modificado de Dulbecco (DMEM) (Gibco) suplementado con suero bovino fetal al 10% (FBS, Gibco) . El plásmido SARS-CoV-2:S fue obtenido del "Icahn School of Medicine at Mount Sinai, Nueva York. Este plásmido incluye la secuencia S de longitud completa en el plásmido (vector) pCAGGS. Los plásmidos que expresan las proteínas: Jun fusionada al extremo Nt de la proteína de la fluorescencia Venus (Jun-Nt VFP) , la Fos fusionada al extremo Ct de la proteína de fluorescencia Venus (Fos-Ct VFP) así como ACE2 humano, se obtuvieron de Addgene (referencias: n° 22012, n° 22013 y n° 1786, respectivamente) . Los plásmidos de luciferasa Jun-Nt y luciferasa Fos-Ct se obtuvieron como se describió en García-Murria M.J., et al 2019, Viruses; 11 (3) :229. Ensayo de fusión célula-célula Para el ensayo de fusión célula-célula, los inventores sembraron células HEK 293T en placas de 24 pocillos (2x106 células/placa) el día 1 en medio DMEM suplementado con FBS al 10%. Después de 24 horas (día 2) , las células fueron transfectadas, usando polietilenimina (PEI) como reactivo de transfección, con Jun-Nt, Fos-Ct, SARS-CoV-2:S, ACE2 humano y pRL Renilla Luciferase (Promega) (usando las combinaciones de plásmidos indicadas) o simuladas de transfección (controles negativos) . El día 3, las células se contaron, se mezclaron y se sembraron en placa de 24 pocillos (1x105 células/pocillo en 500^L de medio) o en placas de 96 pocillos (3x104 células/pocillo en 100 ^L de medio) . El día 5, se midió la fluorescencia en placas de 96 pocillos mediante un lector de placas Victor X (PerkinElmer) con agitación y empleando los filtros de 485nm y 535nm. Cuando se usaron las placas de 24 pocillos, las células se recogieron y se transfirieron a una placa negra de 96 pocillos antes de la medición de la fluorescencia. Cada experimento se realizó tres veces y por triplicado. Infección con SARS-CoV-2 Las infecciones con SARS-CoV-2 se realizaron en células Vero E6 (ATCC-CRL/1586) a una multiplicidad de infección baja (0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 tras la infección, se recogieron los sobrenadantes, se colocaron en tubos sellados y se aclararon mediante centrifugación durante 10 minutos a 2000rpm en una centrífuga Eppendorf 5810 refrigerada. El stock de virus se almacenó a -80°C para su conservación. Las células Vero E6 se mantuvieron de forma rutinaria en medio de cultivo Eagle modificado de Dulbecco (DMEM) (Biowest) que contenía suplementos: suero bovino fetal al 5%, glutamina 2mM, penicilina 100U/mL y estreptomicina 100^g/mL. Los matraces de células se incubaron de forma rutinaria a 37°C en una atmósfera de 5% de CO2. El título de SARS-CoV-2 se determinó en células Vero-E6 mediante ensayo de placa. Las muestras se sometieron a diluciones seriadas de 3 o 10 veces y se agregaron a cada pocillo. Después de 1h de adsorción del inóculo a 37°C, las células se lavaron con medio DMEM y se añadió a cada pocillo una mezcla semisólida de carboximetilcelulosa (CMC) al 1% en DMEM suplementado con suero. Tras el período de incubación de 3 días después de la infección, se examinaron los pocillos para detectar la presencia de placas de lisis inducidas por virus. Las células se fijaron durante la noche con una solución de formaldehído al 10%, se eliminó el medio semisólido y los cultivos fijados se tiñeron adicionalmente durante 10 minutos con una solución filtrada de violeta cristal al 2%. Después de lavar la solución de tinción, se contaron en aquellas diluciones que mostraban más de 30 placas de lisis. El título se estimó mediante la siguiente fórmula: (número de placas * factor de dilución de la muestra) / volumen de la muestra (en mL) . Todos los procedimientos de cultivo de SARS-CoV-2 se llevaron a cabo en un laboratorio de nivel 3 de bioseguridad mejorado (BSL3+) y todo el personal usó respiradores purificadores de aire motorizados (3M) incorporados en los trajes Prochem. La manipulación de virus infecciosos vivos se completó dentro de una cabina de bioseguridad de clase II. Infección con IAV En los ensayos de infección con el virus de la influenza o gripe A (IAV) se empleó la cepa WSN en células MDCK del inglés "Madin-Darby Canine Kidney cells" (https://www.atcc.org/products/ccl-34) a una multiplicidad de infección baja (0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes, se colocaron en tubos sellados y se aclararon mediante centrifugación durante 10 minutos a 2000rpm en una centrífuga Eppendorf 5810 refrigerada. El stock de virus se almacenó a -80°C para su conservación. Las células MDCK se mantuvieron de forma rutinaria en medio de cultivo Eagle modificado de Dulbecco (DMEM) (Biowest) que contenía suplementos: suero bovino fetal al 5%, glutamina 2mM, penicilina 100U/mL y estreptomicina 100^g/mL. Los matraces de células se incubaron de forma rutinaria a 37°C en una atmósfera de 5% de CO2. El título de IAV se determinó en células MDCK mediante un ensayo de TCID50. Las muestras se sometieron a diluciones seriadas y se emplearon para infectar células en placas de 96 pocillos. Tras el período de incubación de 3 días después de la infección, se examinaron los pocillos. La presencia de virus en cada uno de ellos se puede detectar por la ausencia de células debido al efecto citopático del virus. La no infección provoca la aparición de una monocapa de células. Las células se fijaron con formaldehído al 4% (20min) , y se tiñeron adicionalmente durante 20 minutos con una solución filtrada de violeta cristal al 1%. Después de lavar la solución de tinción, se contaron en aquellas diluciones que mostraban efecto citopático. El título se estimó mediante el método de Reed y Muench (LJ, MUENCH H. American Journal of Epidemiology. 1938 May 1;27 (3) :493-7) . Todos los procedimientos de cultivo de IAV se llevaron a cabo en un laboratorio de nivel 2 de bioseguridad. RESULTADOS El ensayo BiMuC se basa en las propiedades de complementación de algunas enzimas y proteínas fluorescentes como la proteína fluorescente Venus (VFP) . La VFP se puede dividir en dos fragmentos (VN y VC respectivamente) , ninguno de los cuales es fluorescente por sí mismo. Sin embargo, cuando estos dos fragmentos se fusionan con un par de proteínas que interactúan las dos mitades de la VFP se aproximan, reconstituyéndose la estructura nativa de la VFP y recuperándose sus propiedades fluorescentes (Figura 1A) . Para analizar y cuantificar la capacidad fusogénica de la proteína SARS-CoV-2:S, las proteínas c-Jun y c-Fos, las cuales son capaces de interaccionar entre sí, se fusionaron con los fragmentos VN y VC de la VFP, generando las quimeras c-Jun/VN y c-Fos/VC. Estas quimeras (de ahora en adelante serán presentadas como Jun y Fos respectivamente) se expresaron en dos grupos de células independientes junto con la proteína S o ACE2 (es decir, Jun-S, Jun-ACE2, Fos-S y Fos-ACE2) (Figura 1B) . Estos ultivos celulares se transfectaron por separado con plásmidos (vectores) que codifican SARS CoV-2:S, ACE2 humana, Jun, Fos, Jun y Fos simultáneamente (Jun-Fos) o un plásmido vacío. Tras 24 horas, las células se lavaron y combinaron en 5 grupos: Jun-S + Fos-ACE2, Jun-ACE2 + Fos-S, Jun-Fos + Plásmido vacío (empty) , Jun + Fos y S + ACE2 (Figura 2) y se incubaron durante 48 horas adicionales. Las muestras que contenían las poblaciones de células transfectadas con Jun-S + Fos-ACE2 y Jun-ACE2 + Fos-S mostraron una fluorescencia comparable a la del grupo Jun-Fos + Plásmido vacío (control positivo) . Por el contrario, el grupo Jun + Fos (donde los componentes para reconstituir el VFP y su fluorescencia se expresan en células separadas) y el grupo S + ACE2 (que contiene las proteínas necesarias para la formación de sincitios pero no para la reconstitución de VFP) no mostraron ninguna fluorescencia (Figura 2) . Estos resultados muestran la interacción entre las proteínas SARS-CoV-2:S y ACE2 humana y la posterior fusión de membranas que induce esta interacción. Es de destacar que la inhibición de cualquiera de los procesos celulares o virales que conducen a la fusión de la membrana, desde la síntesis y maduración de la proteína S hasta su interacción con ACE2, dará como resultado la ausencia de la señal fluorescente. Además, debe tenerse en cuenta que este ensayo se basa en células HEK 293T, que expresan niveles bajos de ACE2. El uso de una línea celular con niveles suficientes de ACE2 eliminará la necesidad de complementar esta proteína en trans (transfectada) . A continuación, se probó el efecto del etinilestradiol sobre la fusión de membrana inducida por la proteína SARS-CoV-2:S tanto en presencia como en ausencia de la proteasa activadora TMPRSS2. Para ello se co-transfectó junto a los plásmidos indicados para realizar el ensayo de BiMuC previamente descrito un plásmido con la secuencia que codifica para TMPRSS2 o un plásmido vacío en las células HEK-293T. A las 24 horas tras la transfección, las células fueron lavadas y mezcladas para llevar a cabo el ensayo de fusión BiMuC. A continuación, se añadió etinilestradiol (concentración final igual a 6, 25, 12.5 y 25 ^M) o solvente (DMSO, concentración final 1%) . Tras 48 horas a 37°C y una concentración de CO2 del 5%, se midió la fluorescencia de la proteína Venus como marcador de la fusión de membranas (Figura 3A) . Los resultados muestran un aumento en el porcentaje de fusión en las muestras tratadas con etinilestradiol (concentraciones superiores a 6, 25 |jM) en comparación con las muestras tratadas con solvente (indicado con una línea de puntos en la Figura 3) . Este aumento e la actividad, cercano al 200% en comparación con las muestras sin compuesto, se observó tanto en presencia como en ausencia de TMPRSS2. En paralelo la toxicidad del compuesto se midió incubando células HEK-293T con etinilestradiol (concentración final de etinilestradiol igual a 6, 25, 12.5 y 25 ^M en DMSO al 1%) o con solvente (DMSO, concentración final 1%) durante 48 horas a 37°C y una concentración de CO2 del 5% (Figura 3B) . A continuación, la viabilidad de las células se midió empleando el kit CellTiter-Glo de Promega siguiendo las indicaciones del fabricante. Adicionalmente, el etinilestradiol demostró ser activo (medidas realizadas con la técnica de BiMuC) con periodos de incubación es de 24, 48 o 72 horas (Figura 4) . Posteriormente, para comprobar con precisión el efecto del etinilestradiol sobre la fusión de las membranas viral y celular que se produce durante una infección, se analizó el crecimiento viral del SARS-CoV-2 en presencia y ausencia de este compuesto. Dado que el SARS-CoV-2 generalmente se cultiva en células Vero E6 y que se monitoriza el crecimiento a diferentes tiempos tras la inoculación del virus, se analizó, antes de los ensayos de infección, la toxicidad del etinilestradiol después de 24, 48 y 72 horas de tratamiento en células Vero E6 (Figura 4) . El etinilestradiol demostró no ser toxico (viabilidad por encima del 90%, CC90) a concentraciones por debajo de 20j M tras 24 y 48 horas de incubación (Figura 5) . Tras 72 horas de incubación se observó una CC90 cercana a 10j M (Figura 5) . Una vez analizada la toxicidad en células Vero E6 y confirmada la efectividad a múltiples tiempos de incubación se procedió a la realización de las infecciones en cultivos celulares en presencia de etinilestradiol a concentraciones no tóxicas (<10j M) , particularmente a 1 y a 10 |jM. Las infecciones con SARS-CoV-2 se realizaron en células Vero E6 (MOI: 0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes. Los títulos virales de estas muestras se determinaron en células Vero-E6 mediante ensayo de placa. El resultado de las infecciones de células Vero E6 confirman que el etinilestradiol potencia el crecimiento del SARS-CoV-2 (Figura 6) alcanzándose rendimientos del 180% en comparación con las células no tratadas con el compuesto (valor representado n la figura con una línea punteada) . Además, también se ha medido el efecto del etinilestradiol en la fusión de membranas inducida por otros virus con envuelta lipídica altamente patógenos como el virus Nipah utilizando el enfoque BiMuC adaptado para este virus (Figura 7) . Brevemente, dos grupos de células fueron transfectados con VN, Nipah F y Nipah G y VC respectivamente. Tras 24h ambos grupos se juntaron y las células fueron tratadas con etinilestradiol (concentración final de 12, 5, 25 o 50 ^M) . Como control una alícuota de las células fue tratada exclusivamente con el solvente (100% de fusión, indicado en la figura 7 con una línea de puntos) . Tras 48 horas de incubación se analizó la fluorescencia. Los resultados obtenidos indican que el etinilestradiol potencia la fusión de membranas biológicas iniciada por la proteína de fusión (F) y la proteína de unión (G) del virus NiV. En este caso se alcanza una señal cercana al 150%, respecto a la fusión obtenida en ausencia de compuesto. Además, podemos ver una relación directa entre la cantidad de etinilestradiol y la cantidad de fusión viral observada. Los virus NiV y SARS-CoV-2 no pertenecen a la misma familia viral, pero comparten un mecanismo común para mejorar la fusión célula-célula, tanto NiV:F como SARS-CoV-2:S son proteínas de fusión de tipo I. Por tanto, se demuestra que el etinilestradiol favorece la entrada de cualquier virus con envuelta lipídica mediante un mecanismo de fusión similar y, por tanto, que el etinilestradiol puede incrementar su el crecimiento in vitro. Además, también se ha medido el efecto del etinilestradiol sobre el crecimiento del IAV. Pare ello se procedió a la realización de las infecciones en cultivos celulares en presencia de etinilestradiol (Figura 8) . Las infecciones con IAV se realizaron en células MDCK (aproximadamente a una MOI: 0, 01PFU/célula) . Después de 48 horas de incubación a 37°C y 5% CO2 se recogieron los sobrenadantes. Los títulos virales de estas muestras se determinaron en células MDCK mediante ensayo de TCID50. El resultado de las infecciones el IAV confirman el efecto del etinilestradiol sobre la capacidad infectiva de los virus con envuelta lipídica.
Publicaciones:
ES2955613 (04/12/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 29/04/2022 se realizó Registro Instancia de Solicitud
En fecha 29/04/2022 se realizó Admisión a Trámite
En fecha 29/04/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 11/05/2022 se realizó Suspenso en examen de oficio
En fecha 11/05/2022 se realizó 6101P_Notificación defectos en examen de oficio
En fecha 18/05/2022 se realizó Publicación Defectos en examen de oficio
En fecha 15/07/2022 se realizó 3007_Registro contestación al suspenso en examen de oficio
En fecha 15/07/2022 se realizó Superado examen de oficio
En fecha 24/02/2023 se realizó Realizado IET
En fecha 24/02/2023 se realizó Falta Unidad de Invención en Opinión Escrita
En fecha 28/02/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 06/03/2023 se realizó Publicación Falta unidad de Invencion
En fecha 04/12/2023 se realizó Publicación Solicitud
En fecha 04/12/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 28/02/2024 se realizó PETEX_Petición de examen sustantivo
En fecha 19/03/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
29/04/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 27/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395
El registro de patente nacional por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395 fue solicitada el 29/04/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395 fue solicitada por UNIVERSITAT DE VALÈNCIA mediante los servicios del agente Ángel Pons Ariño. El registro [modality] por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395 está clasificado como C12N 7/02,C07J 1/00 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes C12N 7/02,C07J 1/00.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395 está clasificado con la clasificación C12N 7/02,C07J 1/00 por lo que si se desea conocer más registros con la clasificación C12N 7/02,C07J 1/00 clicar aquí.Otras invenciones solicitadas a través del representante ÁNGEL PONS ARIÑO
Es posible conocer todas las invenciones solicitadas a través del agente ÁNGEL PONS ARIÑO entre las que se encuentra el registro patente nacional por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Si se desean conocer más invenciones solicitadas a través del agente ÁNGEL PONS ARIÑO clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12
Es posible conocer todas las patentes registradas en la clase C12 (BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUT) entre las que se encuentra la patente USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12N
Es posible conocer todas las patentes registradas en la clase C12N (MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN;CULTURE OU CONSERVATION DE MICRO-ORGANISM) entre las que se encuentra la patente USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C07
Es posible conocer todas las patentes registradas en la clase C07 (QUIMICA ORGANICA) entre las que se encuentra la patente USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C07J
Es posible conocer todas las patentes registradas en la clase C07J (ESTEROIDES) entre las que se encuentra la patente USO IN VITRO DEL ETINILESTRADIOL PARA INCREMENTAR EL CRECIMIENTO VÍRICO con el número P202230395. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202230393
P202230393