- Home /
- Publicaciones de patentes /
- Implante dental y su procedimiento de fabricación
Patente nacional por "Implante dental y su procedimiento de fabricación"
Este registro ha sido solicitado por
Persona física
a través del representanteÁNGEL PONS ARIÑO
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 20/07/2022
- Número solicitud:
-
P202230666
- Número publicación:
-
ES2958908
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
Ángel Pons Ariño
- Clasificación Internacional de Patentes:
- A61C 8/00,A61C 13/00,A61C 8/00
- Clasificación Internacional de Patentes de la publicación:
- A61C 8/00,A61C 13/00,A61C 8/00
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2958908_A11. Un implante dental (1) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm que comprende: - una primera zona o zona apical (4) en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , garantizar la integración del implante durante su atornillado y favorecer su osteointegración, compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, y con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y20 m o entre 1 m y 2 m, - una segunda zona, zona central o cuerpo (5) con una porosidad en una proporción de entre 30 % y 50 % en volumen, situada sobre la primera zona o zona apical (4) , con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro, donde dicha segunda zona, zona central o cuerpo (5) está compuesta por Ti, Ti6Al4V o Ti3sNb7ZrsTa, y donde los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas, y donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquier combinación de las mismas, - una tercera zona, cabeza o módulo de cresta (6) en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , resistir las cargas de masticación y evitar la adhesión de bacterias perjudiciales, y compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, situada sobre la segunda zona, zona central o cuerpo (5) , donde la superficie de dicha tercera zona (4) comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas, y - un pilar protésico (2a) fijado con un tornillo (2b) situado sobre la tercena zona, cabeza o módulo de cresta (6) y configurado para acoplar una corona artificial (2c) . donde la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) ocupan el mismo volumen en el implante dental (1) , y donde el volumen de la segunda zona, zona central o cuerpo (5) es el doble del volumen de la primera zona o zona apical (4) o de la tercera zona, cabeza o módulo de cresta (6) . 2. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante irradiación de iones argón y tiene una rugosidad superficial Sq de entre 0, 9 nmy1 nm. 3. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante tratamiento químico y tiene una rugosidad superficial Sq de entre 10 m y20 m. 4. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante irradiación con láser de femtosegundo y tiene una rugosidad superficial Sq de entre 1 m y 2 m. 5. El implante dental (1) según cualquiera de las reivindicaciones 1 a 4 donde la primera zona o zona apical (4) tiene una estructura de superficie con • ondulaciones que tienen crestas de igual o distinta altura y valles de igual o distinta profundidad.donde la distancia entre dos crestas adyacentes o dos valles adyacentes es igual o distinta, • columnas de igual o distinto diámetro y distinta o igual altura, donde dichas columnas se separan entre sí con una distancia adyacente igual o distinta, • surcos o agujeros de distinta profundidad que se separan entre sí con una distancia adyacente igual o distinta, • y cualquier combinación de los mismos. 6. Un procedimiento para fabricar el implante dental (1) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm según cualquiera de las reivindicaciones 1 a 5, caracterizado por que comprende las siguientes etapas: a) añadir un polvo seleccionado de entre Ti, Ti6Al4V o Ti35Nb7Zr5Ta en un molde cilindrico (8) de diámetro al menos 2 mm mayor que el diámetro del implante dental (1) y que comprende una sufridera (9) en su interior, b) añadir una mezcla homogénea de un polvo seleccionado de entre Ti, T¡6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03 en el molde cilindrico (8) , sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v, c) añadir un polvo seleccionado de entre Ti, T¡6Al4V o T hs^Z rsT a en el molde cilindrico (8) , sobre el polvo de la etapa (b) , d) compactar el conjunto de polvos estratificados obtenido en la etapa (c) que se encuentra dentro del molde cilindrico (8) mediante unos medios de compresión uniaxial en frío manteniendo una presión de entre 800 MPa y 1200 MPa durante un periodo de tiempo de al menos 2 minutos, e) extraer la preforma cilindrica en verde del polvo compactado obtenido en la etapa (d) junto con la sufridera (9) del molde cilindrico (8) , f) calentar la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 60 0C y 70 0C y una presión de entre 8 P a y 12 P a durante un periodo de tiempo de entre 11 h y 13h, g) calentar la preforma cilindrica, que se encuentra en el interior del contenedor, obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 P a y 12 P a durante un periodo de tiempo de entre 11 h y 13 h, h) sinterizar en un horno la preforma cilindrica obtenida en la etapa (g) a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y 130 min y a una presión de entre 0, 04 Pa y 0, 06 Pa, para obtener un cilindro de diámetro de entre 3 mm y 8 mm que comprende una primera zona o zona apical (4) , una segunda zona, zona central o cuerpo (5) y una tercera zona, cabeza o módulo de cresta (6) , donde la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo (5) es el doble del volumen de la primera zona o zona apical (4) o de la tercera zona, cabeza o módulo de cresta (6) , i) mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado para obtener un cilindro de diámetro de entre 3 mm y 8 mm y dar forma de rosca externa de unión a la primera zona o zona apical (4) y a la tercera zona, cabeza o módulo de cresta (6) , j) procesar la superficie de la primera zona o zona apical (4) mediante tratamiento químico o irradiación con iones argón o láser de femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nmy 1 nm, entre 10 m y 20 pmo entre 1 m y 2 m, k) infiltrar por inmersión en los poros de la segunda zona, zona central o cuerpo (5) una matriz polimérica biodegradable seleccionada de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos y poliacrilamidas, donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo o cualquier combinación de las mismas, y I) depositar en la superficie de la tercera zona, cabeza o módulo de cresta (6) , nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. 7. El procedimiento según la reivindicación 6, donde las etapas (a) , (b) y (c) se llevan a cabo independientemente, sin vibración y con una compactación manual posterior mediante punzón (13) . 8. El procedimiento según cualquiera de las reivindicaciones 6 o 7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante irradiación con iones de argón de energía de entre 0, 5 KeV y 1 KeV en un ángulo de incidencia del haz de entre 0 ° y 75 ° respecto a la normal de la superficie. 9. El procedimiento según cualquiera de las reivindicaciones 6 Ó7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante ataque químico sumergiendo la primera zona o zona apical (4) en una solución que se encuentra a una temperatura de entre 48 0C y 52 0C que comprende ácido fluorhídrico en una concentración de entre 20 ml/l y 24 ml/l y un inhibidor orgánico en un concentración de entre 45 ml/l y 55 ml/l, durante un periodo de tiempo de 120 s y 130 s, 10. El procedimiento según la reivindicación 9, donde el inhibidor orgánico utilizado en la etapa (j) es alcohol propargil. 11. El procedimiento según cualquiera de las reivindicaciones 6 ó 7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante irradiación con un láser de femtosegundos, de pulsos de 396 fs en una frecuencia de repetición preferiblemente de 100 kHz, que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 J. 12. El procedimiento según cualquiera de las reivindicaciones 6 a 11, donde la deposición de la etapa (I) se lleva a cabo mediante li) tratamiento de la superficie de la tercera zona, cabeza o módulo de cresta (6) con una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una elación 3:1, 4:1 o 7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1 12) tratamiento de silanización de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (li) mediante inmersión en una solución seleccionada de entre aminopropiltrietoxisilano (APTES) , 3-cloropropiltrietoxisilano (CPTES) y 3-glicidiloxipropiltrietoxisilano (GPTES) , 13) inmersión de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (l2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas.
Los productos y servicios protegidos por este registro son:
A61C 8/00 - A61C 13/00 - A61C 8/00
Descripciones:
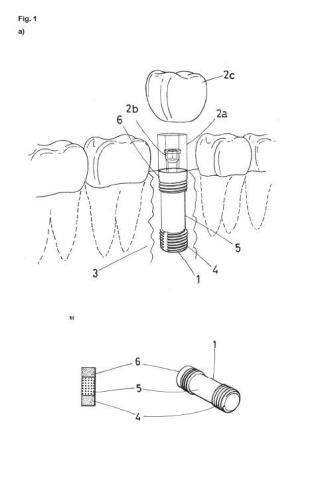
+ ES-2958908_A1 Implante dental v su procedimiento de fabricación La presente invención se refiere al implante dental que comprende tres zonas diferenciadas de distinta composición química, de distinta porosidad y distinto acabado superficial, que se puede utilizar para la reposición dental. Además, la presente invención se refiere al procedimiento pulvimetalúrgico para fabricar dicho implante dental que comprende etapas de prensado en molde, eliminación de espaciador, sinterizado, micromecanizado y modificación superficial de las distintas zonas. Por tanto, la presente invención se encuadra en el área de la Ciencia e Ingeniería de Materiales y es de interés fundamentalmente para el sector odontológico, aunque también para la industria pulvimetalúrgica, en aras de fabricar productos con un mayor valor añadido. ANTECEDENTES DE LA INVENCIÓN Los tejidos óseos presentan una estructura porosa jerarquizada y su sustitución es muy habitual en la práctica clínica, entre otros casos en implantología dental, debido a enfermedades congénitas, degenerativas, fracturas, resecciones tumorales o razones estéticas (C. Ning, L. Zhou and G. Tan, Materials Today, 19 (1) (2016) 2-3) . La reparación dental incluye el uso de implantes sintéticos, destacando entre los biomateriales metálicos el titanio comercialmente puro (c.p. Ti) y la aleación Ti6Al4V (P. Norwsky, D. Bumgardner, J. Biomedical Mat. Research, 2009; M. Navarro, A. Michiardi, O. Castaño, J.A. Planell, J. of the Royal Society Interface 5 (2008) 1137-1158; V. Goriainov, R. Cook, J. M. Latham, D. G. Dunlop and R. O. C. Oreffo, Acta Biomaterialia, 10 (10) (2014) 4043 4057; E.J. Tobin, Advanced Drug Deliver y Reviews, 112 (2017) 88-100) . A pesar de sus excelentes resultados, existen algunos problemas reconocidos que comprometen su fiabilidad: • Apantallamiento de tensiones (diferencia notable en la rigidez entre el implante y el hueso cortical, 100-110 GPa frente a 20-25 GPa, respectivamente) que provoca la reabsorción ósea (pérdida de densidad) y el aumento del riesgo de fractura del hueso adyacente al implante. • Fallos por fatiga mecánica debidos a unas características inadecuadas del aterial o del diseño del implante, así como el uso de cargas prematuras o excesivas. • Problemas relacionados con la intercara implante/hueso, que inhiben la formación de tejido óseo nuevo: a) pobre osteointegración de los implantes de titanio, se generan micro-movimientos relativos y un aflojamiento del implante a medio y largo plazo, y b) infecciones, adhesión y proliferación de bacterias, durante las intervenciones, postoperatorio y servicio del implante. En este contexto, el equilibrio entre el comportamiento biomecánico y biofuncional de los implantes dentales sigue siendo un enorme desafío para el sector biomédico. Es ampliamente reconocido por la comunidad científico-técnica, el uso de materiales porosos (WÜ2015054101A, EP3034033A, US2010081109A1, EP3034033A) para solventar el desajuste en rigidez entre el implante y el tejido óseo que pretende sustituir. Sin embargo, es muy importante el control de la porosidad en términos de contenido, tamaño, morfología y distribución (homogénea o gradiente) , que garantice la resistencia mecánica, a fatiga y desgaste, a la corrosión, así como que permita el crecimiento del hueso hacia el interior y/o infiltración de los recubrimientos superficiales, inhibiendo la adhesión y la proliferación de bacterias en la superficie de los implantes. Por tanto, es necesario desarrollar nuevos implantes dentales y/o nuevos procedimientos de producción de implantes dentales con prestaciones mejoradas. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere al implante dental que comprende tres zonas diferenciadas de distinta composición química, distinta porosidad (porosidad longitudinal controlada) y distinto acabado superficial, que se puede utilizar para la reposición dental. En el caso de la reposición dental con implantes, éstos fallan durante su vida en servicio, debido a varios problemas que pueden coexistir: • reabsorción ósea y el aumento de la probabilidad de fractura del hueso receptor provocada por la diferencia de rigidez entre el implante dental y el hueso cortical, • fallos por fatiga mecánica (material, tamaño y/o diseño geométrico inadecuado; cargas prematuras o excesivas en el implante; uso de criterios de tolerancia al daño en vez de los de prevención, recomendados para este tipo de aplicación) , • y aflojamiento del implante, provocada por una mala osteointegración (rugosidad superficial inadecuada, nula o pobre bioactividad e infecciones bacterianas que inhiben la formación de hueso nuevo) . Además, la presente invención se refiere a un procedimiento pulvimetalúrgico para la fabricación del implante dental de la invención, que es económico y fácilmente reproducible y que comprende etapas de - Fabricación de una preforma cilindrica en verde con tres zonas de composición diferenciadas que utiliza espaciadores para aportar porosidad longitudinal controladay que comprende además una etapa de eliminación de dichos espaciadores - Sinterizado de la preforma cilindrica - Micronizado de la preforma cilindrica - Modificación de la superficie de la superficie de las distintas zonas. Por tanto, en un primer aspecto, la presente invención se refiere a un implante dental (a partir de aquí el implante dental de la invención) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm que comprende: - una primera zona o zona apical en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , garantizar la integración del implante durante su atornillado y favorecer su osteointegración, compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, y con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y20 m o entre 1m y 2 m, - una segunda zona, zona central o cuerpo, con una porosidad en una proporción de entre 30 % v/v y 50 % v/v, situada sobre la primera zona o zona apical, con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro, donde dicha segunda zona, zona central o cuerpo está compuesta por Ti, Ti6Al4V o Ti35Nb7Zr5Ta, y donde los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas, y donde dichas matrices poliméricas biodegradables comprenden nanopartículas deAg, hidroxiapatita, vidrio bioactivo, o cualquier combinación de las mismas, - una tercera zona, cabeza o módulo de cresta en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , resistir las cargas de masticación y evitar la adhesión de bacterias perjudiciales, y compuesta por Ti, Ti6Al4V o Ti35Nb7Zr5Ta, situada sobre la segunda zona, zona central o cuerpo, donde la superficie de dicha tercera zona comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas, y - un pilar protésico fijado con un tornillo situado sobre la tercena zona, cabeza o módulo de cresta y configurado para acoplar una corona artificial, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen en el implante dental y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. En la presente invención, el término "rugosidad superficial Sq" se refiere al conjunto de irregularidades que posee una superficie equivalente a la desviación estándar de la distribución de la altura. En la presente invención la rugosidad superficial Sq se determina mediante microscopía electrónica de barrido y/o microscopía confocal. La primera zona o zona apical del implante dental está compuesta por Ti, T¡6Al4V o T¡35Nb7ZrsTa. Dicha primera zona o zona apical está mecanizada en forma de rosca externa de unión y está configurada para unirse al hueso de la cavidad bucal. Además, la superficie rugosa de dicha primera zona con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y 20 m o entre 1 m y 2 m, está procesada mediante irradiación con iones argón, tratamiento químico o láser femtosegundo para modificar su rugosidad superficial garantizando la integridad del implante durante su implantación (atornillado) y favoreciendo la posterior osteointegración. En una realización preferente del implante de la presente invención, la primera zona o zona apical es procesada mediante irradiación de iones argón y tiene una rugosidad superficial Sq de entre 0, 9 nmy1 nm. En otra realización preferente del implante de la presente invención la primera zona o zona apical es procesada mediante tratamiento químico y tiene una rugosidad superficial Sq de entre 10m y20 m. En otra realización preferente del implante de la presente invención la primera zona o ona apical es procesada mediante irradiación con láser de femtosegundo y tiene una rugosidad superficial Sq de entre 1 m y 2 m. En otra realización preferente del implante dental de la presente invención la primera zona o zona apical tiene una estructura de superficie con • ondulaciones que tienen crestas de igual o distinta altura y valles de igual o distinta profundidad y donde la distancia entre dos crestas adyacentes o dos valles adyacentes es igual o distinta, • columnas de igual o distinto diámetro y distinta o igual altura, donde dichas columnas se separan entre sí con una distancia adyacente igual o distinta, • surcos o agujeros de distinta profundidad que se separan entre sí con una distancia adyacente igual o distinta, • y cualquier combinación de los mismos. generando patrones de rugosidad superficial que combinan niveles micro y nanométrico que favorecen la osteointegración del implante de la presente invención. La segunda zona, zona central o cuerpo está situada sobre la primera zona o zona apical y está compuesta por Ti, Ti6Al4V o Ti35Nb7ZrsTa. Presenta una porosidad en una proporción de entre 30 % v/v y 50 % v/v, con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro dichos parámetros determinados mediante una técnica de análisis de imagen automática o por microtomografía. En dicha segunda zona los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas y dichas matrices poliméricas comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas tales como nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquiera combinación de las mismas. En la presente invención la porosidad se determina mediante el método de Arquímedes y por microtomografía computerizada (Micro CT) . La tercera zona, cabeza o módulo de cresta está compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa. Además, la superficie de dicha tercera zona, cabeza o módulo de cresta comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas y por tanto configurada para evitar la adhesión de bacterias perjudiciales Dicha tercera zona, cabeza o módulo de cresta está mecanizada en forma de rosca exterior de unión y por tanto configurada para unirse al hueso de la cavidad bucal y resistir las cargas de masticación. El pilar protésico fijado con un tornillo está situado sobre la tercena zona, cabeza o módulo de cresta y está configurado para acoplar una corona artificial. En el implante de la presente invención la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen en el implante dental, y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. La principal ventaja del implante de la presente invención es que presenta un mejor equilibrio de comportamiento bio-tribomecánico y biofuncional, con respecto implantes comerciales gracias a que presenta tres zonas diferenciadas con distinta composición química, distinta porosidad y distinto acabado superficial. Por tanto, otro aspecto de la invención se refiere a un procedimiento para fabricar el implante dental de la presente invención con una geometría cilindrica de diámetro de entre 3 mm y 8 mm descrito anteriormente (a partir de aquí "el procedimiento de la invención") , que comprende las siguientes etapas: a) añadir un polvo seleccionado de entre Ti, Ti6Al4V o T¡3sNb7ZrsTa en un molde cilindrico de diámetro al menos 2 mm mayor que el diámetro del implante dental y que comprende una sufridera en su interior, b) añadir una mezcla homogénea de un polvo seleccionado de entre Ti, Ti6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03 en el molde, sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v, c) añadir un polvo seleccionado de entre Ti, Ti6Al4V o Ti35Nb7Zr5Ta en el molde cilindrico, sobre el polvo de la etapa (b) , d) compactar el conjunto de polvos estratificados obtenido en la etapa (c) que se encuentra dentro del molde cilindrico mediante unos medios de compresión uniaxial en frío manteniendo una presión de entre 800 MPa y 1200 MPa durante un periodo de tiempo de al menos 2 minutos, e) extraer la preforma cilindrica en verde del polvo compactado obtenido en la etapa (d) junto con la sufridera del molde cilindrico, f) calentar la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 60 0C y 70 0C y una presión de entre 8 Pa y 12 Pa durante un periodo de tiempo de entre 11 h y 13 h, preferiblemente en estufa, g) calentar la preforma cilindrica, que se encuentra en el interior del contenedor, obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 Pa y 12 Pa durante un periodo de tiempo de entre 11 h y 13 h, preferiblemente en estufa, h) sinterizar en un horno la preforma cilindrica obtenida en la etapa (g) a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y130 min, y a una presión de entre 0, 04 Pa y 0, 06 Pa, para obtener un cilindro de diámetro de entre 5 mm y 10 mm que comprende una primera zona o zona apical, una segunda zona, zona central o cuerpo y una tercera zona, cabeza o módulo de cresta, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta, ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta, i) mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado, para obtener un cilindro de diámetro de entre 3 mm y 8 mm y dar forma de rosca externa de unión a la primera zona o zona apical y a la tercera zona, cabeza o módulo de cresta, j) procesar la superficie de la primera zona o zona apical mediante tratamiento químico o irradiación con iones argón o láser de femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nmy 1 nm, entre 10 m y 20 pmo entre 1 m y 2 m, k) infiltrar por inmersión en los poros de la segunda zona, zona central o cuerpo una matriz polimérica biodegradable seleccionada de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos y poliacrilamidas, donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo o cualquier combinación de las mismas, y l) depositar en la superficie de la tercera zona, cabeza o módulo de cresta nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación e las mismas. Las etapas (a) , (b) y (c) se refieren a la adición secuencial de los polvos correspondientes a las distintas zonas del implante dental de la presente invención en un molde cilindrico de diámetro al menos 2 mm mayor que el diámetro del implante y que comprende una sufridera en su interior. Preferiblemente las etapas (a) , (b) y (c) se llevan a cabo independientemente, sin vibración y con una compactación manual posterior mediante punzón para que la superficie del polvo quede plana antes de recibir la siguiente capa de polvo. Nótese que, para aportar porosidad a la segunda zona en la etapa (b) , se utiliza un espaciador de (NH4) HC03. En la etapa (b) del procedimiento de la invención se añade en el molde una mezcla homogénea de un polvo seleccionado de entre Ti, Ti6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03, sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v. Dicho espaciador se elimina tras la etapa (d) de compactación del conjunto de polvos estratificados obtenido en la etapa (c) y tras la etapa de extracción ? de la preforma cilindrica del polvo compactado obtenido en la etapa (d) junto con la sufridera del molde cilindrico, en dos etapas: las etapas (f) y (g) . La eliminación del espaciador se lleva a cabo en dos etapas (f) y (g) para evitar la desintegración o la formación de grietas en la preforma en verde debido a una tasa de evaporación excesivamente elevada si se realizara en una sola etapa. En la etapa (f) se elimina el espaciador de (NH4) HC03 calentando la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 600C y 700C y una presión de entre 8 Pa y 12 Pa, durante un periodo de tiempo de entre 11 h y 13 h . Preferiblemente dicha etapa (f) se lleva a cabo en estufa. En la etapa (g) se continúa eliminando el espaciador de (NH4) HC03 calentando la preforma cilindrica que se encuentra en el interior de un contenedor obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 Pa y 12 Pa, durante un periodo de tiempo de entre 11 h y 13 h. Preferiblemente dicha etapa (g) se lleva a cabo en la misma estufa que en la etapa (f) . La etapa (h) se refiere a la sinterización la preforma cilindrica obtenida en la etapa (g) en un horno. Dicha sinterización se lleva a cabo a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y 130 min, y a una presión de de entre 0, 04 Pa y 0, 06 Pa. Tras la sinterización se obtiene un cilindro de diámetro de entre 3 mm y 8 mm que comprende una primera zona o zona apical, una segunda zona, zona central o cuerpo y una tercera zona, cabeza o módulo de cresta, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. La etapa (i) del procedimiento de la presente invención se refiere a mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado, concretamente para obtener un cilindro de diámetro de entre 3 mm y 8 mm y para dar forma de rosca externa de unión a la primera zona o zona apical y a la tercera zona cabeza o módulo de cresta. La primera zona o zona apical está mecanizada en forma de rosca externa de unión para unirse al hueso de la cavidad bucal. La tercera zona, cabeza o módulo de cresta está mecanizada en forma de rosca externa de unión para unirse al hueso de la cavidad bucal. Nótese que la tercena zona, cabeza o módulo de cresta incorpora un pilar protésico fijado con un tornillo configurado para acoplar una corona artificial. La etapa (j) del procedimiento de la presente invención se refiere a procesar la superficie de la primera zona o zona apical mediante tratamiento químico, irradiación con iones argón o láser femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y 20 m o entre 1 m y 2 m garantizando la integridad del implante dental durante su implantación (atornillado) y favoreciendo la posterior osteointegración. En una realización preferida del procedimiento de la presente invención el procesado de la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante irradiación con iones de argón de energía de entre 0, 5 keV y 1 keV en un ángulo de incidencia del haz de entre 0 ° y 75 ° respecto de la normal a la superficie. En otra realización preferida del procedimiento de la presente invención el procesado e la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante ataque químico sumergiendo la primera zona o zona apical (4) en una solución que se encuentra a una temperatura de entre 480C y 520C que comprende ácido fluorhídrico en una concentración de entre 20 ml/l y 24 ml/l y un inhibidor orgánico en un concentración de entre 45 ml/l y 55 ml/l, durante un periodo de tiempo de 120 s y 130 s, preferiblemente el inhibidor orgánico es alcohol propargil, . En otra realización preferida del procedimiento de la presente invención, el procesado de la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante irradiación con un láser de femtosegundos, de pulsos preferiblemente 396 fs en una frecuencia de repetición preferiblemente de 100 kHz, que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 pJ. El uso de irradiación para el procesado de la superficie de la primera zona o zona apical supone una ventaja frente al tratamiento químico puesto que es un procesado respetuoso con el medio ambiente, escalable a la fabricación de gran volumen y grandes superficies, así como interfaces. La segunda zona, zona central o cuerpo tiene una porosidad en una proporción de entre 30 % v/v y 50 % v/v caracterizada por técnicas de análisis de imagen automático o por microtomografía. Dicha segunda zona, zona central o cuerpo muestra una distribución homogénea de poros interconectados y un tamaño de poros de entre 100my 200 m de diámetro. En dicha segunda zona, zona central o cuerpo los poros están rellenos por matrices poliméricas biodegradables y dichas matrices poliméricas comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas. Los poros de esta segunda zona se infiltran homogéneamente por inmersión en la etapa (k) . Las matrices poliméricas biodegradables se seleccionan de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas y dichas matrices poliméricas biodegradables comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas tales como nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquiera de sus combinaciones. La última etapa del procedimiento de la invención, la etapa (I) , se refiere a la deposición homogénea en la superficie de la tercera zona de nanopartículas con propiedades antimicrobianas de tamaño de entre 10 nm y 50 nm y seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. En una realización preferida del procedimiento de la presente invención dicha etapa de deposición (I) se lleva a cabo mediante: 11) tratamiento de la superficie de la tercera zona, cabeza o módulo de cresta (6) con una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una relación 3:1, 4:1 o7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1 12) tratamiento de silanización de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (I1) mediante inmersión en una solución seleccionada de entre aminopropiltrietoxisilano (APTES) , 3-cloropropiltrietoxisilano (CPTES) y 3-glicidiloxipropiltrietoxisilano (GPTES) , 13) inmersión de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (I2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. En la etapa (I1) se utiliza una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una relación 3:1, 4:1 o7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1. La solución piraña es explosiva ya que desprende grandes cantidades de calor, pudiendo alcanzar hasta 1200C, por lo que se prepara in situ. Las explosiones se evitan utilizando como máximo un 30 % en volumen de peróxido de hidrógeno. Para incentivar la eficiencia de la solución piraña, ésta se puede calentar a una temperatura de entre 700C y 750C. En la etapa (I3) se lleva a cabo la inmersión de la superficie de la tercera zona, cabeza o módulo de cresta tratada en la etapa (I2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. Dicha suspensión se prepara preferiblemente con reductores biocompatibles tales como los citratos o el borohidruro sódico para obtener una mayor población de nanopartículas con ropiedades antimicrobianas. Otro aspecto de la invención se refiere a un método para la reposición dental que comprende implantar en un sujeto que lo necesita el implante dental mencionado anteriormente roscando la primera zona o zona apical del implante dental al hueso y roscando el tornillo de la tercera zona, cabeza o módulo de cresta con la corona artificial. A lo largo de la descripción y las reivindicaciones la palabra "comprende" y sus variantes no pretenden excluir otras características técnicas, aditivos, componentes o pasos. Para los expertos en la materia, otros objetos, ventajas y características de la invención se desprenderán en parte de la descripción y en parte de la práctica de la invención. Los siguientes ejemplos y figuras se proporcionan a modo de ilustración, y no se pretende que sean limitativos de la presente invención. BREVE DESCRIPCIÓN DE LAS FIGURAS Fig. 1 a) Esquema del implante dental (1) y su inserción en el hueso maxilar (3) . Se distinguen los siguientes elementos: (1) Implante dental (2a) Pilar protésico (2b) Tornillo (2c) Corona artificial (3) Hueso maxilar b) Esquema del implante dental (1) que comprende (4) una primera zona o zona apical, (5) una segunda zona, zona central o cuerpo y (6) una tercera zona, cabeza o módulo de cresta, con una relación adimensional 1:3:1 entre (4) , (5) y (6) . Fig. 2 Esquema del procedimiento de fabricación de la preforma cilindrica en verde donde se utiliza: (8) Molde cilindrico de compactación (9) Sufridera (10) Polvos correspondientes a la composición de la zona apical o primera zona (11) Polvos correspondientes a la composición de la zona central o segunda zona (12) Polvos correspondientes a la composición de la cabeza o tercera zona (13) Punzón con una relación adimensional 3:6:21 entre (10) , (11) y (12) . Fig. 3 (a) Imágenes de microscopía electrónica de barrido de la superficie de la primera zona antes y después del procesado con láser de femtosegundo de la superficie y (b) Imagen obtenida mediante microscopía confocal de la superficie de la primera zona después del tratamiento con láser de femtosegundo. Fig. 4 Imágenes de microscopía electrónica de barrido de una superficie plana de la primera zona procesada por irradiación de iones argón. Fig. 5 Imágenes de microscopía electrónica de barrido de la modificación superficial de la primera zona mediante ataque químico tras una inmersión de 125 s: (a) escala 100 m y (b) escala 10 m. Fig. 6 Imágenes de microscopía electrónica de barrido de la modificación superficial de la segunda zona mediante recubrimiento del sustrato obtenido con el composite PCL/PVA 50/50 y 0, 4 % en peso de nanopartículas de Ag, a la izquierda, y PCL/PVA 80/20 y 0, 4 % en peso de nanopartículas de Ag a la derecha. Las vistas superiores se muestran en (a) y (b) y la sección transversal en (c) y (d) . Las imágenes de microscopía electrónica de barrido obtenida con electrones retrodispersados de una sección transversal porosa se representan en (e) y (f) . Fig. 7 Experimentos de inhibición utilizando un sustrato de Ti del 40% de porosidad: (a) criterios de medición, (b) resultados generales, (c) imagen después de la silanización y antes del recubrimiento con AgNPs, y (d) después del recubrimiento con AgNPs (d) . Misma barra de escala para la imagen (c) y (d) . EJEMPLOS A continuación, se ilustrará la invención mediante unos ensayos realizados por los inventores, que pone de manifiesto la efectividad del producto de la invención. La Fig. 1a) muestra un esquema del implante dental (1) , el pilar protésico (2a) , tornillo (2b) y corona artificial (2c) , y su inserción en el hueso de la cavidad bucal (3) . La Fig. 1b) muestra un esquema del implante dental (1) que comprende una primera zona o zona apical (4) , una segunda zona, zona central o cuerpo (5) y una tercera zona, cabeza o módulo de cresta (6) donde la relación adimensional entre (4) , (5) y (6) es 1:3:1. En una realización preferente las dimensiones entre (4) , (5) y (6) es 3:6:3 (cotas en mm) con un diámetro de 4 mm. Para la fabricación del implante dental (1) se llevan a cabo los siguientes pasos: - Fabricación de una preforma cilindrica en verde con tres zonas diferenciadas (4, 5, 6) que utiliza espaciadores en la segunda zona, zona central o cuerpo (5) para aportar porosidad y que comprende además una etapa de eliminación de dichos espaciadores - Sinterizado de la preforma cilindrica - Micromecanizado de la preforma cilindrica sinterizada - Modificación superficial de las distintas zonas (4, 5, 6) Fabricación de la preforma cilindrica en verde La Fig. 2 muestra un esquema del procedimiento de fabricación de la preforma cilindrica en verde donde se utiliza (8) un molde cilindrico de compactación (9) una sufridera (10) Polvos correspondientes a la composición de la zona apical o primera zona (4) (11) Polvos correspondientes a la composición de la zona central, cuerpo o segunda zona (5) (12) Polvos correspondientes a la composición de la cabeza, módulo de cresta o tercera zona (6) y (13) un punzón con una relación adimensional 3:6:21 entre (10) , (11) y (12) . Para la fabricación del implante dental se pesan las masas de polvo a emplear para cada zona (4, 5, 6) del implante dental mediante una balanza, según lo indicado en la Tabla 1. Tabla 1. Masas de polvo para fabricar las zonas apical, central y cabeza de la preforma cilindrica * espaciador para obtener mayor porosidad en la segunda zona, zona central o cuerpo (5) Para llevar a cabo una "lubricación en paredes" del molde para la compactación, se emplea una suspensión de 20 g de cera de Etileno bis estearamida (EBS) por 100 cm3 de acetona. Se ha empleado un molde cilindrico (8) de 8 mm de diámetro para obtener una preforma cilindrica de 8 mm de diámetro que permita obtener un implante dental de la invención (1) de6 mm de diámetro. En general, el molde (8) debe tener un diámetro, al menos, 2 mm mayor que el diámetro del implante dental (1) . Se coloca una sufridera (9) en el interior del molde (8) . Se vierten secuencialmente las masas de polvo correspondientes a las composiciones de la primera zona o zona apical (4) , de la segunda zona, zona central o cuerpo (5) y de la tercera zona, cabeza o módulo de cresta (6) en el interior del molde cilindrico (8) . Se compactan en una prensa mecánica, una vez colocado el punzón (13) , el conjunto de polvos estratificados (10, 11, 12) a 800 MPa y se mantiene dicha presión durante 2 minutos. Se extrae, junto con la sufridera del molde (9) , la preforma cilindrica compactada y en erde. El bicarbonato de amonio (NH4) HC03, utilizado como espaciador para crear porosidad en la segunda zona, zona central o cuerpo (5) se elimina introduciendo la preforma cilindrica en verde en un contenedor y el conjunto en una estufa, primeramente, a una temperatura a 600C durante 12 horas y, seguidamente, a una temperatura de 1200C durante otras 12 horas más. Las dos etapas anteriores se realizan a una presión de vacío 10Pa. Sinterizado de la preforma cilindrica en verde A continuación, se sinteriza la preforma cilindrica en verde en un horno, a una temperatura de 13000C durante 2 horas y en alto vacío, a 0, 05 Pa. Micromecanizado de la preforma cilindrica sinterizada En un centro de mecanizado de 5 ejes se mecaniza la preforma sinterizada, para obtener la geometría y la forma de la rosca exterior de unión de la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) mediante los procesos de cilindrado, refrentado, roscado y ranurado, con herramientas de metal duro recubiertas de TiN para aplicaciones universales y acabado fino. Modificación superficial de las zonas apical (4) , zona central (5) y cabeza (6) En un primer ensayo, la superficie de la primera zona o zona apical (4) se procesa en forma de líneas con la ayuda de un láser (Spirit 1040-4, Spectra-Physics, Santa Clara, CA, USA) de 396 femtosegundos en una frecuencia de repetición de 100 kHz que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 pJ. El área de irradiación es de 12 m con una velocidad de escaneo de 960 mm/s y un numero de repeticiones de 20. La rugosidad superficial obtenida es de Sq= 1, 5 m. La Fig. 3 muestra ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : (a) imágenes de microscopía electrónica de barrido antes y después del procesado con láser de fs de la superficie y (b) imagen obtenida ediante microscopía confocal (S Neox, Sensofar, Barcelona, España) de la superficie después del tratamiento con láser de femtosegundo. En un segundo ensayo la superficie de la primera zona o zona apical (4) se procesa en forma de líneas mediante irradiación con iones argón de energía entre 0, 5 keV y 1 keV en un ángulo de incidencia 60º respecto a la normal de la superficie. El ensayo se llevó a cabo en IMPACT experimental facility, https://doi.orq/10.1063/1.2805677. La rugosidad superficial obtenida es de Sq= 0, 93 nm. La Fig. 4 muestra ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : imagen de microscopía electrónica de barrido de una superficie plana procesada por irradiación de iones argón. En un tercer ensayo la superficie de la primera zona o zona apical (4) se procesa mediante ataque químico sumergiendo la superficie de la primera zona o zona apical (4) en una solución que se encuentra a una temperatura 50 0C y que comprende ácido fluorhídrico (HF) al 45 % en agua destilada (22 mL/L) y un inhibidor orgánico, Propargyl Alcohol (0, 5 mL/L) , durante un periodo de tiempo de 125 s. La rugosidad superficial obtenida es de Sq= 15, 2 m. En la Fig. 5 se muestran ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : microscopía electrónica de barrido de la modificación superficial de la primera zona o zona apical (4) mediante dicho ataque químico tras una inmersión de125s (a) escala 100my (b) escala 10 m. La segunda zona, zona central o cuerpo (5) tiene una porosidad en una proporción del 30 % v/v, una distribución homogénea de poros interconectados y un tamaño de poros entre 100m y 200 m de diámetro, determinado mediante el método de Arquímedes y por microtomografía computerizada (Micro CT) . La Fig. 6 muestra ensayos preliminares en sustratos de discos de composición similar a la segunda zona, zona central o cuerpo (5) : imágenes de microscopía electrónica de barrido de la modificación superficial de la segunda zona, zona central o cuerpo (5) mediante recubrimiento del sustrato obtenido con el composite PCL/PVA 50/50 y 0, 4 % en peso nanopartículas de Ag (columna izquierda) , y PCL/PVA 80/20 y 0, 4 % en peso anopartículas de Ag (columna derecha) . Las vistas superiores de la Fig. 6 se muestran en (a) y (b) y la sección transversal en (c) y (d) . Las imágenes de microscopía electrónica de barrido obtenida con electrones retrodispersados de una sección transversal porosa se representan en (e) y (f) . La superficie de la tercera zona, cabeza o módulo de cresta (6) se modifica con nanopartículas con propiedades antimicrobianas. Para ello, una pieza de titanio de porosidad 40 % se sumerge completamente en una disolución denominada "piraña", preparada a partir de una mezcla 1:7 de H2O2 (30 % v/v) y H2SO4 (70 % v/v) a 750C, durante 1 hora. La disolución cambia en unos minutos de incolora a anaranjada, debido a la aparición de óxido de titanio, acompañada de un burbujeo en toda la superficie del metal debido a la generación de oxígeno. Pasado este tiempo, se extrae la pieza de titanio con pinzas y se lava tres veces con agua destilada, acetona y se seca en corriente de nitrógeno. Una vez que la superficie de titanio ha sido funcionalizada con grupos hidroxilos (-OH) , se procede a la etapa de silanización mediante un anclaje, en el que se emplea una disolución acuosa de 3-aminopropiltrietoxisilano (APTES) , al 1 vol. %, y se mantiene a temperatura ambiente 15 minutos reaccionando. A continuación, se seca en un horno a 115 0C durante 90 minutos. Posteriormente se lavaron tres veces con agua y se secaron siguiendo el procedimiento habitual. Por otro lado, se procedió a la preparación de las correspondientes AgNPsmediante el uso de 10 mL de PEG 200 en agitación con 3, 42 g de PEG 3000 a 800C. Una vez que se alcanza la disolución completa se sube la temperatura a 400C y se adiciona de una vez 100 mg de nitrato de plata, para obtener una suspensión de color marrón. A continuación, la pieza de titanio se sumerge en la suspensión de AgNPs durante 30 minutos con objeto de que se unan al silano. La caracterización se llevó a cabo mediante microscopía electrónica SEM acoplada EDS-SEM, que proporcionó información sobre la orografía de la superficie y de su composición química. Por otro lado, la capacidad antibacteriana frente a diversas cepas de la colección española, Gram-negativa y Gram-positiva, se estudió utilizando medio Müller-Hinton y con suspensiones de TSA de bacterias enriquecidas utilizando asas estériles. Para ello, las muestras de titanio biofuncionalizadas se colocan boca abajo en contacto con la superficie rica en bacterias y se cultivan 24 h a 37 °C en condiciones aeróbicas. Los halos de inhibición se identifican al presentar una superficie más trasparente y se miden tilizando el programa ImageJ. Se hacen tres medidas para que el estudio resulte estadísticamente reproducible. En la Fig. 7 se muestran experimentos de inhibición utilizando un sustrato de Ti del 40% de porosidad: (a) criterios de medición, (b) resultados generales, (c) imagen después de la silanización y antes del recubrimiento con AgNPs, y (d) después del recubrimiento con AgNPs (d) . Misma barra de escala para la imagen (c) y (d) .
Publicaciones:
ES2958908 (16/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 20/07/2022 se realizó Registro Instancia de Solicitud
En fecha 20/07/2022 se realizó Admisión a Trámite
En fecha 20/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 27/07/2022 se realizó Superado examen de oficio
En fecha 02/09/2022 se realizó Realizado IET
En fecha 12/09/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 16/02/2024 se realizó Publicación Solicitud
En fecha 16/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
20/07/2022 - Pago Tasas IET
+ ES-2958908_A11. Un implante dental (1) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm que comprende: - una primera zona o zona apical (4) en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , garantizar la integración del implante durante su atornillado y favorecer su osteointegración, compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, y con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y20 m o entre 1 m y 2 m, - una segunda zona, zona central o cuerpo (5) con una porosidad en una proporción de entre 30 % y 50 % en volumen, situada sobre la primera zona o zona apical (4) , con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro, donde dicha segunda zona, zona central o cuerpo (5) está compuesta por Ti, Ti6Al4V o Ti3sNb7ZrsTa, y donde los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas, y donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquier combinación de las mismas, - una tercera zona, cabeza o módulo de cresta (6) en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , resistir las cargas de masticación y evitar la adhesión de bacterias perjudiciales, y compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, situada sobre la segunda zona, zona central o cuerpo (5) , donde la superficie de dicha tercera zona (4) comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas, y - un pilar protésico (2a) fijado con un tornillo (2b) situado sobre la tercena zona, cabeza o módulo de cresta (6) y configurado para acoplar una corona artificial (2c) . donde la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) ocupan el mismo volumen en el implante dental (1) , y donde el volumen de la segunda zona, zona central o cuerpo (5) es el doble del volumen de la primera zona o zona apical (4) o de la tercera zona, cabeza o módulo de cresta (6) . 2. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante irradiación de iones argón y tiene una rugosidad superficial Sq de entre 0, 9 nmy1 nm. 3. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante tratamiento químico y tiene una rugosidad superficial Sq de entre 10 m y20 m. 4. El implante según la reivindicación 1, donde la primera zona o zona apical (4) es procesada mediante irradiación con láser de femtosegundo y tiene una rugosidad superficial Sq de entre 1 m y 2 m. 5. El implante dental (1) según cualquiera de las reivindicaciones 1 a 4 donde la primera zona o zona apical (4) tiene una estructura de superficie con • ondulaciones que tienen crestas de igual o distinta altura y valles de igual o distinta profundidad.donde la distancia entre dos crestas adyacentes o dos valles adyacentes es igual o distinta, • columnas de igual o distinto diámetro y distinta o igual altura, donde dichas columnas se separan entre sí con una distancia adyacente igual o distinta, • surcos o agujeros de distinta profundidad que se separan entre sí con una distancia adyacente igual o distinta, • y cualquier combinación de los mismos. 6. Un procedimiento para fabricar el implante dental (1) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm según cualquiera de las reivindicaciones 1 a 5, caracterizado por que comprende las siguientes etapas: a) añadir un polvo seleccionado de entre Ti, Ti6Al4V o Ti35Nb7Zr5Ta en un molde cilindrico (8) de diámetro al menos 2 mm mayor que el diámetro del implante dental (1) y que comprende una sufridera (9) en su interior, b) añadir una mezcla homogénea de un polvo seleccionado de entre Ti, T¡6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03 en el molde cilindrico (8) , sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v, c) añadir un polvo seleccionado de entre Ti, T¡6Al4V o T hs^Z rsT a en el molde cilindrico (8) , sobre el polvo de la etapa (b) , d) compactar el conjunto de polvos estratificados obtenido en la etapa (c) que se encuentra dentro del molde cilindrico (8) mediante unos medios de compresión uniaxial en frío manteniendo una presión de entre 800 MPa y 1200 MPa durante un periodo de tiempo de al menos 2 minutos, e) extraer la preforma cilindrica en verde del polvo compactado obtenido en la etapa (d) junto con la sufridera (9) del molde cilindrico (8) , f) calentar la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 60 0C y 70 0C y una presión de entre 8 P a y 12 P a durante un periodo de tiempo de entre 11 h y 13h, g) calentar la preforma cilindrica, que se encuentra en el interior del contenedor, obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 P a y 12 P a durante un periodo de tiempo de entre 11 h y 13 h, h) sinterizar en un horno la preforma cilindrica obtenida en la etapa (g) a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y 130 min y a una presión de entre 0, 04 Pa y 0, 06 Pa, para obtener un cilindro de diámetro de entre 3 mm y 8 mm que comprende una primera zona o zona apical (4) , una segunda zona, zona central o cuerpo (5) y una tercera zona, cabeza o módulo de cresta (6) , donde la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo (5) es el doble del volumen de la primera zona o zona apical (4) o de la tercera zona, cabeza o módulo de cresta (6) , i) mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado para obtener un cilindro de diámetro de entre 3 mm y 8 mm y dar forma de rosca externa de unión a la primera zona o zona apical (4) y a la tercera zona, cabeza o módulo de cresta (6) , j) procesar la superficie de la primera zona o zona apical (4) mediante tratamiento químico o irradiación con iones argón o láser de femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nmy 1 nm, entre 10 m y 20 pmo entre 1 m y 2 m, k) infiltrar por inmersión en los poros de la segunda zona, zona central o cuerpo (5) una matriz polimérica biodegradable seleccionada de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos y poliacrilamidas, donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo o cualquier combinación de las mismas, y I) depositar en la superficie de la tercera zona, cabeza o módulo de cresta (6) , nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. 7. El procedimiento según la reivindicación 6, donde las etapas (a) , (b) y (c) se llevan a cabo independientemente, sin vibración y con una compactación manual posterior mediante punzón (13) . 8. El procedimiento según cualquiera de las reivindicaciones 6 o 7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante irradiación con iones de argón de energía de entre 0, 5 KeV y 1 KeV en un ángulo de incidencia del haz de entre 0 ° y 75 ° respecto a la normal de la superficie. 9. El procedimiento según cualquiera de las reivindicaciones 6 Ó7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante ataque químico sumergiendo la primera zona o zona apical (4) en una solución que se encuentra a una temperatura de entre 48 0C y 52 0C que comprende ácido fluorhídrico en una concentración de entre 20 ml/l y 24 ml/l y un inhibidor orgánico en un concentración de entre 45 ml/l y 55 ml/l, durante un periodo de tiempo de 120 s y 130 s, 10. El procedimiento según la reivindicación 9, donde el inhibidor orgánico utilizado en la etapa (j) es alcohol propargil. 11. El procedimiento según cualquiera de las reivindicaciones 6 ó 7, donde el procesado de la superficie de la primera zona o zona apical (4) de la etapa (j) se lleva a cabo mediante irradiación con un láser de femtosegundos, de pulsos de 396 fs en una frecuencia de repetición preferiblemente de 100 kHz, que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 J. 12. El procedimiento según cualquiera de las reivindicaciones 6 a 11, donde la deposición de la etapa (I) se lleva a cabo mediante li) tratamiento de la superficie de la tercera zona, cabeza o módulo de cresta (6) con una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una elación 3:1, 4:1 o 7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1 12) tratamiento de silanización de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (li) mediante inmersión en una solución seleccionada de entre aminopropiltrietoxisilano (APTES) , 3-cloropropiltrietoxisilano (CPTES) y 3-glicidiloxipropiltrietoxisilano (GPTES) , 13) inmersión de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (l2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas.
Los productos y servicios protegidos por este registro son:
A61C 8/00 - A61C 13/00 - A61C 8/00
Descripciones:
+ ES-2958908_A1 Implante dental v su procedimiento de fabricación La presente invención se refiere al implante dental que comprende tres zonas diferenciadas de distinta composición química, de distinta porosidad y distinto acabado superficial, que se puede utilizar para la reposición dental. Además, la presente invención se refiere al procedimiento pulvimetalúrgico para fabricar dicho implante dental que comprende etapas de prensado en molde, eliminación de espaciador, sinterizado, micromecanizado y modificación superficial de las distintas zonas. Por tanto, la presente invención se encuadra en el área de la Ciencia e Ingeniería de Materiales y es de interés fundamentalmente para el sector odontológico, aunque también para la industria pulvimetalúrgica, en aras de fabricar productos con un mayor valor añadido. ANTECEDENTES DE LA INVENCIÓN Los tejidos óseos presentan una estructura porosa jerarquizada y su sustitución es muy habitual en la práctica clínica, entre otros casos en implantología dental, debido a enfermedades congénitas, degenerativas, fracturas, resecciones tumorales o razones estéticas (C. Ning, L. Zhou and G. Tan, Materials Today, 19 (1) (2016) 2-3) . La reparación dental incluye el uso de implantes sintéticos, destacando entre los biomateriales metálicos el titanio comercialmente puro (c.p. Ti) y la aleación Ti6Al4V (P. Norwsky, D. Bumgardner, J. Biomedical Mat. Research, 2009; M. Navarro, A. Michiardi, O. Castaño, J.A. Planell, J. of the Royal Society Interface 5 (2008) 1137-1158; V. Goriainov, R. Cook, J. M. Latham, D. G. Dunlop and R. O. C. Oreffo, Acta Biomaterialia, 10 (10) (2014) 4043 4057; E.J. Tobin, Advanced Drug Deliver y Reviews, 112 (2017) 88-100) . A pesar de sus excelentes resultados, existen algunos problemas reconocidos que comprometen su fiabilidad: • Apantallamiento de tensiones (diferencia notable en la rigidez entre el implante y el hueso cortical, 100-110 GPa frente a 20-25 GPa, respectivamente) que provoca la reabsorción ósea (pérdida de densidad) y el aumento del riesgo de fractura del hueso adyacente al implante. • Fallos por fatiga mecánica debidos a unas características inadecuadas del aterial o del diseño del implante, así como el uso de cargas prematuras o excesivas. • Problemas relacionados con la intercara implante/hueso, que inhiben la formación de tejido óseo nuevo: a) pobre osteointegración de los implantes de titanio, se generan micro-movimientos relativos y un aflojamiento del implante a medio y largo plazo, y b) infecciones, adhesión y proliferación de bacterias, durante las intervenciones, postoperatorio y servicio del implante. En este contexto, el equilibrio entre el comportamiento biomecánico y biofuncional de los implantes dentales sigue siendo un enorme desafío para el sector biomédico. Es ampliamente reconocido por la comunidad científico-técnica, el uso de materiales porosos (WÜ2015054101A, EP3034033A, US2010081109A1, EP3034033A) para solventar el desajuste en rigidez entre el implante y el tejido óseo que pretende sustituir. Sin embargo, es muy importante el control de la porosidad en términos de contenido, tamaño, morfología y distribución (homogénea o gradiente) , que garantice la resistencia mecánica, a fatiga y desgaste, a la corrosión, así como que permita el crecimiento del hueso hacia el interior y/o infiltración de los recubrimientos superficiales, inhibiendo la adhesión y la proliferación de bacterias en la superficie de los implantes. Por tanto, es necesario desarrollar nuevos implantes dentales y/o nuevos procedimientos de producción de implantes dentales con prestaciones mejoradas. DESCRIPCIÓN DE LA INVENCIÓN La presente invención se refiere al implante dental que comprende tres zonas diferenciadas de distinta composición química, distinta porosidad (porosidad longitudinal controlada) y distinto acabado superficial, que se puede utilizar para la reposición dental. En el caso de la reposición dental con implantes, éstos fallan durante su vida en servicio, debido a varios problemas que pueden coexistir: • reabsorción ósea y el aumento de la probabilidad de fractura del hueso receptor provocada por la diferencia de rigidez entre el implante dental y el hueso cortical, • fallos por fatiga mecánica (material, tamaño y/o diseño geométrico inadecuado; cargas prematuras o excesivas en el implante; uso de criterios de tolerancia al daño en vez de los de prevención, recomendados para este tipo de aplicación) , • y aflojamiento del implante, provocada por una mala osteointegración (rugosidad superficial inadecuada, nula o pobre bioactividad e infecciones bacterianas que inhiben la formación de hueso nuevo) . Además, la presente invención se refiere a un procedimiento pulvimetalúrgico para la fabricación del implante dental de la invención, que es económico y fácilmente reproducible y que comprende etapas de - Fabricación de una preforma cilindrica en verde con tres zonas de composición diferenciadas que utiliza espaciadores para aportar porosidad longitudinal controladay que comprende además una etapa de eliminación de dichos espaciadores - Sinterizado de la preforma cilindrica - Micronizado de la preforma cilindrica - Modificación de la superficie de la superficie de las distintas zonas. Por tanto, en un primer aspecto, la presente invención se refiere a un implante dental (a partir de aquí el implante dental de la invención) con una geometría cilindrica de diámetro de entre 3 mm y 8 mm que comprende: - una primera zona o zona apical en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , garantizar la integración del implante durante su atornillado y favorecer su osteointegración, compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa, y con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y20 m o entre 1m y 2 m, - una segunda zona, zona central o cuerpo, con una porosidad en una proporción de entre 30 % v/v y 50 % v/v, situada sobre la primera zona o zona apical, con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro, donde dicha segunda zona, zona central o cuerpo está compuesta por Ti, Ti6Al4V o Ti35Nb7Zr5Ta, y donde los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas, y donde dichas matrices poliméricas biodegradables comprenden nanopartículas deAg, hidroxiapatita, vidrio bioactivo, o cualquier combinación de las mismas, - una tercera zona, cabeza o módulo de cresta en forma de rosca exterior de unión configurada para unirse al hueso de la cavidad bucal (3) , resistir las cargas de masticación y evitar la adhesión de bacterias perjudiciales, y compuesta por Ti, Ti6Al4V o Ti35Nb7Zr5Ta, situada sobre la segunda zona, zona central o cuerpo, donde la superficie de dicha tercera zona comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas, y - un pilar protésico fijado con un tornillo situado sobre la tercena zona, cabeza o módulo de cresta y configurado para acoplar una corona artificial, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen en el implante dental y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. En la presente invención, el término "rugosidad superficial Sq" se refiere al conjunto de irregularidades que posee una superficie equivalente a la desviación estándar de la distribución de la altura. En la presente invención la rugosidad superficial Sq se determina mediante microscopía electrónica de barrido y/o microscopía confocal. La primera zona o zona apical del implante dental está compuesta por Ti, T¡6Al4V o T¡35Nb7ZrsTa. Dicha primera zona o zona apical está mecanizada en forma de rosca externa de unión y está configurada para unirse al hueso de la cavidad bucal. Además, la superficie rugosa de dicha primera zona con rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y 20 m o entre 1 m y 2 m, está procesada mediante irradiación con iones argón, tratamiento químico o láser femtosegundo para modificar su rugosidad superficial garantizando la integridad del implante durante su implantación (atornillado) y favoreciendo la posterior osteointegración. En una realización preferente del implante de la presente invención, la primera zona o zona apical es procesada mediante irradiación de iones argón y tiene una rugosidad superficial Sq de entre 0, 9 nmy1 nm. En otra realización preferente del implante de la presente invención la primera zona o zona apical es procesada mediante tratamiento químico y tiene una rugosidad superficial Sq de entre 10m y20 m. En otra realización preferente del implante de la presente invención la primera zona o ona apical es procesada mediante irradiación con láser de femtosegundo y tiene una rugosidad superficial Sq de entre 1 m y 2 m. En otra realización preferente del implante dental de la presente invención la primera zona o zona apical tiene una estructura de superficie con • ondulaciones que tienen crestas de igual o distinta altura y valles de igual o distinta profundidad y donde la distancia entre dos crestas adyacentes o dos valles adyacentes es igual o distinta, • columnas de igual o distinto diámetro y distinta o igual altura, donde dichas columnas se separan entre sí con una distancia adyacente igual o distinta, • surcos o agujeros de distinta profundidad que se separan entre sí con una distancia adyacente igual o distinta, • y cualquier combinación de los mismos. generando patrones de rugosidad superficial que combinan niveles micro y nanométrico que favorecen la osteointegración del implante de la presente invención. La segunda zona, zona central o cuerpo está situada sobre la primera zona o zona apical y está compuesta por Ti, Ti6Al4V o Ti35Nb7ZrsTa. Presenta una porosidad en una proporción de entre 30 % v/v y 50 % v/v, con una distribución homogénea de poros interconectados y un tamaño de poros de entre 100 m y 200 m de diámetro dichos parámetros determinados mediante una técnica de análisis de imagen automática o por microtomografía. En dicha segunda zona los poros están rellenos por matrices poliméricas biodegradables seleccionadas de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas y dichas matrices poliméricas comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas tales como nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquiera combinación de las mismas. En la presente invención la porosidad se determina mediante el método de Arquímedes y por microtomografía computerizada (Micro CT) . La tercera zona, cabeza o módulo de cresta está compuesta por Ti, Ti6Al4V o T¡35Nb7ZrsTa. Además, la superficie de dicha tercera zona, cabeza o módulo de cresta comprende nanopartículas antimicrobianas de tamaño de entre 10 nm y 50 nm distribuidas homogéneamente por toda la superficie, seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas y por tanto configurada para evitar la adhesión de bacterias perjudiciales Dicha tercera zona, cabeza o módulo de cresta está mecanizada en forma de rosca exterior de unión y por tanto configurada para unirse al hueso de la cavidad bucal y resistir las cargas de masticación. El pilar protésico fijado con un tornillo está situado sobre la tercena zona, cabeza o módulo de cresta y está configurado para acoplar una corona artificial. En el implante de la presente invención la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen en el implante dental, y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. La principal ventaja del implante de la presente invención es que presenta un mejor equilibrio de comportamiento bio-tribomecánico y biofuncional, con respecto implantes comerciales gracias a que presenta tres zonas diferenciadas con distinta composición química, distinta porosidad y distinto acabado superficial. Por tanto, otro aspecto de la invención se refiere a un procedimiento para fabricar el implante dental de la presente invención con una geometría cilindrica de diámetro de entre 3 mm y 8 mm descrito anteriormente (a partir de aquí "el procedimiento de la invención") , que comprende las siguientes etapas: a) añadir un polvo seleccionado de entre Ti, Ti6Al4V o T¡3sNb7ZrsTa en un molde cilindrico de diámetro al menos 2 mm mayor que el diámetro del implante dental y que comprende una sufridera en su interior, b) añadir una mezcla homogénea de un polvo seleccionado de entre Ti, Ti6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03 en el molde, sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v, c) añadir un polvo seleccionado de entre Ti, Ti6Al4V o Ti35Nb7Zr5Ta en el molde cilindrico, sobre el polvo de la etapa (b) , d) compactar el conjunto de polvos estratificados obtenido en la etapa (c) que se encuentra dentro del molde cilindrico mediante unos medios de compresión uniaxial en frío manteniendo una presión de entre 800 MPa y 1200 MPa durante un periodo de tiempo de al menos 2 minutos, e) extraer la preforma cilindrica en verde del polvo compactado obtenido en la etapa (d) junto con la sufridera del molde cilindrico, f) calentar la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 60 0C y 70 0C y una presión de entre 8 Pa y 12 Pa durante un periodo de tiempo de entre 11 h y 13 h, preferiblemente en estufa, g) calentar la preforma cilindrica, que se encuentra en el interior del contenedor, obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 Pa y 12 Pa durante un periodo de tiempo de entre 11 h y 13 h, preferiblemente en estufa, h) sinterizar en un horno la preforma cilindrica obtenida en la etapa (g) a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y130 min, y a una presión de entre 0, 04 Pa y 0, 06 Pa, para obtener un cilindro de diámetro de entre 5 mm y 10 mm que comprende una primera zona o zona apical, una segunda zona, zona central o cuerpo y una tercera zona, cabeza o módulo de cresta, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta, ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta, i) mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado, para obtener un cilindro de diámetro de entre 3 mm y 8 mm y dar forma de rosca externa de unión a la primera zona o zona apical y a la tercera zona, cabeza o módulo de cresta, j) procesar la superficie de la primera zona o zona apical mediante tratamiento químico o irradiación con iones argón o láser de femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nmy 1 nm, entre 10 m y 20 pmo entre 1 m y 2 m, k) infiltrar por inmersión en los poros de la segunda zona, zona central o cuerpo una matriz polimérica biodegradable seleccionada de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos y poliacrilamidas, donde dichas matrices poliméricas biodegradables comprenden nanopartículas de Ag, hidroxiapatita, vidrio bioactivo o cualquier combinación de las mismas, y l) depositar en la superficie de la tercera zona, cabeza o módulo de cresta nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación e las mismas. Las etapas (a) , (b) y (c) se refieren a la adición secuencial de los polvos correspondientes a las distintas zonas del implante dental de la presente invención en un molde cilindrico de diámetro al menos 2 mm mayor que el diámetro del implante y que comprende una sufridera en su interior. Preferiblemente las etapas (a) , (b) y (c) se llevan a cabo independientemente, sin vibración y con una compactación manual posterior mediante punzón para que la superficie del polvo quede plana antes de recibir la siguiente capa de polvo. Nótese que, para aportar porosidad a la segunda zona en la etapa (b) , se utiliza un espaciador de (NH4) HC03. En la etapa (b) del procedimiento de la invención se añade en el molde una mezcla homogénea de un polvo seleccionado de entre Ti, Ti6Al4V o T¡35Nb7ZrsTa y un espaciador de (NH4) HC03, sobre el polvo añadido en la etapa (a) , donde la proporción en volumen de (NH4) HC03 en la mezcla es de entre 30 % v/v y 50 % v/v. Dicho espaciador se elimina tras la etapa (d) de compactación del conjunto de polvos estratificados obtenido en la etapa (c) y tras la etapa de extracción ? de la preforma cilindrica del polvo compactado obtenido en la etapa (d) junto con la sufridera del molde cilindrico, en dos etapas: las etapas (f) y (g) . La eliminación del espaciador se lleva a cabo en dos etapas (f) y (g) para evitar la desintegración o la formación de grietas en la preforma en verde debido a una tasa de evaporación excesivamente elevada si se realizara en una sola etapa. En la etapa (f) se elimina el espaciador de (NH4) HC03 calentando la preforma cilindrica en verde obtenida en la etapa (e) en el interior de un contenedor a una temperatura de entre 600C y 700C y una presión de entre 8 Pa y 12 Pa, durante un periodo de tiempo de entre 11 h y 13 h . Preferiblemente dicha etapa (f) se lleva a cabo en estufa. En la etapa (g) se continúa eliminando el espaciador de (NH4) HC03 calentando la preforma cilindrica que se encuentra en el interior de un contenedor obtenida en la etapa (f) a una temperatura de entre 1100C y 1200C y una presión de entre 8 Pa y 12 Pa, durante un periodo de tiempo de entre 11 h y 13 h. Preferiblemente dicha etapa (g) se lleva a cabo en la misma estufa que en la etapa (f) . La etapa (h) se refiere a la sinterización la preforma cilindrica obtenida en la etapa (g) en un horno. Dicha sinterización se lleva a cabo a una temperatura de entre 12500C y 13000 C durante un periodo de tiempo de entre 110 min y 130 min, y a una presión de de entre 0, 04 Pa y 0, 06 Pa. Tras la sinterización se obtiene un cilindro de diámetro de entre 3 mm y 8 mm que comprende una primera zona o zona apical, una segunda zona, zona central o cuerpo y una tercera zona, cabeza o módulo de cresta, donde la primera zona o zona apical y la tercera zona, cabeza o módulo de cresta ocupan el mismo volumen y donde el volumen de la segunda zona, zona central o cuerpo es el doble del volumen de la primera zona o zona apical o de la tercera zona, cabeza o módulo de cresta. La etapa (i) del procedimiento de la presente invención se refiere a mecanizar el cilindro obtenido en la etapa (h) mediante cilindrado, refrentado, roscado y ranurado, concretamente para obtener un cilindro de diámetro de entre 3 mm y 8 mm y para dar forma de rosca externa de unión a la primera zona o zona apical y a la tercera zona cabeza o módulo de cresta. La primera zona o zona apical está mecanizada en forma de rosca externa de unión para unirse al hueso de la cavidad bucal. La tercera zona, cabeza o módulo de cresta está mecanizada en forma de rosca externa de unión para unirse al hueso de la cavidad bucal. Nótese que la tercena zona, cabeza o módulo de cresta incorpora un pilar protésico fijado con un tornillo configurado para acoplar una corona artificial. La etapa (j) del procedimiento de la presente invención se refiere a procesar la superficie de la primera zona o zona apical mediante tratamiento químico, irradiación con iones argón o láser femtosegundo para proporcionar una rugosidad superficial Sq entre 0, 9 nm y 1 nm, entre 10 m y 20 m o entre 1 m y 2 m garantizando la integridad del implante dental durante su implantación (atornillado) y favoreciendo la posterior osteointegración. En una realización preferida del procedimiento de la presente invención el procesado de la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante irradiación con iones de argón de energía de entre 0, 5 keV y 1 keV en un ángulo de incidencia del haz de entre 0 ° y 75 ° respecto de la normal a la superficie. En otra realización preferida del procedimiento de la presente invención el procesado e la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante ataque químico sumergiendo la primera zona o zona apical (4) en una solución que se encuentra a una temperatura de entre 480C y 520C que comprende ácido fluorhídrico en una concentración de entre 20 ml/l y 24 ml/l y un inhibidor orgánico en un concentración de entre 45 ml/l y 55 ml/l, durante un periodo de tiempo de 120 s y 130 s, preferiblemente el inhibidor orgánico es alcohol propargil, . En otra realización preferida del procedimiento de la presente invención, el procesado de la superficie de la primera zona o zona apical de la etapa (j) se lleva a cabo mediante irradiación con un láser de femtosegundos, de pulsos preferiblemente 396 fs en una frecuencia de repetición preferiblemente de 100 kHz, que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 pJ. El uso de irradiación para el procesado de la superficie de la primera zona o zona apical supone una ventaja frente al tratamiento químico puesto que es un procesado respetuoso con el medio ambiente, escalable a la fabricación de gran volumen y grandes superficies, así como interfaces. La segunda zona, zona central o cuerpo tiene una porosidad en una proporción de entre 30 % v/v y 50 % v/v caracterizada por técnicas de análisis de imagen automático o por microtomografía. Dicha segunda zona, zona central o cuerpo muestra una distribución homogénea de poros interconectados y un tamaño de poros de entre 100my 200 m de diámetro. En dicha segunda zona, zona central o cuerpo los poros están rellenos por matrices poliméricas biodegradables y dichas matrices poliméricas comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas. Los poros de esta segunda zona se infiltran homogéneamente por inmersión en la etapa (k) . Las matrices poliméricas biodegradables se seleccionan de entre policaprolactona, polivinilalcohol, quitosano, poliacrilatos o poliacrilamidas y dichas matrices poliméricas biodegradables comprenden aditivos que aportan propiedades bioactivas para mejorar el crecimiento del hueso y/o propiedades antibacterianas tales como nanopartículas de Ag, hidroxiapatita, vidrio bioactivo, o cualquiera de sus combinaciones. La última etapa del procedimiento de la invención, la etapa (I) , se refiere a la deposición homogénea en la superficie de la tercera zona de nanopartículas con propiedades antimicrobianas de tamaño de entre 10 nm y 50 nm y seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. En una realización preferida del procedimiento de la presente invención dicha etapa de deposición (I) se lleva a cabo mediante: 11) tratamiento de la superficie de la tercera zona, cabeza o módulo de cresta (6) con una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una relación 3:1, 4:1 o7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1 12) tratamiento de silanización de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (I1) mediante inmersión en una solución seleccionada de entre aminopropiltrietoxisilano (APTES) , 3-cloropropiltrietoxisilano (CPTES) y 3-glicidiloxipropiltrietoxisilano (GPTES) , 13) inmersión de la superficie de la tercera zona, cabeza o módulo de cresta (6) tratada en la etapa (I2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. En la etapa (I1) se utiliza una solución piraña seleccionada de entre • una mezcla de ácido sulfúrico concentrado y peróxido de hidrógeno en una relación 3:1, 4:1 o7:1, y • una mezcla de hidróxido de amonio y peróxido de hidrógeno en una relación 3:1. La solución piraña es explosiva ya que desprende grandes cantidades de calor, pudiendo alcanzar hasta 1200C, por lo que se prepara in situ. Las explosiones se evitan utilizando como máximo un 30 % en volumen de peróxido de hidrógeno. Para incentivar la eficiencia de la solución piraña, ésta se puede calentar a una temperatura de entre 700C y 750C. En la etapa (I3) se lleva a cabo la inmersión de la superficie de la tercera zona, cabeza o módulo de cresta tratada en la etapa (I2) en una suspensión de nanopartículas con propiedades antimicrobianas y de tamaño de entre 10 nm y 50 nm seleccionadas de entre Au, Ag, óxido de grafeno y cualquier combinación de las mismas. Dicha suspensión se prepara preferiblemente con reductores biocompatibles tales como los citratos o el borohidruro sódico para obtener una mayor población de nanopartículas con ropiedades antimicrobianas. Otro aspecto de la invención se refiere a un método para la reposición dental que comprende implantar en un sujeto que lo necesita el implante dental mencionado anteriormente roscando la primera zona o zona apical del implante dental al hueso y roscando el tornillo de la tercera zona, cabeza o módulo de cresta con la corona artificial. A lo largo de la descripción y las reivindicaciones la palabra "comprende" y sus variantes no pretenden excluir otras características técnicas, aditivos, componentes o pasos. Para los expertos en la materia, otros objetos, ventajas y características de la invención se desprenderán en parte de la descripción y en parte de la práctica de la invención. Los siguientes ejemplos y figuras se proporcionan a modo de ilustración, y no se pretende que sean limitativos de la presente invención. BREVE DESCRIPCIÓN DE LAS FIGURAS Fig. 1 a) Esquema del implante dental (1) y su inserción en el hueso maxilar (3) . Se distinguen los siguientes elementos: (1) Implante dental (2a) Pilar protésico (2b) Tornillo (2c) Corona artificial (3) Hueso maxilar b) Esquema del implante dental (1) que comprende (4) una primera zona o zona apical, (5) una segunda zona, zona central o cuerpo y (6) una tercera zona, cabeza o módulo de cresta, con una relación adimensional 1:3:1 entre (4) , (5) y (6) . Fig. 2 Esquema del procedimiento de fabricación de la preforma cilindrica en verde donde se utiliza: (8) Molde cilindrico de compactación (9) Sufridera (10) Polvos correspondientes a la composición de la zona apical o primera zona (11) Polvos correspondientes a la composición de la zona central o segunda zona (12) Polvos correspondientes a la composición de la cabeza o tercera zona (13) Punzón con una relación adimensional 3:6:21 entre (10) , (11) y (12) . Fig. 3 (a) Imágenes de microscopía electrónica de barrido de la superficie de la primera zona antes y después del procesado con láser de femtosegundo de la superficie y (b) Imagen obtenida mediante microscopía confocal de la superficie de la primera zona después del tratamiento con láser de femtosegundo. Fig. 4 Imágenes de microscopía electrónica de barrido de una superficie plana de la primera zona procesada por irradiación de iones argón. Fig. 5 Imágenes de microscopía electrónica de barrido de la modificación superficial de la primera zona mediante ataque químico tras una inmersión de 125 s: (a) escala 100 m y (b) escala 10 m. Fig. 6 Imágenes de microscopía electrónica de barrido de la modificación superficial de la segunda zona mediante recubrimiento del sustrato obtenido con el composite PCL/PVA 50/50 y 0, 4 % en peso de nanopartículas de Ag, a la izquierda, y PCL/PVA 80/20 y 0, 4 % en peso de nanopartículas de Ag a la derecha. Las vistas superiores se muestran en (a) y (b) y la sección transversal en (c) y (d) . Las imágenes de microscopía electrónica de barrido obtenida con electrones retrodispersados de una sección transversal porosa se representan en (e) y (f) . Fig. 7 Experimentos de inhibición utilizando un sustrato de Ti del 40% de porosidad: (a) criterios de medición, (b) resultados generales, (c) imagen después de la silanización y antes del recubrimiento con AgNPs, y (d) después del recubrimiento con AgNPs (d) . Misma barra de escala para la imagen (c) y (d) . EJEMPLOS A continuación, se ilustrará la invención mediante unos ensayos realizados por los inventores, que pone de manifiesto la efectividad del producto de la invención. La Fig. 1a) muestra un esquema del implante dental (1) , el pilar protésico (2a) , tornillo (2b) y corona artificial (2c) , y su inserción en el hueso de la cavidad bucal (3) . La Fig. 1b) muestra un esquema del implante dental (1) que comprende una primera zona o zona apical (4) , una segunda zona, zona central o cuerpo (5) y una tercera zona, cabeza o módulo de cresta (6) donde la relación adimensional entre (4) , (5) y (6) es 1:3:1. En una realización preferente las dimensiones entre (4) , (5) y (6) es 3:6:3 (cotas en mm) con un diámetro de 4 mm. Para la fabricación del implante dental (1) se llevan a cabo los siguientes pasos: - Fabricación de una preforma cilindrica en verde con tres zonas diferenciadas (4, 5, 6) que utiliza espaciadores en la segunda zona, zona central o cuerpo (5) para aportar porosidad y que comprende además una etapa de eliminación de dichos espaciadores - Sinterizado de la preforma cilindrica - Micromecanizado de la preforma cilindrica sinterizada - Modificación superficial de las distintas zonas (4, 5, 6) Fabricación de la preforma cilindrica en verde La Fig. 2 muestra un esquema del procedimiento de fabricación de la preforma cilindrica en verde donde se utiliza (8) un molde cilindrico de compactación (9) una sufridera (10) Polvos correspondientes a la composición de la zona apical o primera zona (4) (11) Polvos correspondientes a la composición de la zona central, cuerpo o segunda zona (5) (12) Polvos correspondientes a la composición de la cabeza, módulo de cresta o tercera zona (6) y (13) un punzón con una relación adimensional 3:6:21 entre (10) , (11) y (12) . Para la fabricación del implante dental se pesan las masas de polvo a emplear para cada zona (4, 5, 6) del implante dental mediante una balanza, según lo indicado en la Tabla 1. Tabla 1. Masas de polvo para fabricar las zonas apical, central y cabeza de la preforma cilindrica * espaciador para obtener mayor porosidad en la segunda zona, zona central o cuerpo (5) Para llevar a cabo una "lubricación en paredes" del molde para la compactación, se emplea una suspensión de 20 g de cera de Etileno bis estearamida (EBS) por 100 cm3 de acetona. Se ha empleado un molde cilindrico (8) de 8 mm de diámetro para obtener una preforma cilindrica de 8 mm de diámetro que permita obtener un implante dental de la invención (1) de6 mm de diámetro. En general, el molde (8) debe tener un diámetro, al menos, 2 mm mayor que el diámetro del implante dental (1) . Se coloca una sufridera (9) en el interior del molde (8) . Se vierten secuencialmente las masas de polvo correspondientes a las composiciones de la primera zona o zona apical (4) , de la segunda zona, zona central o cuerpo (5) y de la tercera zona, cabeza o módulo de cresta (6) en el interior del molde cilindrico (8) . Se compactan en una prensa mecánica, una vez colocado el punzón (13) , el conjunto de polvos estratificados (10, 11, 12) a 800 MPa y se mantiene dicha presión durante 2 minutos. Se extrae, junto con la sufridera del molde (9) , la preforma cilindrica compactada y en erde. El bicarbonato de amonio (NH4) HC03, utilizado como espaciador para crear porosidad en la segunda zona, zona central o cuerpo (5) se elimina introduciendo la preforma cilindrica en verde en un contenedor y el conjunto en una estufa, primeramente, a una temperatura a 600C durante 12 horas y, seguidamente, a una temperatura de 1200C durante otras 12 horas más. Las dos etapas anteriores se realizan a una presión de vacío 10Pa. Sinterizado de la preforma cilindrica en verde A continuación, se sinteriza la preforma cilindrica en verde en un horno, a una temperatura de 13000C durante 2 horas y en alto vacío, a 0, 05 Pa. Micromecanizado de la preforma cilindrica sinterizada En un centro de mecanizado de 5 ejes se mecaniza la preforma sinterizada, para obtener la geometría y la forma de la rosca exterior de unión de la primera zona o zona apical (4) y la tercera zona, cabeza o módulo de cresta (6) mediante los procesos de cilindrado, refrentado, roscado y ranurado, con herramientas de metal duro recubiertas de TiN para aplicaciones universales y acabado fino. Modificación superficial de las zonas apical (4) , zona central (5) y cabeza (6) En un primer ensayo, la superficie de la primera zona o zona apical (4) se procesa en forma de líneas con la ayuda de un láser (Spirit 1040-4, Spectra-Physics, Santa Clara, CA, USA) de 396 femtosegundos en una frecuencia de repetición de 100 kHz que opera a una longitud de onda de 1040 nm y con una energía de pulso máxima de 49, 7 pJ. El área de irradiación es de 12 m con una velocidad de escaneo de 960 mm/s y un numero de repeticiones de 20. La rugosidad superficial obtenida es de Sq= 1, 5 m. La Fig. 3 muestra ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : (a) imágenes de microscopía electrónica de barrido antes y después del procesado con láser de fs de la superficie y (b) imagen obtenida ediante microscopía confocal (S Neox, Sensofar, Barcelona, España) de la superficie después del tratamiento con láser de femtosegundo. En un segundo ensayo la superficie de la primera zona o zona apical (4) se procesa en forma de líneas mediante irradiación con iones argón de energía entre 0, 5 keV y 1 keV en un ángulo de incidencia 60º respecto a la normal de la superficie. El ensayo se llevó a cabo en IMPACT experimental facility, https://doi.orq/10.1063/1.2805677. La rugosidad superficial obtenida es de Sq= 0, 93 nm. La Fig. 4 muestra ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : imagen de microscopía electrónica de barrido de una superficie plana procesada por irradiación de iones argón. En un tercer ensayo la superficie de la primera zona o zona apical (4) se procesa mediante ataque químico sumergiendo la superficie de la primera zona o zona apical (4) en una solución que se encuentra a una temperatura 50 0C y que comprende ácido fluorhídrico (HF) al 45 % en agua destilada (22 mL/L) y un inhibidor orgánico, Propargyl Alcohol (0, 5 mL/L) , durante un periodo de tiempo de 125 s. La rugosidad superficial obtenida es de Sq= 15, 2 m. En la Fig. 5 se muestran ensayos preliminares en sustratos de discos de composición similar a la primera zona o zona apical (4) : microscopía electrónica de barrido de la modificación superficial de la primera zona o zona apical (4) mediante dicho ataque químico tras una inmersión de125s (a) escala 100my (b) escala 10 m. La segunda zona, zona central o cuerpo (5) tiene una porosidad en una proporción del 30 % v/v, una distribución homogénea de poros interconectados y un tamaño de poros entre 100m y 200 m de diámetro, determinado mediante el método de Arquímedes y por microtomografía computerizada (Micro CT) . La Fig. 6 muestra ensayos preliminares en sustratos de discos de composición similar a la segunda zona, zona central o cuerpo (5) : imágenes de microscopía electrónica de barrido de la modificación superficial de la segunda zona, zona central o cuerpo (5) mediante recubrimiento del sustrato obtenido con el composite PCL/PVA 50/50 y 0, 4 % en peso nanopartículas de Ag (columna izquierda) , y PCL/PVA 80/20 y 0, 4 % en peso anopartículas de Ag (columna derecha) . Las vistas superiores de la Fig. 6 se muestran en (a) y (b) y la sección transversal en (c) y (d) . Las imágenes de microscopía electrónica de barrido obtenida con electrones retrodispersados de una sección transversal porosa se representan en (e) y (f) . La superficie de la tercera zona, cabeza o módulo de cresta (6) se modifica con nanopartículas con propiedades antimicrobianas. Para ello, una pieza de titanio de porosidad 40 % se sumerge completamente en una disolución denominada "piraña", preparada a partir de una mezcla 1:7 de H2O2 (30 % v/v) y H2SO4 (70 % v/v) a 750C, durante 1 hora. La disolución cambia en unos minutos de incolora a anaranjada, debido a la aparición de óxido de titanio, acompañada de un burbujeo en toda la superficie del metal debido a la generación de oxígeno. Pasado este tiempo, se extrae la pieza de titanio con pinzas y se lava tres veces con agua destilada, acetona y se seca en corriente de nitrógeno. Una vez que la superficie de titanio ha sido funcionalizada con grupos hidroxilos (-OH) , se procede a la etapa de silanización mediante un anclaje, en el que se emplea una disolución acuosa de 3-aminopropiltrietoxisilano (APTES) , al 1 vol. %, y se mantiene a temperatura ambiente 15 minutos reaccionando. A continuación, se seca en un horno a 115 0C durante 90 minutos. Posteriormente se lavaron tres veces con agua y se secaron siguiendo el procedimiento habitual. Por otro lado, se procedió a la preparación de las correspondientes AgNPsmediante el uso de 10 mL de PEG 200 en agitación con 3, 42 g de PEG 3000 a 800C. Una vez que se alcanza la disolución completa se sube la temperatura a 400C y se adiciona de una vez 100 mg de nitrato de plata, para obtener una suspensión de color marrón. A continuación, la pieza de titanio se sumerge en la suspensión de AgNPs durante 30 minutos con objeto de que se unan al silano. La caracterización se llevó a cabo mediante microscopía electrónica SEM acoplada EDS-SEM, que proporcionó información sobre la orografía de la superficie y de su composición química. Por otro lado, la capacidad antibacteriana frente a diversas cepas de la colección española, Gram-negativa y Gram-positiva, se estudió utilizando medio Müller-Hinton y con suspensiones de TSA de bacterias enriquecidas utilizando asas estériles. Para ello, las muestras de titanio biofuncionalizadas se colocan boca abajo en contacto con la superficie rica en bacterias y se cultivan 24 h a 37 °C en condiciones aeróbicas. Los halos de inhibición se identifican al presentar una superficie más trasparente y se miden tilizando el programa ImageJ. Se hacen tres medidas para que el estudio resulte estadísticamente reproducible. En la Fig. 7 se muestran experimentos de inhibición utilizando un sustrato de Ti del 40% de porosidad: (a) criterios de medición, (b) resultados generales, (c) imagen después de la silanización y antes del recubrimiento con AgNPs, y (d) después del recubrimiento con AgNPs (d) . Misma barra de escala para la imagen (c) y (d) .
Publicaciones:
ES2958908 (16/02/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 20/07/2022 se realizó Registro Instancia de Solicitud
En fecha 20/07/2022 se realizó Admisión a Trámite
En fecha 20/07/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 27/07/2022 se realizó Superado examen de oficio
En fecha 02/09/2022 se realizó Realizado IET
En fecha 12/09/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 16/02/2024 se realizó Publicación Solicitud
En fecha 16/02/2024 se realizó Publicación Folleto Solicitud con IET (A1)
Pagos:
20/07/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 29/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por Implante dental y su procedimiento de fabricación con el número P202230666
El registro de patente nacional por Implante dental y su procedimiento de fabricación con el número P202230666 fue solicitada el 20/07/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro Implante dental y su procedimiento de fabricación con el número P202230666 fue solicitada por UNIVERSIDAD DE SEVILLA mediante los servicios del agente Ángel Pons Ariño. El registro [modality] por Implante dental y su procedimiento de fabricación con el número P202230666 está clasificado como A61C 8/00,A61C 13/00,A61C 8/00 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes A61C 8/00,A61C 13/00,A61C 8/00.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por Implante dental y su procedimiento de fabricación con el número P202230666 está clasificado con la clasificación A61C 8/00,A61C 13/00,A61C 8/00 por lo que si se desea conocer más registros con la clasificación A61C 8/00,A61C 13/00,A61C 8/00 clicar aquí.Otras invenciones solicitadas a través del representante ÁNGEL PONS ARIÑO
Es posible conocer todas las invenciones solicitadas a través del agente ÁNGEL PONS ARIÑO entre las que se encuentra el registro patente nacional por Implante dental y su procedimiento de fabricación con el número P202230666. Si se desean conocer más invenciones solicitadas a través del agente ÁNGEL PONS ARIÑO clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por Implante dental y su procedimiento de fabricación. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente Implante dental y su procedimiento de fabricación con el número P202230666. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61
Es posible conocer todas las patentes registradas en la clase A61 (CIENCIAS MEDICAS O VETERINARIAS; HIGIENE) entre las que se encuentra la patente Implante dental y su procedimiento de fabricación con el número P202230666. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61C
Es posible conocer todas las patentes registradas en la clase A61C (TECNICA DENTAL; APARATOS O METODOS PARA HIGIENE ORAL O DENTAL) entre las que se encuentra la patente Implante dental y su procedimiento de fabricación con el número P202230666. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202230664
P202230664