- Home /
- Publicaciones de patentes /
- EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO
Patente nacional por "EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO"
Este registro ha sido solicitado por
Persona física
Contacto
- Estado: Solicitud retirada
- País:
- España
- Fecha solicitud:
- 12/05/2022
- Número solicitud:
-
P202230419
- Número publicación:
-
ES2956393
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
- Clasificación Internacional de Patentes:
- C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91
- Clasificación Internacional de Patentes de la publicación:
- C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
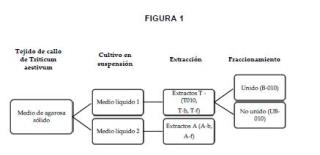
+ ES-2956393_A11. Procedimiento de extracción de polisacáridos, en adelante "procedimiento de la invención", que comprende la extracción etanólica de polisacáridos extracelulares a partir de un cultivo celular de tejido de callos embiogénicos de cereales. 2. Procedimiento de obtención de extractos de polisacáridos según reivindicación anterior, que comprende las etapas de: a) Plantar un embrión inmaduro en medio de agar sólido para obtener un callo embriogénico. b) Cultivar tejido de dicho callo embriogénico en medio de agar sólido. c) Cultivar células del paso b) en suspensión con la adición de al menos una fitohormona. d) Extracción de los polisacáridos extracelulares del paso c) mediante extracción etanólica. e) 3. Procedimiento según cualquiera de las reivindicaciones anteriores, donde el cereal utilizado es trigo 4. Procedimiento según cualquiera de las reivindicaciones anteriores, donde el cereal utilizado es Triticum aestivum. 5. Procedimiento según cualquiera de las reivindicaciones 2 a 4, que comprende una etapa adicional de fraccionamiento del extracto de polisacáridos del paso d) , para obtener el extracto alcalino. 6. Procedimiento según cualquiera de las reivindicaciones 2 a 5, donde el callo embriogénico seleccionado/obtenido en el paso a) tiene una morfología friable, preferentemente una morfología friable a largo plazo. 7. Procedimiento según cualquiera de las reivindicaciones 2 a 6 donde el cultivo del callo del paso a) se realiza durante entre 10 días y 24 meses, preferentemente entre 10 y 365 días, y más preferentemente durante 28 o 70 días. 8. Procedimiento según cualquiera de las reivindicaciones 2 a 7, donde el medio de gar sólido del paso a) es Murashige y Skoog en presencia de ácido 2, 4-didorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL. 9. Procedimiento según cualquiera de las reivindicaciones 2 a 8 donde las células del paso c) se cultivan durante entre 5 días y 6 meses. 10. Procedimiento según cualquiera de las reivindicaciones 2 a 9 donde las células del paso c) se cultivan con un fotoperiodo de 16 horas. 11. Procedimiento según cualquiera de las reivindicaciones 2 a 10, donde el medio de agar en suspensión del paso c) es Murashige y Skoog en presencia de ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente a concentración 5, 0 mg/mL. 12. Procedimiento según cualquiera de las reivindicaciones 2 a 11, donde el medio de agar en suspensión del paso c) es Murashige y Skoog en presencia de ácido abcísico a concentración de entre 0, 1 y 10 mg/mL, preferentemente a concentración 1, 0 mg/mL. 13. Extractos de polisacáridos extracelulares obtenidos mediante el procedimiento según cualquiera de las reivindicaciones 1 a 12. 14. Extractos de polisacáridos extracelulares según la reivindicación anterior, para su uso como medicamento. 15. Extractos de polisacáridos extracelulares según las reivindicaciones 13 o 14, para su uso en la mejora, alivio, prevención y/o el tratamiento del cáncer. 16. Extractos de polisacáridos extracelulares según la reivindicación anterior, donde el tipo de cáncer es cáncer colorrectal. 17. Composición farmacéutica que comprende en su formulación al menos un extracto de polisacáridos extracelulares según cualquiera de las reivindicaciones 13 a 16. 18. Composición farmacéutica según la reivindicación anterior, que comprende al enos un agente antitumoral adicional. 19. Composición farmacéutica según cualquiera de las reivindicaciones 17 o 18, que adicionalmente comprende uno o más excipientes o vehículos farmacéuticamente aceptables. 20. Composición farmacéutica según cualquiera de las reivindicaciones 17 a 19, para su uso como medicamento. 21. Composición farmacéutica según la reivindicación anterior, para su uso en la mejora, alivio, prevención y/o el tratamiento del cáncer. 22. Composición farmacéutica según la reivindicación anterior, donde el tipo de cáncer es cáncer colorrectal. 23. Extractos de polisacáridos extracelulares según las reivindicaciones 13 a 16, para su uso comen la mejora, alivio, prevención y/o tratamiento de la fibrosis. 24. Composición farmacéutica según la reivindicación 17, que comprende al menos un agente antifibrótico adicional. 25. Composición farmacéutica según cualquiera de las reivindicaciones 17 o 24, que adicionalmente comprende uno o más excipientes o vehículos farmacéuticamente aceptables. 26. Composición farmacéutica según cualquiera de las reivindicaciones 17, 24 o 25, para su uso en medicina. 27. Composición farmacéutica según la reivindicación anterior, para su uso en la mejora, alivio, prevención y/o el tratamiento de la fibrosis.
Los productos y servicios protegidos por este registro son:
C12P 19/04 - A61K 36/899 - A61K 31/715 - A61P 35/00 - C12R 1/91
Descripciones:
+ ES-2956393_A1 EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO SECTOR DE LA TÉCNICA La presente invención se encuentra dentro del campo de la biología, botánica, nutrición y biomedicina. En concreto, se refiere a la obtención de extractos de polisacáridos de origen vegetal para ser usados como agentes antitumorales y/o antifibróticos, procedentes de cereales, concretamente Trigo y más concretamente Tríticum aestivum. ANTECEDENTES DE LA INVENCIÓN A pesar de los desarrollos recientes en prevención y tratamiento, el cáncer causa millones de muertes anuales y supone una enorme carga económica a nivel mundial [1]. En 2020, el cáncer provocó 10, 0 millones de muertes en todo el mundo, entre ellas, 915.000 fueron a causa de cáncer colorrectal (CCR) [2]. Globalmente, se diagnostican entre 1 y 2 millones de nuevos casos de CCR cada año, lo que lo convierte en el tercer tipo de cáncer con más incidencia, y la cuarta causa de muerte relacionada con el cáncer [3, 4, 5]. Entre los factores de riesgo para el desarrollo de un CCR se encuentran i) la edad, ya que se diagnostica con mayor frecuencia en pacientes mayores de 50 años (90% de los casos) sin otras patologías ni enfermedades predisponentes; ii) los factores dietéticos, que juegan un papel esencial y se encuentran en continua investigación; de hecho, el consumo excesivo de alcohol, el sobrepeso y obesidad y ciertos tipos de alimentos (carne procesada) han sido vinculados a esta patología; iii) enfermedades predisponentes, especialmente la presencia de pólipos intestinales o de enfermedad intestinal inflamatoria, que hacen que estos pacientes deban ser consideradas de alto riesgo para el desarrollo de CCR; iv) la presencia de un CCR previo; v) los denominados factores genéticos o familiares, dado que en 25% de los casos existe un antecedente familiar y en el 10% un componente hereditario y vi) por último, el estilo e vida, en el que se debe destacar la inactividad física, también se han relacionado con el CCR. A pesar de que los avances recientes en el tratamiento del cáncer son prometedores, aún se requiere descubrir nuevos componentes que puedan combatirlo con menos efectos secundarios en células no cancerosas. El desarrollo de nuevas estrategias terapéuticas y de prevención abarca una gran cantidad de campos de investigación que se extienden desde la nanotecnología, la terapia génica, la inmunoterapia usando de estrategias que activan el sistema inmune o el uso de nuevos compuestos que puedan ser activos en el tratamiento del CCR o adyuvantes de las terapias actuales para la mejora de la respuesta al tratamiento. En este sentido, en las últimas décadas han sido de especial interés los compuestos extraídos de fuentes naturales [6, 7], por lo que urge explorarlos en busca de compuestos activos beneficiosos. Polisacáridos de origen natural En los últimos años ha habido un interés creciente en la exploración de nuevos compuestos derivados de fuentes naturales renovables para un tratar y prevenir el cáncer de forma segura y efectiva. Los polisacáridos (PSs) están relacionados con la clase de sustancias naturales que han sido obtenidos a partir de microorganismos, hongos, algas y plantas. Se ha demostrado tanto in vitro como in vivo que tienen propiedades antioxidantes inmunomoduladoras y efectos antitumorales [7, 8, 9]. Además, en estudios preclínicos se ha observado que la actividad biológica de los PSs naturales es capaz de disminuir el crecimiento tumoral y prolongar la supervivencia mediante estimulación inmune, apoptosis, y detención del ciclo celular [10]. En los últimos 20 años ha existido una tendencia a buscar nuevos PSs con propiedades antitumorales y que causen el mínimo daño a la célula huésped. En este sentido, los PSs aislados de plantas han sido a menudo considerados preferibles a otras fuentes debido a que son menos tóxicos y causan menos efectos secundarios [11]. Además, los PSs procedentes de plantas son macromoléculas complejas con variabilidad estructural y funcional amplia [12, 13], lo que los convierte en una molécula poderosa con multitud de efectos biológicos. Ya se ha demostrado que los PSs derivados de varias plantas (manzana, ginseng, aloe y muchas otras) tienen propiedades antitumorales, inmunomoduladoras y antioxidantes [14, 15]. La actividad antioxidante de los PSs ha mostrado tener un efecto protector frente al daño por oxidación celular, minimizando el riesgo causado por especies reactivas de oxígeno. A su vez, se conoce que muchas enfermedades crónicas (entre ellas cáncer, diabetes, enfermedades cardiovasculares, etc.) están asociadas a estrés oxidativo y los PSs actúan como eliminadores de radicales libres [16, 17]. Esta enorme magnitud de efectos beneficiosos de los PSs hace que sean altamente valiosos para prevenir y tratar el cáncer y otros muchos trastornos crónicos. Entre otros PSs de origen vegetal, las hierbas medicinales han sido investigadas con mayor frecuencia y han sido utilizadas en terapias adyuvantes contra el cáncer. Algunos de esos PSs de hongos y plantas medicinales se han utilizado para desarrollar productos farmacéuticos como lentinan, schizophyllan, Krestin, GanoPoly, astragalan, GCS-100, y PectaSol, con baja toxicidad a la vez que potente actividad antitumoral, y actualmente existen en el mercado como suplementos nutricionales o medicamentos. En Japón, China y Korea, PSs bioactivos ya han sido introducidos como adyuvantes, complementando los tratamientos estándar de radio- y quimioterapia [10]. Sin embargo, aunque todos ellos hayan mostrado un efecto anticancerígeno directo in vitro y/o in vivo, se usan preferentemente como inmunomoduladores y adyuvantes durante estos tratamientos. Este hecho probablemente se deba a que estos polisacáridos estimulan el sistema inmune a dosis bajas (0, 5-100 ^g/ml) , mientras que ese efecto directo anticancerígeno requiere dosis mucho más elevadas (40-10000 ^g/ml) (Tabla 1) . Por ejemplo, para el CRC la dosis necesaria fue de 5000 ^g/ml. El uso de PSs a concentraciones elevadas para la terapia antitumoral se encuentra comprometido por la inhibición del crecimiento de las células normales junto con las células cancerosas. Tabla 1. Comparación de los polisacáridos naturales existentes en el mercado También han sido investigadas la estructura química y características funcionales de PSs procedentes de cereales, tras ser sugeridas por su uso en alimentación, cosméticos e industria de los medicamentos [18, 19]. Hay evidencias de actividad antitumoral e inmunomoduladora en PSs de salvado de arroz [20], y recientemente se ha revelado también el efecto antitumoral de PSs de salvado de trigo [21]. Sin embargo, no existen estudios del efecto biológico de los PSs obtenidos a partir del cultivo celular de cereales. Se ha demostrado que los tejidos de callos vegetales pueden ser una fuente de PSs valiosos [22, 23]. Cultivar células vegetales es una aproximación biotecnológica que permite que se obtengan diferentes compuestos químicos con numerosas ventajas: no control de organismos, ausencia de cambios en las condiciones climáticas, homogeneidad, posibilidad de optimización, estandarización y mayor rendimiento [24]. El cultivo de tejido vegetal in vitro hace posible enfocarse en la producción de aquellos PSs que tengan un propiedades especiales [25]. Además, el cultivo de células vegetales permite la producción y regulación de la salida de fitoquímicos con biotransformación, lo que contribuye a la obtención de sustancias naturales con ctividad novedosa [26]. Callos de morfología friable Concretamente, los callos vegetales embriogénicos con morfología friable muestran características distintivas en comparación con otros tipos: células competentes embriogénicas únicas y complejos celulares embriogénicos, células con signos de muerte celular programada, y una red densa de polisacáridos en el espacio extracelular. La utilización del cultivo de callos embriogénicos de morfología friable como fuente de obtención de un cultivo en suspensión para el aislamiento de polisacáridos con actividad anticancerígena y/o antifibrótica no ha sido descrita en otras patentes o artículos. Este tipo de callos permiten regular la obtención y la composición química de los exopolisacáridos mediante el cambio del balance de fitohormonas en el medio de cultivo, lo que a su vez se correlaciona con el crecimiento, la morfogénesis y la diferenciación celular en este tipo de tejido. Mecanismos moleculares del cáncer Existen numerosos procesos que favorecen la aparición y la progresión del cáncer, entre ellos la desregulación de la apoptosis, el aumento de la proliferación celular, la incapacidad de diferenciación, o la presencia y acumulación de radicales libres. Centrarse en solucionar estas alteraciones ha sido hasta ahora el enfoque para encontrar nuevas soluciones y tratamientos que permitan frenar y hacer retroceder a esta enfermedad hasta su eliminación. Es ampliamente conocido que la apoptosis, la muerte celular programada de tipo I, es un mecanismo esencial para mantener el balance entre la muerte celular y la proliferación. Su desregulación suele ocasionar la progresión de células cancerosas. Notablemente, muchas células cancerosas parecen resistir los mecanismos de señalización de la apoptosis, sugiriendo la necesidad de buscar compuestos que induzcan la apoptosis en estas células [27, 28]. Las células que sufren este proceso se caracterizan porque su cromatina se condensa y desfragmenta [29], las mitocondrias se agrandan y dañan y sus membranas internas se desorganizan, aparece una gran cantidad de vacuolas autofágicas con partículas en su interior, el aparato de Golgi se hincha, desaparece la membrana nuclear, y aparecen ampollas y cuerpos multilaminares. Existen dos rutas que desencadenan apoptosis: la ruta intrínseca o mitocondrial, y la ruta extrínseca a través de receptores de muerte. Ambas rutas llevan a la activación de caspasas, y provocan cambios intracelulares como la condensación de la cromatina, fragmentación del DNA, formación de ampollas en la membrana y encogimiento de las células [30, 31]. Hay multitud de rutas de señalización por las que puede tener lugar la apoptosis, involucrando a p53, Bcl-2, NFkB, MAPK y otras proteínas relacionadas [27]. Se ha reportado que el efecto citotóxico de los PSs procedentes de plantas se consigue a través de uno o más mecanismos: MAPK, NF kB, JNK, p38, p53, PARP, etc. [32, 33, 34]. Concretamente, en la ruta de activación intrínseca participan proteínas de la familia Bcl-2 [35], entre ellas Bax, que lleva a la liberación del citocromo C de la mitocondria al citoplasma [36], seguido de la activación de la caspasa 9 y finalmente la caspasa que ejecuta la apoptosis, la caspasa 3. Por otro lado, la ruta extrínseca, que ocurre con la activación de los receptores de muerte (Fas, TNFR-I, TRAIL, etc.) , sigue con la activación de la caspasa 8, que desencadena la apoptosis a través de la caspasa 3 [37]. En cuanto a la inhibición del crecimiento celular, suele asociarse a la disminución de los niveles de beta-catenina [38, 39], lo que ocasionaría el bloqueo de la ciclina D1 y la ruta de genes APC (adenomatous polyposis coli) ; y a la disminución de la proteína c-Myc [40]. Esto último causa un cambio en las células tumorales para volverse más diferenciadas, y con ello creciendo a tasa menores [41, 42]. También se han relacionado los procesos de diferenciación con la disminución de los niveles de CD44. En general, el arresto del ciclo celular contribuye a la diferenciación, pero sin ser un elemento últimamente necesario para la misma, sino acompañado de la regulación a la baja de ciclinas o la activación de inhibidores de quinasas dependientes de ciclinas (cyclin dependent kinases, CDKs) [43]. Además de en la ruta intrínseca de la apoptosis, también se ha relacionado al citocromo C con la diferenciación celular, usualmente acompañado de la rotura de caspasas, pero sin causar la muerte celular [44]. También se ha detectado que el receptor de CD44 está relacionado con la progresión de las células de cáncer colorrectal y parece ser un indicador prometedor para el ronóstico de esta enfermedad [45]. La expresión de CD44 puede correlacionarse con la ruta Wnt y la transición epitelial-mesenquimal. Además, CD44 es un biomarcador de células madre cancerosas (cancer stem cells, CSCs) en algunos tumores y se considera que contribuye al crecimiento del cáncer y a la metástasis [46]. Se ha demostrado que se puede inducir la diferenciación de las CSC en mama con el noqueo de CD44, ocasionando la pérdida del fenotipo CSC junto con la reducción de la expresión de las proteínas Bcl-2, Muc-1 y la consecuente reducción de metástasis y tumorigénesis [47]. Existen también proteínas frecuentemente asociadas a la progresión del cáncer, como ocurre con NFkB. Esta proteína es ampliamente utilizada por las células como regulador de los genes que controlan la proliferación y supervivencia celular. Una sobreactivación del gen asociado lleva a la protección y la inducción de la proliferación de las células, que normalmente deberían morir por apoptosis, mientras que su inhibición aumenta la susceptibilidad de las células a la apoptosis. Hay dos tipos de rutas de NFkB, que se activan de forma diferente e inducen la activación de genes distintos: ruta clásica, de NFkB 1 a través de las proteínas p65/p50; y ruta alternativa, de NFkB 2 a través de las proteínas p100/p52 [48]. Ambos mecanismos son importantes en la tumorigénesis, aunque la ruta alternativa no se ha investigado en profundidad en el caso de células de cáncer colorrectal. Además, existen fármacos antitumorales que se han probado para inhibir la ruta clásica de NFkB, y no tantos para la ruta alternativa [49], lo que deja abierta la posibilidad de hacer investigaciones y aplicaciones de nuevos fármacos [50]. Mecanismos moleculares de la fibrosis Los fibroblastos producen las proteínas estructurales de la matriz extracelular (MEC) , como colágeno fibrilar y elastina, proteínas adhesivas, como laminina y fibronectina, y la sustancia fundamental, que comprende glicosaminoglicanos como el ácido hialurónico, y glicoproteínas. Sin embargo, los fibroblastos también juegan varios papeles adicionales más allá de la producción de MEC. Por ejemplo, participan en el mantenimiento y reabsorción de la MEC, cicatrización de heridas, inflamación, angiogénesis, progresión del cáncer y en la fibrosis tisular tanto fisiológica como patológica. De manera auxiliar, los fibroblastos producen y responden a un amplio rango de señales paracrinas y autocrinas, como citoquinas y factores de crecimiento. Apuntar a estos eventos de señalización auxiliares es la principal estrategia que ubyace a múltiples líneas de investigación que buscan una nueva generación de tratamientos para trastornos relacionados con los fibroblastos. Los fibroblastos son células mesenquimales derivadas del tejido del mesodermo embrionario, y no están completamente diferenciados. Pueden ser activados por una variedad de señales químicas que promueven la proliferación y la diferenciación celular para derivar en miofibroblastos, con una tasa de producción de matriz aumentada. La activación de los fibroblastos juega un papel vital en la cicatrización de heridas. Sin embargo, en algunos casos y debido a razones que aún no se han esclarecido completamente, su activación se vuelve descontrolada, produciendo una respuesta fibrótica patológica que promueve múltiples enfermedades y afecta a una variedad de órganos. De hecho, la fibrosis juega un papel contribuyente muy importante en la mayoría de casos de fallo orgánico. Los ejemplos son abundantes, desde esclerosis sistémica, fibrosis pulmonar idiopática, cirrosis hepática, fibrosis renal, y la fibrosis cardiaca observada en la hipertrofia cardiaca que deriva en insuficiencia cardiaca. El rol principal de los fibroblastos en la fibrosis pulmonar se validó mediante la deleción específica del linaje del receptor TGFp tipo II [51]. Dado que los fibroblastos son un efector central en la fibrosis, se convierten en potenciales dianas terapéuticas. Una de las rutas de la actividad de los fibroblastos es la ruta Wnt, relacionada con la proliferación, migración e invasión de estas células. Por otro lado, se conoce que la galectina-3 (gal-3) es una proteína de unión a azúcares con efectos pleiotrópicos con un papel clave en la progresión de tumores, pudiendo ser un agente terapéutico [52]. Gal-3 contribuye a la sobreexpresión de c-Myc, betacatenina, relacionadas con la ruta Wnt, así como otras rutas involucradas en la tumorigénesis y además, rutas que contribuyen a mantener a las células cancerosas sin diferenciarse [53]. Se ha demostrado que la inhibición de gal-3 desencadena la acumulación de células en la fase G2/M [54], suprime la adhesión celular del tumor al endotelio y con ello previene la metástasis y los depósitos intravasculares [55]. Sin embargo, los inhibidores de gal-3 pueden utilizarse para otros fines, en particular, para prevenir la fibrosis. Esto es posible puesto que gal-3 activa multitud de factores profibróticos, promueve la proliferación y transformación de los fibroblastos, y modula la producción de colágeno. Se ha demostrado la importancia de gal-3 en la ibrogénesis de diferentes órganos, incluyendo el hígado, riñón, pulmón, y miocardio [56]. Concretamente, promueve la actividad de los fibroblastos, incluyendo la producción, secreción y maduración del colágeno [57, 58], y también estimula la secreción de las citoquinas proinflamatorias IL-1 e IL-6, así como fibronectina [59]. En investigaciones previas, los inventores pudieron identificar PSs bioactivos en cultivos en suspensión de células de cereales [60]. Exploraron la composición química y las propiedades físicas de PSs procedentes de trigo, que están representados por arabinogalactanos, y por xiloglucanos, arabinoxilanos y glucanos, de acuerdo a su composición en monosacáridos [61, 62]. Además, demostraron que la composición en monosacáridos cambiaba de forma significativa dependiendo del tipo y la concentración de fitohormonas en el medio de cultivo, así como el tiempo de cultivo en las diferentes etapas [63]. De la literatura se conoce que estos tipos de PSs se consideran aptos para su aplicación en medicina, incluido el tratamiento contra el cáncer [10]. Por lo tanto, los resultados sugieren que los arabinogalactanos [64], betaglucanos [65] y arabinoxilanos [66] tienen la capacidad de suprimir la proliferación de células cancerosas in vitro [66]. Por otro lado, experimentos previos con pectinas modificadas de cítricos, las cuales inhiben gal-3, previenen fibrosis cardiacas, inflamaciones, y otras alteraciones funcionales [67]. El estado de la técnica más cercano conocido por el solicitante se refleja en CN101705268 [68], que describe un método de extracción de polisacáridos de salvado de trigo con actividad antitumoral e inmunomoduladora. La composición de los monosacáridos extraídos consiste tan solo en arabinoxilanos, y la extracción consiste en un tratamiento de múltiples pasos: remojo en HCl, eliminación de almidón, enzimólisis con xilanasas (pasos que también modulan la composición de monosacáridos) , doble extracción con etanol, e inactivación de los productos de la enzimólisis. En la presente invención, se propone un método de extracción de PSs de cultivos celulares de trigo y su uso para el tratamiento, alivio y prevención del cáncer colorrectal y/o la fibrosis. En este método, se realizan modificaciones en la composición de fitohormonas y los tiempos de cultivo para obtener extractos con distinta composición. Los extractos obtenidos presentan baja toxicidad, lo que solventaría los problemas existentes con los tratamientos actuales, cuya actividad también perjudica a las células anas, provocando numerosos efectos secundarios. Por tanto, la utilización de extractos de PSs de cultivos celulares de trigo supone una alternativa efectiva y segura a los tratamientos actuales. BREVE DESCRIPCIÓN DE LA INVENCIÓN La presente invención se basa en la obtención y la utilización de extractos de polisacáridos de una especie vegetal del género Triticum, más concretamente, obtenidos de cultivos celulares de tejido de callos embriogénicos de la especie Triticum aestivum, en su variedad de trigo blando de primavera, para el tratamiento y la prevención del cáncer colorrectal y/o fibrosis. En contraste con los productos farmacéuticos obtenidos de hongos y plantas mencionados en los "Antecedentes de la invención" (lentinan, schizophyllan, Krestin, GanoPoly, astragalan, GCS-100 y PectaSol) , en la presente invención se han obtenido extractos de PSs cuya actividad contra las células cancerosas es efectiva a bajas concentraciones de entre 10 y 1600 ^g/ml (células de cáncer colorrectal, Tabla 1) , además de presentar una toxicidad baja para las células sanas. En consecuencia, el índice terapéutico de los extractos más efectivos se encontraría entre 9 y 70. El estado de la técnica más cercano conocido por el solicitante se refleja en CN101705268, como ya se ha mencionado en los "Antecedentes de la invención". Al compararlos con la presente invención, se encontraron las siguientes diferencias: • Fuente de obtención: en la patente CN101705268, los PSs se han aislado de salvado de trigo, que consiste en la capa exterior dura (aleurona y pericarpio) del grano maduro del cereal. Sin embargo, en la presente tecnología los polisacáridos se obtienen de un cultivo en suspensión de células de trigo capaz de mantener su potencial biosintético a largo plazo (varios años) mediante la realización de subcultivos in vitro. • Composición en monosacáridos: mientras que en la patente CN101705268 se determina que un extracto de polisacáridos de trigo con alta actividad antitumoral y baja toxicidad para el organismo consiste tan solo en arabinoxilanos (xilosa - 62, 25%, arabinosa - 33, 77%, glucosa - 4, 03%) , en la presente invención, dos de los extractos de polisacáridos con elevada actividad ntitumoral y baja toxicidad consisten principalmente en glucanos (glucosa -86-90%, arabinosa - 1, 5%, xilosa - 2-5%, galactosa - 1-2%, manosa - 1-2%, ácido glucurónico - 1%, ácido galacturónico - 1%) , como ya han publicado previamente [63]. • Método de extracción: el método de obtención de PSs en CN101705268 consiste en un tratamiento de múltiples pasos: remojo en HCl, eliminación de almidón, enzimólisis con xilanasas, doble extracción con etanol, e inactivación de los productos de la enzimólisis; mientras que el método aquí descrito requiere solo de un paso, y otro paso adicional de manera opcional, puesto que los PSs se secretan de forma natural al espacio extracelular. • Modulación de la composición de monosacáridos. En la patente CN101705268 se utilizan métodos químicos especiales para obtener la composición deseada: remojo en HCl, eliminación de almidón, enzimólisis para una adecuada bioactividad y estructura molecular. Por otro lado, en la presente invención la composición se modula usando un balance de fitohormonas óptimo y distintos tiempos de cultivo. • La actividad antitumoral de los polisacáridos obtenidos de salvado de trigo en la patente CN101705268 es complicado compararla con la obtenida con el uso de los extractos aquí descritos, dado que realizaron estudios in vivo en los que se inhibía al 50% de las células cancerosas con concentraciones de 400 mg/kg y 10 mg/kg, y esta tecnología se testeó in vitro, donde el rango de IC50 se encontraba entre 10 ^g/ml y 1600 ^g/ml. La presente invención se basa en: 1) El desarrollo de diferentes extractos de polisacáridos a partir de trigo blando de primavera Triticum aestivum, cultivados durante diferentes periodos de tiempo, y en presencia de diferentes fitohormonas, lo que da lugar a extractos con composiciones diferentes y distintas propiedades. Los extractos se obtienen a partir de embriones inmaduros cultivados en agar sólido durante 28 o 70 días en presencia de 2, 4-D 5, 0 mg/mL, para originar callos embriogénicos jóvenes o maduros, respectivamente, cuyas células serán cultivadas en suspensión durante una, tres o seis semanas en medio con diferentes fitohormonas: 2, 4-D 5, 0 mg/mL, o ABA 1, 0 mg/mL. Los polisacáridos se obtienen mediante extracción etanólica del medio extracelular. 2) La actividad antitumoral de los extractos de Tríticum aestivum cuando son testados en cultivos celulares de cáncer de colon humanos (células HCT-116) , utilizando como control la línea de fibroblastos de colon humanos CDD-18CO. Así mismo, se han estudiado los mecanismos de acción por los que los extractos actúan sobre las células tumorales para dilucidar las rutas moleculares que activan la muerte celular, inhiben el crecimiento celular e inducen la diferenciación celular. 3) La actividad antifibrótica de los extractos de Triticum aestivum cuando son testados en cultivos celulares de fibroblastos de colon humanos CDD-18CO. Así mismo, se han estudiado los mecanismos de acción por los que los extractos actúan sobre los fibroblastos para dilucidar las rutas moleculares que inhiben el crecimiento celular y activan la muerte celular. En definitiva, la tecnología aquí presentada muestra las siguientes ventajas técnicas respecto al estado de la técnica: • Todos los polisacáridos existentes en el mercado con propiedades anticancerígenas se obtienen de hongos y plantas medicinales que necesitan crecer en el suelo. Por lo tanto, una producción a gran escala requiere de grandes superficies, regado o, como mínimo, invernaderos. En muchos casos, hay una fuerte dependencia del clima y las estaciones. A la vez, la literatura muestra que también se pueden obtener PSs del cultivo celular de hongos. La ventaja de la presente tecnología es que permite obtener PSs durante todo el año, independientemente del clima y la estación del año, a través del cultivo celular en suspensión, en condiciones controladas (temperatura, intensidad lumínica, fotoperiodo, etc.) , sin necesitar grandes terrenos, regado o invernaderos. • La composición deseada de PSs existente en el mercado se consigue a través de una modificación química de varios pasos, seguida de una purificación también de varios pasos, lo que supone una gran inversión de tiempo y esfuerzo. Por otro lado, la presente invención es mucho más sencillo. La composición de PSs deseada se consigue simplemente cambiando el balance de fitohormonas del medio de cultivo y los tiempos de cultivo, sin necesitar hacer modificaciones químicas, y la purificación es de un solo paso gracias a ue los PSs se secretan al espacio extracelular. De acuerdo a la tecnología de obtención de PSs existente en el mercado, es necesario modificar el protocolo de aislamiento y purificación para cada especie diferente que actúe como organismo fuente. La tecnología aquí descrita funcionaría para cualquier cultivo de cereales (cebada, maíz, avena, arroz, centeno, sorgo, mijo proso) usando el cultivo de células de trigo como sistema modelo universal para cereales y hierbas. Además, la presente tecnología mejoraría la rentabilidad, además de por la simplificación del método de obtención, por la optimización, estandarización y aumento del rendimiento del mismo, así como a la posibilidad de dirigir la producción hacia los PSs deseados. Los PSs existentes en el mercado consiguen ser efectivos a través de la activación del sistema inmune, y se usan mayoritariamente como adyuvantes en los tratamientos de quimio- y radioterapia, y no como tratamiento directo, debido a su efecto negativo en células sanas. En la presente invención se ha demostrado que los PSs obtenidos del cultivo de células de trigo, preferentemente aquellos cultivados en suspensión con ácido abcísico (ABA) , actúan como inhibidores directos de las células cancerosas a concentraciones mucho más bajas que los PSs del mercado y su toxicidad en células sanas es mucho menor. Gracias a esto, los extractos más efectivos han obtenido índices terapéuticos que cumplen con los requisitos de los medicamentos antitumorales y se pueden usar a concentraciones mayores. Por último, al investigar el mecanismo de acción de los extractos de PSs de cultivos celulares de trigo, se ha visto que no solo se induce la apoptosis, sino que también se inhibe la proliferación y la diferenciación de las células. Al analizar los marcadores, se ha detectado una reducción de los niveles de betacatenina y c-Myc, con lo que la ruta Wnt/beta-catenina estaría inhibida. Estas observaciones, junto al hecho de que los PSs contienen galactosa, la cual es capaz de unirse al extremo terminal de unión de azúcares de la proteína gal-3, indican que los extractos de PSs de cultivos celulares, preferentemente aquellos cultivados en suspensión con 2, 4-diclorofenoxiacético (2, 4-D) , actúan como inhibidores de gal-3, que además de como agentes anticancerígenos, también son efectivos para la prevención de la fibrosis. BREVE DESCRIPCIÓN DE LOS DIBUJOS Para complementar la descripción que se está realizando y con objeto de ayudar a una mejor comprensión de las características de la invención, se acompaña como parte integrante de dicha descripción, un juego de dibujos en donde con carácter ilustrativo y no limitativo, se ha representado lo siguiente: Figura 1. Inhibición de la proliferación (en %) de la línea celular de cáncer de colon HCT-116 bajo la influencia de diferentes concentraciones de los extractos T-010, B-010 y UB-010. T01.- extracto completo, B-01.- extracto ácido/unido, UB-01.- extracto alcalino/no unido. Figura 2. Actividad inhibidora de los extractos de PSs en la línea celular sana CCD-18 CO en comparación con la inhibición en células de cáncer de colon HCT-116. Extractos T-010, T-b, T-f, A-b y A-f. Figura 3. Ciclo celular y apoptosis de células de cáncer de colon HCT-116 tratadas con extractos PSs de cultivos celulares de trigo . A - células sin tratar, B - extracto A-b, C - extracto T-010, D - extracto UB-010, E - extracto T-b (2xIC50) , F - extracto A-f, G - extracto T-f, H - ciclo celular, I - apoptosis, J - restos celulares. Figura 4. Micrografías en microscopio electrónico de transmisión de células HCT-116 tratadas con extractos PSs de cultivos celulares de trigo a concentraciones IC50. (Escala: a, b, e, j, k, l, m, n, o, p, q, r - 400 nm, c, d, f - 600 nm, g, h, I - 200 nm) , a - núcleos de células sin tratar, b, c - núcleos con cromatina condensada y poros nucleares, burbujas nucleares de células tratadas con el extracto T-010, d - núcleos de células tratadas con el extracto T-b, cromatina condensada, poros nucleares (2xIC50) , e - núcleos de células tratadas con el extracto A-b, f -burbujas en el espacio intercelular, entre las células tratadas con el extracto UB-01, g - mitocondrias de células sin tratar, h - mitocondrias tratadas con el extracto T-010, i - mitocondrias tratadas con el extracto T-b, j - aparato de Golgi de células sin tratar, k - aparato de Golgi hinchado en células tratadas con el extracto T-010, l - aparato de Golgi hinchado en células tratadas con el extracto A-b, m - aparato de Golgi hinchado en células tratadas con el extracto T-b, n - lisosomas y vacuola autofágica de células sin tratar, o - acumulación de múltiples vacuolas autofágicas con membrana doble y imple en células tratadas con el extracto T-010, p - acumulación de múltiples vacuolas autofágicas con membrana doble y triple, q - vesículas en células tratadas con el extracto T-b, r - vesícula autofágica grande con membrana doble en célula tratada con el extracto UB-010, A - diámetro de un corte transversal de mitocondrias, B - número de mitocondrias dañadas por imagen. N-núcleo, Np - poro nuclear, M-mitocondria, G- aparato de Golgi, L-lisosoma, av - vesícula autofágica; ALV-vesícula autofágica grande. Figura 5. Micrografías en microscopio electrónico de barrido de células HCT-116 tratadas con extractos de PSs. A: Aumento 3000x, 50^m: a - células sin tratar, b -extracto T-010, c - extracto A-b, d - extracto UB-010, e - extracto T-b a IC50, f -extracto T-b a IC50x2; Aumento 9975x, 10^m: g - células sin tratar, h - extracto T-010, i - extracto A-b, j - extracto UB-010, k - extracto T-b a IC50, l - extracto T-b a IC50x2. B - número de microvellosidades/10^m2. Figura 6. Inmunotransferencia de diferentes proteínas relacionadas con la proliferación del cáncer tras el tratamiento con diferentes extractos de PSs. La cuantificación fue normalizada con la señal de p-actina. Los datos se obtuvieron de experimentos independientes realizados por duplicado y se expresan como la media ± desviación estándar de tres experimentos independientes realizados por triplicado (****p < 0.0001, ***p < 0.001, **p < 0.01 y *p< 0.05 frente al control) . Figura 7. Esquema de la obtención de los extractos de PSs. DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Definiciones El término "extracto" en el contexto de este documento, cuando se utiliza en relación al objeto de la invención, hace referencia a una composición obtenida a partir de una especie vegetal, y su contenido comprende esencialmente polisacáridos. El término "tratamiento" o "tratar en el contexto de este documento se refieren al uso de polisacáridos según la invención en forma de extracto o composición para curar o aliviar una enfermedad, condición patológica o uno o más síntomas asociados con icha enfermedad o condición. "Tratamiento" también abarca la prevención, mejora o eliminación de las secuelas fisiológicas de la enfermedad. Concretamente, el concepto "tratar" se puede interpretar como: i. Inhibir o prevenir la enfermedad o condición patológica, es decir, detener su desarrollo; ii. Paliar síntomas o aliviar la enfermedad o la condición patológica, es decir, causa la regresión de la enfermedad o la condición patológica; iii. Estabilizar la enfermedad o la condición patológica. Así, en un primer aspecto, la invención se refiere a un procedimiento de extracción de polisacáridos, en adelante "procedimiento de la invención", que comprende la extracción etanólica de polisacáridos extracelulares a partir de un cultivo celular de tejido de callos embiogénicos de cereales. En una realización preferente, el cereal utilizado es trigo, y más preferentemente Triticum aestivum, y aún más preferentemente la variedad Kazakhstanskaya-10 En una realización particular, el procedimiento de la invención se refiere a un procedimiento de obtención de extractos de polisacáridos procedentes de cultivos celulares de cereales, que comprende las etapas de: a) Plantar un embrión inmaduro en medio de agar sólido para obtener un callo embriogénico b) Cultivar tejido de dicho callo embriogénico en medio de agar sólido c) Cultivar células del paso b) en suspensión con la adición de al menos una fitohormona d) Extracción de los polisacáridos extracelulares del paso c) mediante extracción etanólica En otra realización particular, el procedimiento cuenta con una etapa adicional de fraccionamiento del extracto de polisacáridos, para obtener el extracto alcalino. En otra realización preferente, el callo embriogénico de la etapa a) tiene una morfología friable, más preferentemente una morfología friable que se mantenga a largo plazo. En realizaciones preferidas, el procedimiento de la invención se lleva a cabo bajo las siguientes condiciones: • El callo embriogénico se cultiva durante entre 10 días y 24 meses, preferentemente entre 10 y 365 días, y más preferentemente durante 28 o 70 días, y/o • El callo embriogénico se cultiva en medio Murashige y Skoog en presencia de ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente 5, 0 mg/mL. • Las células se cultivan en medio de agar en suspensión Murashige y Skoog en presencia de al menos una de estas fitohormonas, preferentemente una de estas fitohormonas: o Ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente a 5, 0 mg/mL. o Ácido abcísico a concentración de entre 0, 1 y 10 mg/mL, preferentemente a 1, 0 mg/mL. • El cultivo para obtener las células de tejido de callo embriogénico se lleva a cabo durante un periodo de tiempo comprendido entre 5 días y 6 meses, más preferentemente durante 7, 21 o 42 días, y/o • El cultivo para obtener las células de tejido de callo embriogénico se lleva a cabo con un fotoperiodo de 16 horas. En un segundo aspecto, la invención se refiere a los extractos de polisacáridos extracelulares obtenidos u obtenibles mediante el procedimiento de la presente invención. Un tercer aspecto se refiere a la utilización de los extractos de polisacáridos en medicina, los extractos de polisacáridos para su uso como medicamento o para la fabricación de un medicamento. En una realización particular, los extractos son utilizados para la mejora, alivio, prevención y/o el tratamiento del cáncer. Preferentemente, el tipo de cáncer es cáncer colorrectal. En otra realización particular, los extractos son utilizados para la mejora, alivio, revención y/o tratamiento de la fibrosis. En un cuarto aspecto, la invención hace referencia a una composición farmacéutica que comprende en su formulación al menos un extracto de polisacáridos extracelulares de la presente invención. La composición puede comprender al menos un agente antitumoral adicional. Alternativamente, la composición puede comprender al menos un agente antifibrótico adicional. En una realización particular, la composición farmacéutica comprende uno o más excipientes o vehículos farmacéuticamente aceptables. Un último aspecto de la invención se refiere a la utilización de una composición farmacéutica según el aspecto anterior, para su uso como medicamento o para la fabricación de un medicamento. En una realización particular, la composición es utilizada para la mejora, alivio, prevención y/o el tratamiento del cáncer. Preferentemente, el tipo de cáncer es cáncer colorrectal. En otra realización particular, la composición es utilizada para la mejora, alivio, prevención y/o tratamiento de la fibrosis. Como en el caso del procedimiento de la invención, y en los otros aspectos de la invención que se describen más adelante, se prefieren las realizaciones que corresponden a extractos obtenidos a partir de trigo, preferiblemente Tríticum aestivum. A lo largo de la descripción y las reivindicaciones el término "comprende", que también podrá interpretarse como "consiste en", y sus variantes no pretenden excluir otras características técnicas, aditivos, componentes o pasos. Para los expertos en la materia, otros objetos, ventajas y características de la invención se desprenderán en parte de la descripción y en parte de la práctica de la invención. MODOS DE REALIZACIÓN Materiales y métodos Cultivo de células vegetales, extracción de polisacáridos y contenido en monosacáridos Se cultivaron células embriogénicas de callos de trigo blando de primavera (Triticum aestivum) en agar sólido (Murashige y Skoog) en presencia de 5, 0 mg/L de 2, 4-D durante cuatro semanas para obtener callos friables jóvenes, o diez semanas para obtener callos friables maduros. Después, el tejido del callo se introdujo en un medio de cultivo líquido (Murashige y Skoog) [69] en presencia de una fitohormona [63], bien 2, 4-D 5, 0 mg/L o ABA 1, 0 mg/L, siguiendo un ratio de 200 a 300 mg de tejido en 30 a 40 ml de medio. El cultivo se realizó en un agitador a 140 rpm manteniendo el callo a una temperatura de 26 ± 2 °C. Para obtener los distintos extractos, se hicieron cultivos durante 7 o 21 días para las células procedentes de callos jóvenes, y de 42 días para aquellas procedentes de callos maduros, todos ellos con un fotoperiodo de 16h. El medio líquido se filtró para eliminar las células y sus restos, y el líquido extracelular se concentró en un evaporador IKA WERKE (Alemania) para el aislamiento de los PSs. Estos fueron extraídos utilizando etanol al 70% v/v y posteriormente sometidos a una precipitación mediante centrifugación a 10.000 rpm durante 10 minutos a 8°C. Adicionalmente, se realizó un paso opcional de fraccionamiento mediante cromatografía de intercambio iónico utilizando un tampón Tris HCL en una columna de DEAE-Sepharose (Sigma, EEUU) [70], para separar los extractos en sus componentes ácidos (extracto unido) , y alcalinos (extracto no unido) . Los PSs fueron extraídos utilizando etanol al 70% v/v y posteriormente sometidos a una precipitación mediante centrifugación a 10.000 rpm durante 10 minutos a 8°C. La cantidad total de polisacáridos de todos los extractos se determinó mediante el método Dubois [71]. Los extractos, para facilitar su identificación, se nombraron T si durante el cultivo celular en suspensión estuvieron en presencia de 2, 4-D (Figura 1, medio 1) ; y A si fue en presencia de ABA (Figura 1, medio 2) . Según los tiempos de cultivo, fueron los siguientes: - Extractos T: o T-010. Cultivo a corto plazo: células de callo joven cultivadas en suspensión urante 7 días. o T-b. Cultivo a medio plazo: células de callo joven cultivadas en suspensión durante 21 días. o T-f. Cultivo a largo plazo: células de callo maduro cultivadas en suspensión durante 42 días - Extractos A: o A-b. Cultivo a corto plazo: células de callo joven cultivadas en suspensión durante 7 días. o A-f. Cultivo a largo plazo: células de callo maduro cultivadas en suspensión durante 42 días. Además, el extracto T-010 fue sometido a la etapa adicional anteriormente mencionada, de fraccionamiento en una columna DEAE-Sepharose, dando lugar a dos extractos: - Extracto B-010. Ácido, unido a la columna (bound) . - Extracto UB-010. Alcalino, no unido a la columna (unbound) . Caracterización de los extractos de polisacáridos En total, siete extractos de PSs se utilizaron para el estudio del efecto en células de CCR y su mecanismo de acción. Los extractos diferían unos de otros en términos de composición nutricional del medio de cultivo líquido (adición de 2, 4-D o ABA) , así como los tiempos de cultivo (Figura 1) , y se obtuvieron 5 extractos completos (T-010, T-b, T-f, A-b, A-f) , y 2 extractos por separación mediante cromatografía de intercambio iónico de uno de los extractos completos (UB-010, B-010) . El precipitado de cada extracto se disolvió en 0, 5 ml de agua ultrapura y se liofilizó. Para cada experimento, los extractos se diluyeron en Dulbeccos Modified Eagle Medium (DMEM; Sigma-Aldrich) para obtener las concentraciones deseadas. Líneas celulares Se obtuvieron líneas celulares de cáncer colorrectal HCT-116 y células sanas CDD-18CO de la American Type Culture Collection (ATCC) y se mantuvieron en DMEM suplementado con un 10% v/v de suero fetal bovino. La autenticidad de todas las líneas celulares fue analizada mediante identificación STR (Short-Tandem Repeat) y los pases se realizaron en menos de 6 meses. Se realizaron ensayos rutinarios de contaminación por micoplasmas. Ensayos de citotoxicidad in vitro El efecto de los extractos de PSs en la viabilidad de las células fue medido mediante un ensayo colorimétrico MTT (bromuro de 3- (4, 5-dimetiltiazol-2-ilo) -2, 5-difeniltetrazol; Sigma, EEUU) . Se sembraron 2, 5x103 células/pocillo en placas de 96 pocillos. Se incubaron durante 24 horas y luego se trataron con diferentes concentraciones de PSs. Tres días más tarde, los pocillos se aspiraron y se trataron con MTT durante 3 horas, con una posterior disolución con dimetil sulfóxido (DMSO) . Las células se analizaron usando un aparato Titertek Multiskan (Flow, Irvine, California) a 570 nm. Evaluamos la linealidad de los ensayos calculando el número de células en cada pocillo antes de cada experimento de crecimiento celular. La concentración inhibitoria del 50% (IC50) se calculó a partir de curvas dosis-respuesta semilogarítmicas mediante interpolación lineal [72]. Todos los experimentos se sembraron en pocillos por triplicado y se realizaron al menos tres veces. Apoptosis y ensayos de ciclo celular in vitro Las fases del ciclo celular (G0/G1, S o G2/M) se caracterizan por diferencias en el contenido de ADN. Dado que el tinte fluorescente yoduro de propidio (Sigma, EEUU) se une fuertemente al DNA a un ratio 1:1, la intensidad de fluorescencia por yoduro de propidio varía entre las distintas fases del ciclo celular. Las células HCT-116 fueron sembradas en placas de 6 pocillos, a una concentración de 200x103 células/pocillo, y se incubaron durante 48 horas. Posteriormente, se trataron durante 48 horas con los extractos de PSs a diferentes concentraciones, determinadas según los valores de IC50. Las células cultivadas en monocapa se recolectaron, se lavaron dos veces con PBS y se fijaron en etanol al 70% a 4°C. El sedimento celular se lavó dos veces en PBS y se resuspendió en una solución de extracción de DNA (pH = 7, 8) de ácido acético 0, 1 M, y fosfato de sodio dibásico anhidro 0, 2 M en PBS, y se incubó durante 15 minutos a 37°C. Las células sedimentaron y fueron lavadas una vez más con PBS, tras lo que se resuspendieron en una solución de PBS con yoduro de propidio 100 mg/ml y RNAsa 40 mg/ml en oscuridad durante 30 minutos a 37°C [73]. El porcentaje de células en las fases subG1, G0/G1, S and G2/M se determinó con un citómetro de flujo FACS Calibur (BD, Biosciences, EEUU) . Microscopía electrónica La línea celular HCT-116 se sembró en placas de 6 pocilios, a una concentración de 200x103 células/pocillo, y se incubaron durante 48 horas. Posteriormente, se trataron durante 48 horas con los extractos de PSs a diferentes concentraciones, determinadas según los valores del doble de IC50. Las células se lavaron con PBS frío, se fijaron y se prepararon para microscopía electrónica de transmisión (MET) de acuerdo al protocolo estándar [74]. Para microscopía electrónica de barrido (MEB) , la línea celular HCT-116 se sembró en placas de 24 pocillos, con 100x103 células/pocillo, y tras 48 horas se trataron con las mismas concentraciones de PSs durante 48h. Las células se fijaron y se prepararon muestras para MEB como se describe en [75]. Inmunotransferencia Las células HCT-116 (150000/pocillo) se sembraron en placas de 6 pocillos en medio DMEM. Tras 48 horas de tratamiento, el medio se retiró de las células, y estas se centrifugaron a 1500 rpm, se lavaron dos veces con PBS y luego se lisaron con tampón Laemmli. Se realizó una inmunotransferencia de los lisados de las células completas siguiendo los protocolos rutinarios [76]. Se utilizaron anticuerpos primarios para detectar las siguientes proteínas: • caspasa-3, dilución 1:1000 (Cell Signaling, Beverly, MA, EEUU) ; • caspasa-8, dilución 1:500 (caspase-8 (8CSP03) : sc-56070, Santa Cruz Biotechnology) ; • bax, dilución 1:500 (bax (B-9) : sc-7480, Santa Cruz Biotechnology) ; • citocromo c, dilución 1:500 (cytochrome c (7H8) : sc-13560, Santa Cruz Biotechnology) ; • p-actina, dilución 1:15000 (A2228, Sigma) ; • c-Myc, dilución 1:100 (c-Myc (9E10) : sc-40, Santa Cruz Biotechnology) ; • beta-catenina, dilución 1:100 (p-beta-catenin (1B11) : sc-57533, Santa Cruz Biotechnology) ; • NF-kB2 p100, dilución 1:1000, (NF-kB2 p100/p52, 4882, Cell signaling technology, USA) ; • CD44, dilución 1:200, (HCAM (DF1485) : sc-7297, Santa Cruz Biotechnology) Los anticuerpos secundarios utilizados incluían anti IgG de conejo conjugado con eroxidasa (Sigma, A0545) y anti IgG de ratón conjugada con peroxidasa (Sigma, A9044) - Los complejos proteína-anticuerpo se hicieron visibles usando quimioluminiscencia mejorada (ECL, Bonus, Amersham, Little Chalfont, UK) con el programa IMAGE READER LAS-4000 en un sistema LAS-4000. La interpretación de la intensidad de la señal se realizó utilizando el programa Image J. Los valores de cada banda se normalizaron dividiéndolos por el valor de su p-actina, y se relativizaron respecto a los de la muestra control, a los que se les asignó el valor 1. Análisis estadístico Los valores se expresaron como media ± desviación estándar (SD, standard deviation) . Se utilizó un test t-student para determinar la significancia de las diferencias entre los dos grupos, considerándose como significativos cuando el p-valor era menor o igual a 0, 05. Para elaborar las figuras se utilizó el programa GraphPrism 8. Resultados Efecto antiproliferativo e inhibidor selectivo de los polisacáridos de cultivos celulares de trigo en líneas de cáncer de colon Los análisis de viabilidad celular revelaron que los PSs inhiben a las células de cáncer de colon HCT-116 a diferentes dosis. Los ensayos MTT mostraron que el extracto T-010 inhibía un máximo del 47% de las células a concentraciones de 1600 |jg/ml (Figura 2) . El extracto fraccionado alcalino obtenido a partir de dicho extracto T-010, tenía un efecto antiproliferativo inhibiendo el 48% de las células a concentraciones de 1600 jg /m l. Estos valores se consideraron como IC50 dado que cualquier incremento en la concentración de los extractos no producía una mayor inhibición (Figura 3A, 3B) . Por otro lado, el extracto ácido indujo en un 40% la proliferación in vitro y fue excluido de los ensayos posteriores. El extracto T-b inhibe el 50% de las células HCT-116 a concentraciones de entre 50 jg /m l y 100 jg /m l, por lo que se ha considerado 75 jg /m l como IC50 (Figura 3C) . En cuanto a el extracto A-b, inhibe el 50% de las células a 160 jg /m l (Figure 3D) . El extracto T-f provocó la inhibición del 47% de las células a 800 jg /m l, y la muerte del 51% de las células a 1600 jg /m l. Puesto que el efecto a doble concentración es casi el mismo, se consideró como IC50 la concentración de 1600 jg /m l (Figura 3E) . El extracto A-f inhibió el 50% de células cancerosas a concentraciones de entre 10 y 80 jg /m l, y si se aumentaba de estos valores, se producía una ligera disminución de la nhibición (40-45% of inhibición) (Figura 3F) . También se determinó el valor de IC50 de cada extracto de PSs para las células de fibroblastos sanos de colon CCD-18CO. Se demostró para todos los extractos cultivados en suspensión con 2, 4-D que el efecto tóxico de los PSs en células sanas era mayor a concentraciones bajas, y disminuía cuando la concentración de PSs era mayor. Por ejemplo, el extracto T-010 inhibía el 35% de las células CCD-18CO a 50 jg /m l, sin embargo, un aumento a 100-400 |jg/ml provocaba una ligera disminución de la inhibición, a 25-27%, y a concentraciones altas se mantenía 20-22% (Figura 3A) . Por otro lado, el extracto T-b producía una inhibición de entre el 30-40% a bajas concentraciones 3, 12.- 12, 5 jg /m l, sin embargo, un aumento de la concentración (2.- 100 jg /m l) inhibió el 20-25% de las células sanas, y a 200 jg /m l se inhibía tan solo el 15% de estas células (Figura 3C) . La incubación de células sanas con el extracto T-f mostró la misma tendencia: a 50 jg /m l se observe un 36% de inhibición, mientras que en el rango de concentraciones entre 100-800 jg /m l la inhibición disminuye al 20-25%, y una mayor concentración (1600-2000 jg /m l) disminuyó ligeramente la inhibición, hasta el 12-18% (Figura 3E) . Debido a este efecto invertido, no se pudo calcular el IC50 para estas células. El extracto UB-010 causó un 30.- 47% de inhibición de las células CCD-18CO, que aumentaba según las concentraciones de 50 jg /m l hasta 1600 jg /m l, y una posterior disminución a 2000 jg /m l. El valor de IC50 de este extracto es de 800 jg /m l (Figura 3B) . Los extractos cultivados en suspensión en presencia de ABA mostraron una menor toxicidad a bajas concentraciones en comparación con las cultivadas en presencia de 2, 4-D. Por tanto, el cálculo del IC50 para estos extractos se hizo utilizando un programa GraphPrism. Por consiguiente, el IC50 para la inhibición de las células CCD-18CO se consigue a una concentración de 1480 jg /m l para el extracto A-b, y a 700 jg /m l para el extracto A-f (Figura 3D, 3F) . El efecto antiproliferativo selectivo de los extractos de PSs se estimó mediante el cálculo del índice terapéutico (Tabla 2) . *No medible: las células proliferaban NC = no calculable El índice terapéutico fue el mayor para el extracto A-f, seguido del extracto A-b (70 y 9, 25, respectivamente) . Estos extractos fueron efectivos en células cancerosas a concentraciones más bajas, y tenían un menor efecto tóxico sobre las células sanas que los extractos T-010, T-b, T-f y UB-010. Los extractos cultivados en suspensión con 2, 4-D tenían un IC50 elevado en células cancerosas, y en células sanas no pudo ser calculado. En consecuencia, no se determinó el índice terapéutico de estos extractos. Sin embargo, todos ellos mostraron que a concentraciones elevadas, su toxicidad hacia las células sanas disminuye (Figura 3) . Por ejemplo, el extracto T-b inhibe el 40-50% de células de cáncer de colon a concentraciones de entre 3 y 75 ^g/ml, y el 86% de las células a 100 ^g/ml. A su vez, este extracto inhibe el 40% de las células sanas a concentraciones bajas, pero si aumentamos la concentración a 100 ^g/ml, inhibe el 30%, y a 200 ^g/ml el 20%. Por lo tanto, para estos extractos, en lugar de calcular el índice terapéutico, los resultados se mostraron como una proporción del porcentaje de células cancerosas inhibidas a concentración IC50, dividido entre el porcentaje de células sanas inhibidas a la misma concentración. Por consiguiente, se pudo calcular que a niveles de IC50, los extractos T-010 (1600 ^g/ml) y T-f (800 ^g/ml) son, respectivamente, 2, 35 y 2, 5 veces más tóxicas para las células cancerosas que para las células sanas, y el extracto T-b a 100 ^g/ml es 2, 86 veces más tóxica para las células cancerosas que para las células sanas (Figura 3, Tabla 3) . Tabla 3. Proporción del porcentaje de células HCT-116 inhibidas a IC50 y el porcentaje de células CCD-18CO inhibidas a la misma concentración para los extractos cultivados en suspensión con 2, 4-D y no fraccionadas. Estos resultados confirman el efecto antitumoral de los PSs extraídos de cultivos celulares de trigo y su actividad antitumoral selectiva cuando se utilizan los extractos y las dosis óptimos para este fin. Existen extractos que a ciertas dosis muestran una actividad inhibidora de la proliferación incluso mayor en células de fibroblastos sanos CCD-18CO, especialmente cuando se utilizan los extractos T-010, UB-010 o T-f a dosis bajas (de hasta 100 o 400 jg /m l según el extracto) (Figura 3A, 3B, 3E) . Sería ideal dedicar unas líneas a incluir porcentajes de inhibición de estos extractos y sus concentraciones. De esta manera, se obtuvieron las primeras evidencias del potencial antifibrótico de estos extractos de polisacáridos. Inducción de la apoptosis y del arresto del ciclo celular El extracto B-010 se excluyó debido a que causaba la proliferación de las células cancerosas HCT-116 (Figura 2) . Se hicieron tests con el resto de extractos para estudiar su capacidad de inducir apoptosis y arresto del ciclo celular debido a que habían inhibido el crecimiento de las células cancerosas a la vez que eran menos tóxicas para las células sanas. Los resultados de citometría de flujo revelaron que el tratamiento de las células HCT-116 durante 48h con los extractos aumentaba la proporción de células en la fase G0/G1, y disminuía el porcentaje de células en la fase S (Figura 4) . De hecho, la proporción de células no tratadas en la fase G0/G1 era de alrededor del 60%, mientras que en las tratadas era de entre el 68% y el 74%. La influencia del extracto T-b la aumenta hasta el 74%, el extracto T-f al 69%, el extracto A-b al 70%, el extracto A-f al 71% y el extracto T-010 al 67, 5%. No hubo un cambio significativo en el porcentaje de células tratadas con el extracto UB-010 en comparación con el control. El porcentaje de células en la fase S era del alrededor del 30% en células control, mientras que en las células tratadas disminuyó a entre el 11% y el 21% (Figura 4H) . Todos los extractos disminuyeron de forma significativa el número de células en la fase S. El extracto T-b hasta el 17%, el extracto T-f al 21%, el extracto A-b al 13%, el extracto A-f al 18%, el extracto UB-010 al 20%, y el extracto T-010 al 11%. La presente investigación reveló que algunos extractos inducían la apoptosis (Figura 4I) . Los análisis de citometría de flujo mostraron que la fase apoptótica SubG1 se incrementaba cuando las células se trataban con los extractos T-b, A-b, UB-010 y T-010. Particularmente, los niveles de apoptosis más altos (48%) se obtuvieron tratando las células HCT-116 con el extracto T-010, en comparación con el control (4, 6%) . El extracto A-b mostró un efecto bastante fuerte dado que provocó muerte celular programada en el 40, 35% de las células cancerosas. Los extractos T-b y UB-010 mostraron un aumento moderado de células en la fase SubG1, del 20% y del 12, 5%, respectivamente. El porcentaje de fragmentos celulares fue también elevado en dichos extractos, de entre 20% y 60% dependiendo del extracto (Figura 4J) . Sin embargo, no se observó ningún cambio significativo en la fase SubG1 ni en la cantidad de fragmentos celulares tras el tratamiento con los extractos A-f ni T-f en comparación con el control (Figura 4I, 4J) . Microscopía electrónica de células HCT-116 tratadas con los polisacáridos de cultivos celulares de trigo Las imágenes de microscopía electrónica de transmisión revelaron cambios en el núcleo, citoplasma y el espacio intercelular de las células de cáncer de colon HCT-116 cuando se encontraban bajo la influencia de los extractos de polisacáridos de cultivos celulares de trigo (Figura 5) . Núcleo y ampollas. Tratar las células de cáncer de colon con el extracto T-010 llevó a una condensación mayor de la cromatina (Figura 5b) en comparación con las células no tratadas (Figura 5a) ; así como a la pérdida de la membrana nuclear y la presencia de ampollas junto a la célula (Figura 5c) . Cuando se incubaron con los extractos T-b y A-b, se observó que la cromatina se había fragmentado y se encontraba muy cerca de la membrana nuclear, y los poros nucleares eran muy visibles (Figura 5d, 5e) . El tratamiento con el extracto UB-010 provocó cambios similares en el núcleo, aunque la liberación de ampollas al espacio intercelular fue más intensa (Figura 5f) . Mitocondrias. Algunos extractos de polisacáridos de cultivos celulares de trigo mostraron efectos significativos en las mitocondrias, tales como daños y/o agrandamiento. En comparación con las células control (Figura 5g) , el efecto del extracto T-010 causó que las mitocondrias se agrandaran e hincharan, además de presentar sus membranas internas desorganizadas, con daños parciales, vesículas blancas casi vacías y crestas mitocondriales delgadas y apenas visibles (Figura 5h) . Por otro lado, el tratamiento con el extracto T-b también causó alteraciones (Figura 5i) : el tamaño de la mitocondria se duplicó respecto al control (Figura 5a) al visualizar cortes transversales (1000 nm frente a 500 nm) , y aumentó el número de mitocondrias dañadas y rotas (Figura 5b) . No hubo cambios perceptibles en cuanto a tamaño o daños cuando se utilizó el extracto A-b. Con el extracto UB-010, se observó un incremento moderado en el número de mitocondrias dañadas, pero no hubo cambios en su tamaño. Aparato de Golgi. En comparación con células no tratadas (Figura 5j) , el extracto T-010 indujo el hinchamiento del aparato de Golgi (Figura 5k) . El extracto A-b provocó un aumento moderado del tamaño de este orgánulo (Figura 5l) . La incubación de las células HCT-116 con el extracto T-b causó un aparato de Golgi agrandado y en degradación (Figura 5m) . No hubo cambios visibles cuando se utilizó el extracto UB-010. Otros cambios en el citoplasma. Incubar las células con el extracto T-010, al contrario que las células control (Figura 5n) , provocó la aparición de múltiples vacuolas autofágicas o cuerpos apoptóticos (400 x 400 nm y menos) junto a inclusiones de diferentes formas (Figura 5º) . El extracto A-b provocó la aparición de cuerpos multilaminares y vacuolas autofágicas con una triple membrana con inclusiones (600 x 400 nm y menos) (Figura 5p) . El efecto del extracto T-b difirió en que la célula tenía vesículas blancas vacías en el citoplasma además de vesículas con inclusiones (700 x 500 nm) o autofagosomas/autolisosomas (Figura 5q) . El extracto UB-010 contribuyó a la formación de vesículas autofágicas grandes de doble membrana (2000 x 800 nm) , que contenían múltiples orgánulos o vesículas (Figura 5r) . En general, se determine que los extractos T-010, T-b, A-b y UB-010 provocaban cambios significativos en las células cancerosas: dañando la mitocondria, ondensando la cromatina, eliminando la membrana nuclear, produciendo vesículas dentro y fuera (ampollas) de la membrana celular, y cuerpos multilaminares. Curiosamente, una variedad de vacuolas autofágicas de diferentes tamaños presentó inclusiones como gránulos y partes de orgánulos degradados. Se detectaron cambios notables en la morfología de células de cáncer de colon HCT-116 incubadas junto a los extractos T-010, A-b, T-b o UB-010 al analizarlas mediante MEB. Se observó que el efecto del extracto T-010, comparado con las células control (Figura 6A, a y b) disminuía el número de células cancerosas, provocaba que las células se aplanaran, reducía la frecuencia y longitud de las microvellosidades (Figura 6B) , y estimulaba la aparición de cuerpos apoptóticos (o hinchamiento en forma de bola de las células con pérdida de microvellosidades) (Figura 6A, c y d) . Incubar las células con el extracto A-b también modificó la morfología de las células cancerosas de manera similar a el extracto T-010, pero con hinchamiento en forma de bola de las células sin pérdida de microvellosidades. (Figura 6A, e y f) . Además de cambios similares, el extracto UB-010 contribuyó a la formación de dos tipos de cuerpos apoptóticos: con microvellosidades remanentes, y en ausencia de ellas (Figura 6A, g y h) . El tratamiento de células de cáncer de colon con el extracto T-b a concentraciones IC50 causó la aparición de cuerpos apoptóticos (Figura 6A, i y j) , pero a concentraciones elevadas, del doble de IC50, provocó que las células se secaran y solo permaneciera su membrana (Figura 6A, k y l) . Mecanismos moleculares de los extractos de polisacáridos de cultivos celulares de trigo Los ensayos de inmunotransferencia revelaron variaciones en las proteínas que participan en las rutas de apoptosis, ciclo celular y diferenciación (Figura 7) , lo que permitió predecir el mecanismo de acción de los extractos. c-Myc La expresión de la proteína c-Myc (Figura 7A) fue analizada respecto al valor relativo del control (1) . Los extractos T-f, A-f y UB-010 mostraron una disminución significativa en la expresión de esta proteína, con unos valores de 0, 6, 0, 7 y 0, 7 respectivamente. Otros extractos no provocaron ningún cambio significativo en la expresión de la proteína c-Myc. Beta-catenina Dos de los extractos (T-f y A-f) presentaron una menor expresión de beta-catenina (Figura 7B) en comparación con el valor del control (1) . El extracto T-f se redujo al 0, 5, y el extracto A-f hasta el 0, 7. El resto de extractos no mostraron cambios significativos. NFkB p100 Los extractos T-f, A-b, A-f y UB-010 redujeron la expresión de la proteína NFkB p100 (Figura 7C) , la forma temprana de la proteína NFkB p52. El extracto T-f disminuyó la expresión de esta proteína hasta un 0, 65, y los extractos A-b, A-f y UB-010 la disminuyeron hasta un 0, 8. Los extractos T-010 y T-b no tuvieron un efecto significativo en la expresión de NFkB p100. HCAM (CD44) Todos los extractos excepto T-010 provocaron una disminución significativa de la expresión de la proteína HCAM (CD44) (Figura 7D) . Los extractos T-b y UB-010 la disminuyeron hasta un valor de intensidad del 0, 5 en comparación con el control (1) . Los extractos T-f y A-b la disminuyeron hasta un 0, 2, y el extracto A-f hasta un 0, 7. Bax La activación de la proteína bax se consiguió con todos los extractos de PSs (Figura 7E) . Los extractos T-b, T-f, A-b y A-f la incrementaron hasta el doble (valor de 2) de la intensidad del control (1) . Los extractos UB-010 y T-010 provocaron un incremento mayor, del 3, 5 y del 5, 2, respectivamente. Citocromo C Los ensayos de inmunotransferencia permitieron detectar en qué medida se libera el citocromo C al citosol (Figura 7F) . La liberación fue provocada por cuatro extractos: T-b, T-f, A-b y T-010. El extracto T-b causó el doble de liberación, el extracto T-f la incrementó hasta 1, 6, el extracto A-b hasta 1, 7, y el extracto T-010 a 1, 6. Los extractos A-f y UB-010 no provocaron un cambio significativo. Caspasa3 El aumento de los valores normalizados de expresión de pro-caspasa 3 (Figura 7G) fueron mayores en comparación con el control (1) tras el tratamiento con cada uno de los extractos. Los valores obtenidos para las células tratadas con T-b, T-f, A-b, A-f, UB 010, T-010 fueron, respectivamente, de 1, 9; 2, 0; 1, 5; 1, 7; 1, 15 y 1, 25. Caspasa 8 En cuatro de los extractos, concretamente T-b, T-f, A-b y T-010, los valores de expresión de la caspasa 8 aumentaron hasta 1, 5; 1, 4; 1, 57; y 1, 3, respectivamente. Los extractos UB-010 y A-f no provocaron una mayor liberación de la caspasa 8 (Figura 7H) . Por lo tanto, todos los extractos mostraron una influencia en el aumento de la expresión de las proteínas bax y la caspasa 3. También se estableció que los extractos T-b, T-f, A-b, T-010 provocaban un aumento significativo en los niveles de citocromo C y caspasa 8. Los extractos T-f, UB-010 y A-f indujeron la reducción de la expresión de c-Myc. La expresión de beta-catenina fue inhibida por los extractos T-f y A-f. Tratar las células con los extractos A-f, T-f, UB-010 y A-b provocaron una reducción de la proteína NFkB p100. También hubo diferencias considerables en la expresión de NFkB p52 cuando se trató con los extractos B-010 y T-010 (no contemplado en las figuras) . Por último, todos los extractos disminuyeron la expresión de CD44. Discusión Es ampliamente conocido que los PSs naturales son a menudo caracterizados en base a su peso molecular, composición en monosacáridos, grupos funcionales, y enlaces químicos [77]. Todas estas características ayudan a predecir la actividad biológica de estos polisacáridos, aunque los procesos de aislamiento, purificación, y fraccionamiento pueden afectar [78]. Sin embargo, dada la dificultad de identificar con precisión la estructura de los PSs naturales debido a su complejidad y variabilidad, el análisis estructural puede omitirse para centrarse en determinar su bioactividad in vitro e in vivo [7]. Por lo tanto, en la presente invención el enfoque central ha sido determinar la importancia de las condiciones de crecimiento de los cultivos celulares para la obtención de PSs con diferentes efectos biológicos, concretamente sobre los procesos de apoptosis, diferenciación y proliferación celular. En este sentido, se obtuvieron distintos extractos de polisacáridos de cultivos en suspensión mediante la modificando los tiempos y medios de cultivo utilizando Triticum aestivum, cuyas propiedades fisicoquímicas, composición química, peso molecular, y diferencias en composición de los extractos tempranas han sido previamente studiadas [61, 62, 63]. Del resto de extractos, obtenidos tras un tiempo de cultivo mayor, no se han hecho análisis de composición de monosacáridos, siendo la prioridad conocer su actividad biológica. En estudios anteriores se ha discutido que el tiempo de cultivo celular de plantas podría alterar los compuestos químicos resultantes en el medio [79]. De hecho, cuando se cultivó arroz en suspensión durante 3 semanas, se consiguió un efecto antitumoral considerable, lo que los autores explicaron por la aparición de metabolitos secundarios durante cultivos prolongados [80]. Por lo tanto, se asumió que existiría una diferencia en la actividad de los PSs obtenidos de células de trigo cuando se cultivaran durante periodos más largos. Debido a que los diferentes extractos presentaron distintos niveles de actividad, se necesitaron diferentes dosis de las mismas para conseguir el efecto inhibidor en las células. En general, los extractos A fueron menos tóxicos para las células de fibroblastos sanos de manera dosis-dependiente, mientras que los extractos T mostraron un efecto dosis-respuesta invertido, donde las concentraciones menores inhiben en mayor medida a las células sanas, y viceversa. En este estudio se identificaron diferencias en los mecanismos de acción y en los cambios morfológicos a nivel celular que provocaban los diferentes extractos de PSs. Para la mayor parte de los extractos se pudo determinar el IC50, pudiendo conseguirse incluso a valores de concentración muy bajos, incluso de 10 ^g/ml para el extracto A-f, 160 ^g/ml para el extracto A-b, y entre 50 y 100 ^g/ml para el extracto T-b. Los extractos T-010, UB-010 y T-f mostraron un IC50 mucho más elevado (1600 ^g/ml) . En general, se encontró que los extractos A tienen índices terapéuticos considerables y eran menos tóxicos para las células sanas, y los extractos T afectaban entre 2, 35 y 2, 86 veces más a las células cancerosas que a las células sanas a concentraciones IC50. Además, durante los análisis de citometría de flujo, se reveló que el tratamiento de células de cáncer de colon con todos los extractos de polisacáridos provocaba un arresto del ciclo celular en la fase G0/G1. Además, los extractos A-f y T-f disminuyeron el porcentaje de células en la fase G2/M, mientras que los extractos A-b, UB-010 y T-010 lo aumentaron. En cuanto a los mecanismos moleculares, se hicieron ensayos de apoptosis que demostraron que los extractos A-f y T-f no provocaron cambios ni en el nivel de apoptosis ni el de fragmentación celular respecto al control. Mientras tanto, algunos extractos sí que indujeron apoptosis: tras 48h de exposición, el extracto T-010 a 1600 ^g/ml indujo apoptosis al 48% de las células; 160 ^g/ml del extracto A-b a un 40%; 1600 ^g/ml del extracto UB-010 al 13, 5%; y 100 ^g/ml del extracto T-b al 16, 7%; mientras que los controles solo presentaban un 4, 5% de apoptosis. El porcentaje de restos celulares varió entre el 20 y el 60%, mayor que en los controles (10%) . Los análisis de MET también confirmaron apoptosis en los extractos T-010, A-b, UB-010 y T-b. Se encontraron numerosos signos de apoptosis: fragmentación y condensación de la cromatina [29], mitocondrias grandes y dañadas con membranas desorganizadas, mitocondrias degradadas, vacuolas autofágicas con partículas en su interior, aparato de Golgi hinchado, ausencia de membrana nuclear, ampollas y cuerpos multilaminares. De acuerdo a los análisis de MET, la acumulación de vacuolas autofágicas con una membrana individual, doble o triple, podría significar el bloqueo de flujo autofágico, implicando que la célula está muriendo [81, 82]. Notablemente, el tamaño de las mitocondrias cambió significativamente por el extracto T-b, y el número de mitocondrias dañadas con ausencia o crestas dañadas aumentó con tres extractos (T-010, UB-010 y T-b) . Mediante MEB, se detectaron cuerpos apoptóticos y una disminución en el número de vellosidades bajo el efecto de PSs. En cuanto a los mecanismos moleculares, en este estudio se detectó el aumento de varias proteínas en células HCT-116: Bax y citocromo C liberado, relacionadas con la vía intrínseca; la caspasa 8, relacionada con la vía extrínseca; y el ejecutor final de la apoptosis de ambas rutas, la caspasa 3. Cuatro extractos, T-010, A-b, T-b y T-f, aumentaron el nivel de la caspasa 8, indicando que activan la ruta extrínseca de la apoptosis, a excepción del extracto T-f que, según los resultados de los ensayos sobre el ciclo celular, no provoca apoptosis. También se reveló que los extractos T-f y A-f inhibían la expresión de la proteína betacatenina, sugiriendo un bloqueo de la ciclina D1, la ruta génica APC, limitando la proliferación celular [38]. Estos mismos extractos, junto a el extracto UB-010, disminuyeron los niveles de c-Myc y confirmando así la inhibición del crecimiento elular en células de cáncer colorrectal HCT-116. Dado que los extractos T-f y A-f no presentaron signos de apoptosis u otro tipo de muerte celular, tendrían un rol activo en los procesos de diferenciación dada la disminución en c-Myc y beta-catenina. Estos mismos extractos también mostraron bajos niveles de CD44, confirmando este hecho. Además, también bloquean el ciclo celular en todos sus puntos: G0/G1, S y G2/M. El extracto T-f, por su parte, provocó una alta liberación de citocromo C sin causar ningún tipo de muerte celular, proteína que también puede participar en los procesos de diferenciación [44]. En cuanto a la proteína CD44, se encontró que todos los extractos excepto T-010 atenuaban su expresión, remarcando su capacidad de inducir la diferenciación de las células cancerosas, y además contribuyendo a disminuir la progresión y la metástasis. Finalmente, se demostró que los extractos T-f, A-f, A-b y UB-010 reducían los niveles de NFkB 2 p100, y T-010 y UB-010 los de la proteína p52, inhibiendo la ruta alternativa de NFkB y con ello inducirían también la diferenciación de las células cancerosas, junto a apoptosis en el caso de A-b y UB-010. En cuanto al potencial antifibrótico, los resultados obtenidos por los inventores mostraron que los extractos de PSs de cultivo celular de trigo, concretamente los extractos T-010, T-b, A-b y UB-010, inducían la acumulación de las células en la fase G2/M del ciclo celular. Además, confirmaron la apoptosis por la detección de la ruptura de las caspasas 3 y 8 en estos extractos. También mostraron que los niveles de betacatenina y c-Myc se encontraban reducidos. Por último, se ha demostrado que especialmente los extractos T-010, UB-010 y T-f inhiben el crecimiento de las células de fibroblastos CCD-18CO. Estas observaciones, junto al hecho de que los PSs contienen galactosa, la cual es capaz de unirse al extremo terminal de unión de azúcares de la proteína gal-3, indican que los extractos de PSs de cultivos celulares actúan como inhibidores de gal-3. Esto permite concluir que los diferentes extractos, los cuales se diferencian en el medio de cultivo (siendo extractos A o T) y en el tiempo de cultivo de los callos embriogénicos y posteriormente de las células en suspensión, presentan diferentes niveles de citotoxicidad y activan distintos procesos y rutas. Los extractos A tienden a ser más efectivos matando células cancerosas a concentraciones más bajas además de tener na menor citotoxicidad para las células sanas. Los extractos T necesitan de dosis más altas para combatir las células cancerosas, pero su efecto y el del extracto alcalino UB-010 en fibroblastos sanos evidencia un potencial prometedor para el tratamiento de la fibrosis. Los polisacáridos de los extractos derivados de los cultivos a corto y medio plazo inducen apoptosis mediante las vías intrínseca y extrínseca (a excepción de UB-010) , y contribuirían también a la diferenciación celular de células cancerosas. Los extractos de polisacáridos obtenidos tras el cultivo a largo plazo, inhiben las rutas APC, NFkB y reducen los niveles de CD44, sugiriendo su papel como agentes diferenciadores. Referencias 1. Diegues, G.; Ferro, C.;Pyenson, B. A Multi-Year Look at the Cost Burden of Cancer Care. New York: Millian. Inc. 2017, pp.1-4. 2. Sung, H.; Ferlay, J.; Siegel, RL.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2020. https://doi.org/10.3322/caac.21660 3. Marmol, I.; Sánchez-de-Diego C.; Pradilla Dieste A.; Cerrada E.; Rodriguez Yoldi M.J.; Colorectal Carcinoma: A General Overview and Future Perspectives in Colorectal Cancer. Int J Mol Sci. 2017, 18 (1) , 197, doi:10.3390/ijms18010197 4. Stewart, B.; Wild, C.P.; (Eds.) World Cancer Report 2014; International Agency for Research on Cancer (IARC) : Lyon, France, 2014, pp. 6-8. 5. Brody, H. Colorectal cancer. Nature.2015, 521, S1. doi: 10.1038/521S1a 6. Xu H.; Xu X. Polysaccharide, a Potential Anticancer Drug with High Efficacy and Safety. Journal of Oncology Research and Treatments, 2016, 1, 2. 7. Pang P.; Wang F.; L. Zhang. Dose matters: Direct killing or immunoregulator y effects of natural polysaccharides in cancer treatment. Carbohydrate Polymers, 2018, 195. pp. 243-256.https://doi.org/10.1016/j.carbpol.2018.04.100 8. Meng X.; Liang H.;Luo L. Antitumor polysaccharides from mushrooms: a review on the structural characteristics, antitumor mechanisms and immunomodulating activities. Carbohydr. Res.2016, 424, pp. 30-41. doi: 10.1016/j.carres.2016.02.008 9. Liu, J.; Willfor, S.; and Xu, C. A review of bioactive plant polysaccharides: biological activities, functionalization, and biomedical applications. Bioact.Carbohydr. Diet. Fibre.2015, 5, pp. 31-61. doi: 10.1016/j.ijbiomac.2016.06.086 10. KishanGopalRamawat, Jean-Michel Mérillon, Polysaccharides, bioactivity and biotechnology. Chapter 72. 2015. pp. 2179-2215. https://doi.org/10.1007/978-3-319-16298-0 11. Schepetkin I. A.; Quinn M. T. Botanical polysaccharides: macrophage immunomodulation and therapeutic potential. Int. Immunopharmacol.2006, 6, pp. 317 333. doi: 10.1016/j.intimp.2005.10.005 12. Caffall, K.H.; Mohnen, D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides. Carbohydr. Res.2009, 344, pp. 1879-1900. 13. Gorshkova, T.A.;KozlovaL.V.;Mikshina P.V. Spatial structure of plant cell wall polysaccharides and its functional significance. Biochemistr y , 2013, 78, pp. 836-853. 14. Li, N.; Wang, Ch.;Georgiev, M. I.; Bajpai, V. K.;Tundis, R.;Simal-Gandara, J.; Lu, X.;Xiao, J.;Tang, Xi.;Qiao, X.; Advances in dietar y polysaccharides as anticancer agents: Structure-activity relationship. Trends in Food Science & Technology. 2021, 111, pp. 360-377.https://doi.org/10.1016/j.tifs.2021.03.008 15. Shi J. J.; Zhang J. G.; Sun Y. H.; Qu J.; Li L.; Prasad C. et al. Physicochemical properties and antioxidant activities of polysaccharides sequentially extracted from peony seed dreg. Int. J. Biol. Macromol. 2016, 9, pp. 23-30. 10.1016/j.ijbiomac.2016.05.082 16. Mohammed, A.S.A.;Naveed, M. &Jost, N. Polysaccharides; Classification, ChemicalProperties, andFuturePerspectiveApplicationsinFieldsofPharmacologyandBiologicalMedicine (A Review of Current Applications and Upcoming Potentialities) . J PolymEnviron. 2021. https://doi.org/10.1007/s10924-021-02052-2 17. Wang, J.; Hu, S.; Nie, S.; Yu, Q.; Xie, M. Reviews on mechanisms of in vitro antioxidant activity of polysaccharides. Oxid Med Cell Longev. 2016. https://doi.org/10.1155/2016/5692852. 18. Muralikrishna, G.; SubbaRao, M. V.S.S.T. Cereal Non-Cellulosic Polysaccharides: Structure and Function Relationship - An Overview. Critical Reviews in Food Science and Nutrition. 2007. 6. pp. 599-610. 19. Cui, Steve W.; Wang, Qi, Cell wall polysaccharides in cereals: chemical structures and functional properties. Structural Chemistr y . 2009. 20:2, pp. 291-297. 20. Wang, Li; Li, Yulin; Zhu, Lidan; Yin, Ran; Wang, Ren; Luo, Xiaohu; Li, Yongfu; Li, Yanan; Chen, Zhengxing. Antitumor activities and Immunomodulator y of rice bran polysaccharides and its sulfates in vitro. Int. J. Biol. Macromolecules. 2016. 21. Wheat bran polysaccharide with antitumor and immune regulation activities and xtraction method thereof, patent CN101705268B, accessed 20.01.2019, https://patents.google.com/patent/CN101705268B/en 22. Gunter E.A., OvodovYu.S., Production of Polysaccharides by Silene vulgaris Callus Culture Depending on Carbohydrates of the Medium. Biochemistr y (Moscow) . 2003. 68: 8, pp. 882-889. 23. Mahmoudifar N., Chai E., Dunstan D., Lane A., Production and applications of novel plant cell culture polysaccharides. Part I. In Hydrocolloids. Ed. By Nishinari K., Publisher: Elsevier. 2000. pp. 135-138. 24. Gunter E.A., OvodovYu.S. KhimijaRastitelnogoSyrja [Chemistr y of plant raw materials] 2001, 2, pp. 57-62 (in Russian) . 25. Ochoa-Villarreal, M.; Aispuro-Hernández, E.; Martínez-Téllez A. and Vargas-Arispuro I. Plant cell wall polymers function, structure and biological activity of their derivatives. Chapter 4. In Polymerization, Ailton De Souza Gomes, Publisher: Intech, Croatia, 2012, pp. 63-74. DOI: 10.5772/46094. 26. Kieran P.M. Bioreactor design for plant cell suspension cultures. Chapter 14. In Multiphase Bioreactor design. Ed. by Joacuim M.S. Cabral, Publisher: Francis and Taylor, Lonfon, UK, 2001, pp.417-422. 27. García, M.A.; Carrasco, E.; Ramírez A.; Jiménez, G.; Elena L.-R.; PeránM.;Picón M.; Campos, J.; Boulaiz, H. and Marchal, J.A.Chapter 5. Apoptosis as a therapeutic target in cancer and cancer stem cells: novel strategies and futures perspectives, InApoptosis and medicine, Ntuli, T.M. (Ed.) , Intech, New York, 2012, pp. 111-117, 10.5772/48267 28. Hanahan, D; Weinberg, R. The hallmarks of cancer, Cell, 2000, 100, pp. 57-70. 29. Balvan, J.; Krizova, A.; Gumulec J.; Raudenska M.; Sladek Z.; Sedackova M. et al. Multimodal Holographic Microscopy: Distinction between Apoptosis and Oncosis. PloS ONE, 2015, 10 (3) e0121674. pmid:25803711 30. Zhou Y.; Zhou X.; Huang X.; Hong N.; Zhang K.; Qi W.; Guo M.; and Nie Sh. Lysosome-Mediated Cytotoxic Autophagy Contributes to Tea Polysaccharide-Induced Colon Cancer Cell Death via mTOR-TFEB Signaling, Journal of Agricultural and Food Chemistr y . 2021, 69 (2) , pp. 686-697 DOI: 10.1021/acs.jafc.0c07166 31. Kerr, J.F.; Wyllie, A.H.; Currie, A.R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer, 1972, 26, pp. 239-257. 32. Ledoux, A.; Perkins, D. N.; NF-kB and the cell cycle. Biochemical Society Transactions, 2014, 42, pp. 76-81. 33. Sun, Y.; Liu, W. Z.; Liu, T.; Feng, X.; Yang, N.; Zhou, H. F. Signaling pathway f MAPK/ERK in cell proliferation, differentiation, migration: Senescence and apoptosis. Journal of Receptor and Signal Transduction Research, 2015, 35, pp. 600 604. 34. Xiong, W.; Li, J.; Jiang, R.; Li, D.; Liu, Z.; Chen, D. Research on the effect of ginseng polysaccharide on apoptosis and cell cycle of human leukemia cell line K562 and its molecular mechanisms. Experimental and Therapeutic Medicine, 2017, 13, pp. 924-934. 35. Abraha, A.M.; Ketema, E.B. Apoptotic pathways as a therapeutic target for colorectal cancer treatment. World J. Gastro. Oncol. 2016, 8, pp. 583-591. 36. Pfeffer, C.M.; Singh, A.T.K. Apoptosis: A Target for Anticancer Therapy. Int. J. Mol. Sci.2018, 19, 448. 37. Mcllwain, D.R.; Berger, T.; Mak, T.W. Caspase functions in cell death and disease. Cold Spring Harb. Perspect. Biol.2015, 7. 38. Tetsu, O.; McCormick, F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature, 1999, 398, pp. 422-426. 39. Saifo, M. S.; Rempinski, D. R.; Rustum, Y. M., &Azrak, R. G. Targeting the oncogenic protein beta-catenin to enhance chemotherapy outcome against solid human cancers. Molecular cancer, 2010, 9, 310. doi:10.1186/1476-4598-9-310 40. He, T.C.; Sparks, A.B.; Rago, C.; Hermeking, H., Zawel, L., Da Costa, L.T.; Morin P.J.; Vogelstein B and Kinzler KW: Identification of c-MYC as a Target of the APC Pathway. Science, 1998, 281 (5382) , pp. 1509-1512. 41. Demeterco, C; Itkin-Ansari, P.; Tyrberg, B.; Ford, L.P.; Jarvis, R.A. et al. c-Myc controls proliferation versus differentiation in human pancreatic endocrine cells. J ClinEndocrinolMetab. 2002, 87, pp. 3475-3485. 42. Leu, W.J.; Chang, H. S.; Chan, S. H.; Hsu, J. L.; Yu, C. C.; Hsu, L. C.; Guh, J. H.; Reevesioside A, a cardenolide glycoside, induces anticancer activity against human hormone-refractor y prostate cancers through suppression of c-myc expression and induction of G1 arrest of the cell cycle. PloS one, 2014., 9 (1) , e87323. doi:10.1371/journal.pone.0087323. 43. Jakoby, M.; Schnitter A. Cell cycle and differentiation. Current Opinion in Plant Biology. 2004. 7:6, pp. 661-669. 44. Garrido, C.; Galluzzi, L.; Brunet, M.; Puig, P E.; Didelot, C.; Kroemer, G.; Mechanisms of cytochrome c release from mitochondria, Cell Death and Differentiation, 2006, 13, pp. 1423-1433, https://doi.org/10.1038/sj.cdd.4401950 45. Su, Y.J.; Lai, H.M.; Chang, Y.W.; Chen, G.Y.; Lee, J.L. Direct reprogramming f stem cell properties in colon cáncer cells by CD44. EMBO J. 2011, 30 (15) , pp. 3186 3199. 46. Xu, H.; Tian, Y.; Yuan, X. et al. The role of CD44 in epithelial-mesenchymal transition and cáncer development. Onco Targets Ther. 2015, 8, pp. 3783-3792. doi:10.2147/OTT.S95470; 47. Pham, P.V.; Phan, N.L.; Nguyen, N.T. et al. Differentiation of breast cancer stem cells by knockdown of CD44: promising differentiation therapy. J Transl Med. 2011, 9, 209. doi:10.1186/1479-5876-9-209 48. Merga, Y. J.; et al. Importance of the alternative NF-KappaB activation pathway in inflammation-associated gastrointestinal carcinogenesis. American journal of physiology. Gastrointestinal and liver physiology, 2016, 310, pp. 1081-1090, doi:10.1152/ajpgi.00026.2016 49. Weber C.K.; Liptay, S.; Wirth, T.; Adler, G.; Schmid, R. M.Suppression of NF-kappaB activity by sulfasalazine is mediated by direct inhibition of IkappaB kinases alpha and beta. Gastroenterology, 2000, 119, pp. 120.- 1218. 50. Horst, D.; Budczies, J.; Brabletz, T.; Kirchner, T.; Hlubek, F. Invasion associated up-regulation of nuclear factor kappaB target genes in colorectal cancer. Cancer. 2009, 115, pp. 4946-58. 51. Kendall, R.T. and Feghali-Bostwick, C.A. Fibroblasts in fibrosis: novel roles and mediators. Front. Pharmacol. 2014, 5, 123. doi: 10.3389/fphar.2014.00123 52. Nakajima K, Balan V., Raz A., Galectin-3: an immune checkpoint target for musculoskeletal tumor patients. Cancer and Metastasis Reviews. 2021, 40:297-302 53. Nangia-Makker P., Hogan V., Raz A., Galectin-3 and cancer stemness. Glycobiology. 2018. V.28, N4, pp. 172-181 54. Hsieh T., Wu J.M. Changes in cell growth, cyclin/kinase, endogenous phosphoproteins and nm23 gene expression in human prostatic JCA-1 cells treated with modified citrus pectin. Biochem. Mol. Biol. Int. 1995;37:833-841. 55. Lehr J.E., Pienta K.J. Preferential adhesion of prostate cancer cells to a human bone marrow endothelial cell line. J. Natl. Cancer Inst. 1998;90:118-123. doi: 10.1093/jnci/90.2.118. 56. Li L-C, Li J, Gao J. Functions of galectin-3 and its role in fibrotic diseases. J Pharmacol Exp Ther. 2014;351: 336-343. 57. Eliaz I., Raz A., Pleiotropic effect of modified citrus pectin. Nutrients. 2019. 11, 2619 58. Yu L., Ruifrok W.P., Meissner M., Bos E.M., van Goor H., Sanjabi B., van der Harst P., Pitt B., Goldstein I.J., Koerts J.A. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis. Circ. Heart Fail. 2013;6:107-117. doi: 10.1161/CIRCHEARTFAILURE.112.971168. 59. Martínez-Martínez E., López-Ándres N., Jurado-López R., Rousseau E., Bartolomé M.V., Fernández-Celis A., Rossignol P., Islas F., Antequera A., Prieto S. Galectin-3 participates in cardiovascular remodeling associated with obesity. Hypertension. 2015;66:961-969. doi: 10.1161/HYPERTENSIONAHA.115.06032. 60. Bishimbayeva, N.K. Cytophysiological basis of biotechnology of long-term plant regeneration in the tissue culture of cereals, Thesis for doctor of biological sciences, Almaty, 2007, p. 38 (In Russian) . 61. Bishimbayeva, N.K.; Sartbayeva, I.A.; Murtazina, A.S.; Gunter, E.A. Chemical composition of polysaccharides from wheat cell culture. International Journal of Biology and Chemistr y , 2015, 8 (2) , pp. 1.- 17. 62. Kazybekova, S. K.; Bishimbayeva, N. K.; Murtazina, A. S., Tazhibaeyva, S. M., Miller, R. Physico-chemical properties of physiologically active polysaccharides from wheat tissue culture. International Journal of Biology and Chemistr y , 2015, 8 (2) , pp. 18-22, ISSN 2409-370X. 63. Bishimbayeva, N.K.; Murtazina, A.S.; McDougall, G.J. Influence of phytohormones on monosaccharide composition of polysaccharides from wheat suspension culture. Eurasian Chemico-Technological Journal, 2017, 19, pp. 251-257. 64. Bento, J.F.; Noleto G.R.; Oliveira Petkowicz C.L. Isolation of an arabinogalactan from Endopleura uchi bark decoction and its effect on HeLa cells. Carbohydr. Polym., 2014.101, pp. 871-877 65. Vetvicka V.; Vetvickova J. Glucans and cancer: comparison of commercially available beta-glucans - Part IV. Anticancer research.2018. 38. pp. 1327-1333. 66. Cao, L., Liu, X.; Qian, T, ; Sun, G.;Guo, Y.; Chang, F.; Zhou, S.; Sun, X. Antitumor and immunomodulator y activity of arabinoxylans: A major constituent of wheat bran. International journal of biological macromolecules. 2011.48. pp. 160-4. 67. Ibarrola J., Matilla L., Martínez-Martínez E., Gueret A., Fernández-Celis A., Henr y J.-P., Nicol L., Jaisser F., Mulder P., Ouvrard-Pascaud A. Myocardial Injur y After Ischemia/Reperfusion Is Attenuated By Pharmacological Galectin-3 Inhibition. Sci. Rep. 2019;9:9607. doi: 10.1038/s41598-019-46119-6. 68. Cao, Li. y otros.- "Wheat bran polysaccharide with antitumor and immune regulation activities and extraction method thereof" . CN101705268A. 69. Murashige, T.; Skoog, F. A revised médium for rapid growth and bioassays with tobacco tissue cultures, Phisiol. Plant. 1962, 15, pp. 473-497. 70. Austin, C., Stewart, D., Allwood, J.W., McDougall G.J. Extracts from the edible seaweed Ascophyllum nodosum inhibit lipase activity in vitro: contributions of phenolic and polysaccharide components. 2018. Food Funct 9 (1) , pp. 502-510 71. Dubois, M.; Gilles, K.A.; Hamilton, J.K.; Rebers, P.A.; Smith F. Colometric Method for Determination of Sugars and Related Substances, Analytical Chemistr y , 1956, 28, 3. pp. 350-356. 72. Ramírez, A.; Boulaiz, H.; Morata-Tarifa, C. et al. HER2-signaling pathway, JNK and ERKs kinases, and cancer stem-like cells are targets of Bozepinib. Oncotarget, 2014, 5 (11) , pp. 3590-3606; 73. Marchal, J.A.; Boulaiz, H.; Suarez, I.; Saniger, E.; Campos, J.; Carrillo, E.; Prados, J.; Gallo, M.A.; Espinosa, A.; Aranega, A. Growth inhibition, G (1) -arrest, and apoptosis in MCF-7 human breast cancer cells by novel highly lipophilic 5-fluorouracil derivatives. Invest New Drugs. 2004, 22 (4) , pp. 379-389. 74. Boulaiz, H.; Prados, J.; Melguizo, C.; García, A.M.; Marchal, J.A.; Ramos, J.L.; Carrillo, E; Vélez, C.; Aranega, A. Inhibition of growth and induction of apoptosis in human breast cancer by transfection of gef gene. Br J Cancer. 2003, 7, 89 (1) , pp. 192 8. PubMed PMID: 12838323; PubMed Central PMCID: PMC2394231. 75. Cáceres, B.; Ramirez, A.; Carrillo, E.; Jimenez, G.; Griñán-Lisón, C.; López-Ruiz, E.; Jiménez-Martínez, Y.; Marchal, J.A.; Boulaiz, H. Deciphering the Mechanism of Action Involved in Enhanced Suicide Gene Colon Cancer Cell Killer Effect Mediated by Gef and Apoptin. Cancers (Basel) .2019, 23, 11 (2) . 76. Ramírez, A.;Boulaiz, H.;Morata-Tarifa, C.; Perán, M.; Jiménez, G.;Picon-Ruiz, M.;Agil, A.; Cruz-López, O.;Conejo-García, A.; Campos, J.M.; Sánchez, A.;García, M.A.;Marchal, J.A.; HER2-signaling pathway, JNK and ERKs kinases, and cancer stem-like cells are targets of Bozepinib small compound. Oncotarget. 2014, 15, 5 (11) , pp. 3590-606. 77. Ferreira, S.S.; Passos, C.P.; Madureira P.; Vilanova M.; Coimbra M.A. Structure-function relationships of immunostimulator y polysaccharides: a review. Carbohydr. Polym., 2015. 132., pp. 378-396 78. Friedman M., Mushroom Polysaccharides: Chemistr y and Antiobesity, Antidiabetes, Anticancer, and Antibiotic Properties in Cells, Rodents, and Humans. Foods. 2016. 29;5 (4) ., pp. 80. doi: 10.3390/foods5040080. PubMed PMID: 28231175; PubMed Central PMCID: PMC5302426. 79. Efferth, T., Biotechnology applications of plant callus cultures. Engineering. 2019. 5 (1) . pp. 50-59. 80. Deshpande A, Dhadi SR, Hager EJ, Ramakrishna W. Anticancer activity of rice callus suspensión culture. Phytother Res 2012;26 (7) :1075-81. 81. Taylor, R.C.; Cullen, S.P.; Martin, S.J.; Apoptosis: controlled demolition at the cellular level. Nat Rev Mol Cell Biol.2008, 9, pp. 231-241. 82. Pan, H.; Wang, Y.; Na, K. et al. Autophagic flux disruption contributes to Ganoderma lucidum polysaccharide-induced apoptosis in human colorectal cancer cells via MAPK/ERK activation. Cell Death Dis. 2019, 10, p. 456. https://doi.org/10.1038/s41419-019-1653-7.
Publicaciones:
ES2956393 (20/12/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 12/05/2022 se realizó Registro Instancia de Solicitud
En fecha 13/05/2022 se realizó 3003_Registro Doc. Subsanación Defectos en Admisión a Trámite Patente Invención
En fecha 18/08/2022 se realizó Publicación Defectos Admisión a Trámite
En fecha 26/08/2022 se realizó Admisión a Trámite
En fecha 26/08/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 15/09/2022 se realizó Superado examen de oficio
En fecha 18/04/2023 se realizó Realizado IET
En fecha 20/04/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 20/12/2023 se realizó Publicación Solicitud
En fecha 20/12/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 04/04/2024 se realizó Validación petición y/o pago de examen sustantivo no conforme
En fecha 04/04/2024 se realizó Retirada
En fecha 04/04/2024 se realizó 1108P_Notificación retirada solicitud por no petición y/o pago de examen sustantivo
En fecha 10/04/2024 se realizó Publicación retirada solicitud por no petición y/o pago de examen sustantivo
Pagos:
13/06/2022 - Pago Tasas IET
+ ES-2956393_A11. Procedimiento de extracción de polisacáridos, en adelante "procedimiento de la invención", que comprende la extracción etanólica de polisacáridos extracelulares a partir de un cultivo celular de tejido de callos embiogénicos de cereales. 2. Procedimiento de obtención de extractos de polisacáridos según reivindicación anterior, que comprende las etapas de: a) Plantar un embrión inmaduro en medio de agar sólido para obtener un callo embriogénico. b) Cultivar tejido de dicho callo embriogénico en medio de agar sólido. c) Cultivar células del paso b) en suspensión con la adición de al menos una fitohormona. d) Extracción de los polisacáridos extracelulares del paso c) mediante extracción etanólica. e) 3. Procedimiento según cualquiera de las reivindicaciones anteriores, donde el cereal utilizado es trigo 4. Procedimiento según cualquiera de las reivindicaciones anteriores, donde el cereal utilizado es Triticum aestivum. 5. Procedimiento según cualquiera de las reivindicaciones 2 a 4, que comprende una etapa adicional de fraccionamiento del extracto de polisacáridos del paso d) , para obtener el extracto alcalino. 6. Procedimiento según cualquiera de las reivindicaciones 2 a 5, donde el callo embriogénico seleccionado/obtenido en el paso a) tiene una morfología friable, preferentemente una morfología friable a largo plazo. 7. Procedimiento según cualquiera de las reivindicaciones 2 a 6 donde el cultivo del callo del paso a) se realiza durante entre 10 días y 24 meses, preferentemente entre 10 y 365 días, y más preferentemente durante 28 o 70 días. 8. Procedimiento según cualquiera de las reivindicaciones 2 a 7, donde el medio de gar sólido del paso a) es Murashige y Skoog en presencia de ácido 2, 4-didorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL. 9. Procedimiento según cualquiera de las reivindicaciones 2 a 8 donde las células del paso c) se cultivan durante entre 5 días y 6 meses. 10. Procedimiento según cualquiera de las reivindicaciones 2 a 9 donde las células del paso c) se cultivan con un fotoperiodo de 16 horas. 11. Procedimiento según cualquiera de las reivindicaciones 2 a 10, donde el medio de agar en suspensión del paso c) es Murashige y Skoog en presencia de ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente a concentración 5, 0 mg/mL. 12. Procedimiento según cualquiera de las reivindicaciones 2 a 11, donde el medio de agar en suspensión del paso c) es Murashige y Skoog en presencia de ácido abcísico a concentración de entre 0, 1 y 10 mg/mL, preferentemente a concentración 1, 0 mg/mL. 13. Extractos de polisacáridos extracelulares obtenidos mediante el procedimiento según cualquiera de las reivindicaciones 1 a 12. 14. Extractos de polisacáridos extracelulares según la reivindicación anterior, para su uso como medicamento. 15. Extractos de polisacáridos extracelulares según las reivindicaciones 13 o 14, para su uso en la mejora, alivio, prevención y/o el tratamiento del cáncer. 16. Extractos de polisacáridos extracelulares según la reivindicación anterior, donde el tipo de cáncer es cáncer colorrectal. 17. Composición farmacéutica que comprende en su formulación al menos un extracto de polisacáridos extracelulares según cualquiera de las reivindicaciones 13 a 16. 18. Composición farmacéutica según la reivindicación anterior, que comprende al enos un agente antitumoral adicional. 19. Composición farmacéutica según cualquiera de las reivindicaciones 17 o 18, que adicionalmente comprende uno o más excipientes o vehículos farmacéuticamente aceptables. 20. Composición farmacéutica según cualquiera de las reivindicaciones 17 a 19, para su uso como medicamento. 21. Composición farmacéutica según la reivindicación anterior, para su uso en la mejora, alivio, prevención y/o el tratamiento del cáncer. 22. Composición farmacéutica según la reivindicación anterior, donde el tipo de cáncer es cáncer colorrectal. 23. Extractos de polisacáridos extracelulares según las reivindicaciones 13 a 16, para su uso comen la mejora, alivio, prevención y/o tratamiento de la fibrosis. 24. Composición farmacéutica según la reivindicación 17, que comprende al menos un agente antifibrótico adicional. 25. Composición farmacéutica según cualquiera de las reivindicaciones 17 o 24, que adicionalmente comprende uno o más excipientes o vehículos farmacéuticamente aceptables. 26. Composición farmacéutica según cualquiera de las reivindicaciones 17, 24 o 25, para su uso en medicina. 27. Composición farmacéutica según la reivindicación anterior, para su uso en la mejora, alivio, prevención y/o el tratamiento de la fibrosis.
Los productos y servicios protegidos por este registro son:
C12P 19/04 - A61K 36/899 - A61K 31/715 - A61P 35/00 - C12R 1/91
Descripciones:
+ ES-2956393_A1 EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO SECTOR DE LA TÉCNICA La presente invención se encuentra dentro del campo de la biología, botánica, nutrición y biomedicina. En concreto, se refiere a la obtención de extractos de polisacáridos de origen vegetal para ser usados como agentes antitumorales y/o antifibróticos, procedentes de cereales, concretamente Trigo y más concretamente Tríticum aestivum. ANTECEDENTES DE LA INVENCIÓN A pesar de los desarrollos recientes en prevención y tratamiento, el cáncer causa millones de muertes anuales y supone una enorme carga económica a nivel mundial [1]. En 2020, el cáncer provocó 10, 0 millones de muertes en todo el mundo, entre ellas, 915.000 fueron a causa de cáncer colorrectal (CCR) [2]. Globalmente, se diagnostican entre 1 y 2 millones de nuevos casos de CCR cada año, lo que lo convierte en el tercer tipo de cáncer con más incidencia, y la cuarta causa de muerte relacionada con el cáncer [3, 4, 5]. Entre los factores de riesgo para el desarrollo de un CCR se encuentran i) la edad, ya que se diagnostica con mayor frecuencia en pacientes mayores de 50 años (90% de los casos) sin otras patologías ni enfermedades predisponentes; ii) los factores dietéticos, que juegan un papel esencial y se encuentran en continua investigación; de hecho, el consumo excesivo de alcohol, el sobrepeso y obesidad y ciertos tipos de alimentos (carne procesada) han sido vinculados a esta patología; iii) enfermedades predisponentes, especialmente la presencia de pólipos intestinales o de enfermedad intestinal inflamatoria, que hacen que estos pacientes deban ser consideradas de alto riesgo para el desarrollo de CCR; iv) la presencia de un CCR previo; v) los denominados factores genéticos o familiares, dado que en 25% de los casos existe un antecedente familiar y en el 10% un componente hereditario y vi) por último, el estilo e vida, en el que se debe destacar la inactividad física, también se han relacionado con el CCR. A pesar de que los avances recientes en el tratamiento del cáncer son prometedores, aún se requiere descubrir nuevos componentes que puedan combatirlo con menos efectos secundarios en células no cancerosas. El desarrollo de nuevas estrategias terapéuticas y de prevención abarca una gran cantidad de campos de investigación que se extienden desde la nanotecnología, la terapia génica, la inmunoterapia usando de estrategias que activan el sistema inmune o el uso de nuevos compuestos que puedan ser activos en el tratamiento del CCR o adyuvantes de las terapias actuales para la mejora de la respuesta al tratamiento. En este sentido, en las últimas décadas han sido de especial interés los compuestos extraídos de fuentes naturales [6, 7], por lo que urge explorarlos en busca de compuestos activos beneficiosos. Polisacáridos de origen natural En los últimos años ha habido un interés creciente en la exploración de nuevos compuestos derivados de fuentes naturales renovables para un tratar y prevenir el cáncer de forma segura y efectiva. Los polisacáridos (PSs) están relacionados con la clase de sustancias naturales que han sido obtenidos a partir de microorganismos, hongos, algas y plantas. Se ha demostrado tanto in vitro como in vivo que tienen propiedades antioxidantes inmunomoduladoras y efectos antitumorales [7, 8, 9]. Además, en estudios preclínicos se ha observado que la actividad biológica de los PSs naturales es capaz de disminuir el crecimiento tumoral y prolongar la supervivencia mediante estimulación inmune, apoptosis, y detención del ciclo celular [10]. En los últimos 20 años ha existido una tendencia a buscar nuevos PSs con propiedades antitumorales y que causen el mínimo daño a la célula huésped. En este sentido, los PSs aislados de plantas han sido a menudo considerados preferibles a otras fuentes debido a que son menos tóxicos y causan menos efectos secundarios [11]. Además, los PSs procedentes de plantas son macromoléculas complejas con variabilidad estructural y funcional amplia [12, 13], lo que los convierte en una molécula poderosa con multitud de efectos biológicos. Ya se ha demostrado que los PSs derivados de varias plantas (manzana, ginseng, aloe y muchas otras) tienen propiedades antitumorales, inmunomoduladoras y antioxidantes [14, 15]. La actividad antioxidante de los PSs ha mostrado tener un efecto protector frente al daño por oxidación celular, minimizando el riesgo causado por especies reactivas de oxígeno. A su vez, se conoce que muchas enfermedades crónicas (entre ellas cáncer, diabetes, enfermedades cardiovasculares, etc.) están asociadas a estrés oxidativo y los PSs actúan como eliminadores de radicales libres [16, 17]. Esta enorme magnitud de efectos beneficiosos de los PSs hace que sean altamente valiosos para prevenir y tratar el cáncer y otros muchos trastornos crónicos. Entre otros PSs de origen vegetal, las hierbas medicinales han sido investigadas con mayor frecuencia y han sido utilizadas en terapias adyuvantes contra el cáncer. Algunos de esos PSs de hongos y plantas medicinales se han utilizado para desarrollar productos farmacéuticos como lentinan, schizophyllan, Krestin, GanoPoly, astragalan, GCS-100, y PectaSol, con baja toxicidad a la vez que potente actividad antitumoral, y actualmente existen en el mercado como suplementos nutricionales o medicamentos. En Japón, China y Korea, PSs bioactivos ya han sido introducidos como adyuvantes, complementando los tratamientos estándar de radio- y quimioterapia [10]. Sin embargo, aunque todos ellos hayan mostrado un efecto anticancerígeno directo in vitro y/o in vivo, se usan preferentemente como inmunomoduladores y adyuvantes durante estos tratamientos. Este hecho probablemente se deba a que estos polisacáridos estimulan el sistema inmune a dosis bajas (0, 5-100 ^g/ml) , mientras que ese efecto directo anticancerígeno requiere dosis mucho más elevadas (40-10000 ^g/ml) (Tabla 1) . Por ejemplo, para el CRC la dosis necesaria fue de 5000 ^g/ml. El uso de PSs a concentraciones elevadas para la terapia antitumoral se encuentra comprometido por la inhibición del crecimiento de las células normales junto con las células cancerosas. Tabla 1. Comparación de los polisacáridos naturales existentes en el mercado También han sido investigadas la estructura química y características funcionales de PSs procedentes de cereales, tras ser sugeridas por su uso en alimentación, cosméticos e industria de los medicamentos [18, 19]. Hay evidencias de actividad antitumoral e inmunomoduladora en PSs de salvado de arroz [20], y recientemente se ha revelado también el efecto antitumoral de PSs de salvado de trigo [21]. Sin embargo, no existen estudios del efecto biológico de los PSs obtenidos a partir del cultivo celular de cereales. Se ha demostrado que los tejidos de callos vegetales pueden ser una fuente de PSs valiosos [22, 23]. Cultivar células vegetales es una aproximación biotecnológica que permite que se obtengan diferentes compuestos químicos con numerosas ventajas: no control de organismos, ausencia de cambios en las condiciones climáticas, homogeneidad, posibilidad de optimización, estandarización y mayor rendimiento [24]. El cultivo de tejido vegetal in vitro hace posible enfocarse en la producción de aquellos PSs que tengan un propiedades especiales [25]. Además, el cultivo de células vegetales permite la producción y regulación de la salida de fitoquímicos con biotransformación, lo que contribuye a la obtención de sustancias naturales con ctividad novedosa [26]. Callos de morfología friable Concretamente, los callos vegetales embriogénicos con morfología friable muestran características distintivas en comparación con otros tipos: células competentes embriogénicas únicas y complejos celulares embriogénicos, células con signos de muerte celular programada, y una red densa de polisacáridos en el espacio extracelular. La utilización del cultivo de callos embriogénicos de morfología friable como fuente de obtención de un cultivo en suspensión para el aislamiento de polisacáridos con actividad anticancerígena y/o antifibrótica no ha sido descrita en otras patentes o artículos. Este tipo de callos permiten regular la obtención y la composición química de los exopolisacáridos mediante el cambio del balance de fitohormonas en el medio de cultivo, lo que a su vez se correlaciona con el crecimiento, la morfogénesis y la diferenciación celular en este tipo de tejido. Mecanismos moleculares del cáncer Existen numerosos procesos que favorecen la aparición y la progresión del cáncer, entre ellos la desregulación de la apoptosis, el aumento de la proliferación celular, la incapacidad de diferenciación, o la presencia y acumulación de radicales libres. Centrarse en solucionar estas alteraciones ha sido hasta ahora el enfoque para encontrar nuevas soluciones y tratamientos que permitan frenar y hacer retroceder a esta enfermedad hasta su eliminación. Es ampliamente conocido que la apoptosis, la muerte celular programada de tipo I, es un mecanismo esencial para mantener el balance entre la muerte celular y la proliferación. Su desregulación suele ocasionar la progresión de células cancerosas. Notablemente, muchas células cancerosas parecen resistir los mecanismos de señalización de la apoptosis, sugiriendo la necesidad de buscar compuestos que induzcan la apoptosis en estas células [27, 28]. Las células que sufren este proceso se caracterizan porque su cromatina se condensa y desfragmenta [29], las mitocondrias se agrandan y dañan y sus membranas internas se desorganizan, aparece una gran cantidad de vacuolas autofágicas con partículas en su interior, el aparato de Golgi se hincha, desaparece la membrana nuclear, y aparecen ampollas y cuerpos multilaminares. Existen dos rutas que desencadenan apoptosis: la ruta intrínseca o mitocondrial, y la ruta extrínseca a través de receptores de muerte. Ambas rutas llevan a la activación de caspasas, y provocan cambios intracelulares como la condensación de la cromatina, fragmentación del DNA, formación de ampollas en la membrana y encogimiento de las células [30, 31]. Hay multitud de rutas de señalización por las que puede tener lugar la apoptosis, involucrando a p53, Bcl-2, NFkB, MAPK y otras proteínas relacionadas [27]. Se ha reportado que el efecto citotóxico de los PSs procedentes de plantas se consigue a través de uno o más mecanismos: MAPK, NF kB, JNK, p38, p53, PARP, etc. [32, 33, 34]. Concretamente, en la ruta de activación intrínseca participan proteínas de la familia Bcl-2 [35], entre ellas Bax, que lleva a la liberación del citocromo C de la mitocondria al citoplasma [36], seguido de la activación de la caspasa 9 y finalmente la caspasa que ejecuta la apoptosis, la caspasa 3. Por otro lado, la ruta extrínseca, que ocurre con la activación de los receptores de muerte (Fas, TNFR-I, TRAIL, etc.) , sigue con la activación de la caspasa 8, que desencadena la apoptosis a través de la caspasa 3 [37]. En cuanto a la inhibición del crecimiento celular, suele asociarse a la disminución de los niveles de beta-catenina [38, 39], lo que ocasionaría el bloqueo de la ciclina D1 y la ruta de genes APC (adenomatous polyposis coli) ; y a la disminución de la proteína c-Myc [40]. Esto último causa un cambio en las células tumorales para volverse más diferenciadas, y con ello creciendo a tasa menores [41, 42]. También se han relacionado los procesos de diferenciación con la disminución de los niveles de CD44. En general, el arresto del ciclo celular contribuye a la diferenciación, pero sin ser un elemento últimamente necesario para la misma, sino acompañado de la regulación a la baja de ciclinas o la activación de inhibidores de quinasas dependientes de ciclinas (cyclin dependent kinases, CDKs) [43]. Además de en la ruta intrínseca de la apoptosis, también se ha relacionado al citocromo C con la diferenciación celular, usualmente acompañado de la rotura de caspasas, pero sin causar la muerte celular [44]. También se ha detectado que el receptor de CD44 está relacionado con la progresión de las células de cáncer colorrectal y parece ser un indicador prometedor para el ronóstico de esta enfermedad [45]. La expresión de CD44 puede correlacionarse con la ruta Wnt y la transición epitelial-mesenquimal. Además, CD44 es un biomarcador de células madre cancerosas (cancer stem cells, CSCs) en algunos tumores y se considera que contribuye al crecimiento del cáncer y a la metástasis [46]. Se ha demostrado que se puede inducir la diferenciación de las CSC en mama con el noqueo de CD44, ocasionando la pérdida del fenotipo CSC junto con la reducción de la expresión de las proteínas Bcl-2, Muc-1 y la consecuente reducción de metástasis y tumorigénesis [47]. Existen también proteínas frecuentemente asociadas a la progresión del cáncer, como ocurre con NFkB. Esta proteína es ampliamente utilizada por las células como regulador de los genes que controlan la proliferación y supervivencia celular. Una sobreactivación del gen asociado lleva a la protección y la inducción de la proliferación de las células, que normalmente deberían morir por apoptosis, mientras que su inhibición aumenta la susceptibilidad de las células a la apoptosis. Hay dos tipos de rutas de NFkB, que se activan de forma diferente e inducen la activación de genes distintos: ruta clásica, de NFkB 1 a través de las proteínas p65/p50; y ruta alternativa, de NFkB 2 a través de las proteínas p100/p52 [48]. Ambos mecanismos son importantes en la tumorigénesis, aunque la ruta alternativa no se ha investigado en profundidad en el caso de células de cáncer colorrectal. Además, existen fármacos antitumorales que se han probado para inhibir la ruta clásica de NFkB, y no tantos para la ruta alternativa [49], lo que deja abierta la posibilidad de hacer investigaciones y aplicaciones de nuevos fármacos [50]. Mecanismos moleculares de la fibrosis Los fibroblastos producen las proteínas estructurales de la matriz extracelular (MEC) , como colágeno fibrilar y elastina, proteínas adhesivas, como laminina y fibronectina, y la sustancia fundamental, que comprende glicosaminoglicanos como el ácido hialurónico, y glicoproteínas. Sin embargo, los fibroblastos también juegan varios papeles adicionales más allá de la producción de MEC. Por ejemplo, participan en el mantenimiento y reabsorción de la MEC, cicatrización de heridas, inflamación, angiogénesis, progresión del cáncer y en la fibrosis tisular tanto fisiológica como patológica. De manera auxiliar, los fibroblastos producen y responden a un amplio rango de señales paracrinas y autocrinas, como citoquinas y factores de crecimiento. Apuntar a estos eventos de señalización auxiliares es la principal estrategia que ubyace a múltiples líneas de investigación que buscan una nueva generación de tratamientos para trastornos relacionados con los fibroblastos. Los fibroblastos son células mesenquimales derivadas del tejido del mesodermo embrionario, y no están completamente diferenciados. Pueden ser activados por una variedad de señales químicas que promueven la proliferación y la diferenciación celular para derivar en miofibroblastos, con una tasa de producción de matriz aumentada. La activación de los fibroblastos juega un papel vital en la cicatrización de heridas. Sin embargo, en algunos casos y debido a razones que aún no se han esclarecido completamente, su activación se vuelve descontrolada, produciendo una respuesta fibrótica patológica que promueve múltiples enfermedades y afecta a una variedad de órganos. De hecho, la fibrosis juega un papel contribuyente muy importante en la mayoría de casos de fallo orgánico. Los ejemplos son abundantes, desde esclerosis sistémica, fibrosis pulmonar idiopática, cirrosis hepática, fibrosis renal, y la fibrosis cardiaca observada en la hipertrofia cardiaca que deriva en insuficiencia cardiaca. El rol principal de los fibroblastos en la fibrosis pulmonar se validó mediante la deleción específica del linaje del receptor TGFp tipo II [51]. Dado que los fibroblastos son un efector central en la fibrosis, se convierten en potenciales dianas terapéuticas. Una de las rutas de la actividad de los fibroblastos es la ruta Wnt, relacionada con la proliferación, migración e invasión de estas células. Por otro lado, se conoce que la galectina-3 (gal-3) es una proteína de unión a azúcares con efectos pleiotrópicos con un papel clave en la progresión de tumores, pudiendo ser un agente terapéutico [52]. Gal-3 contribuye a la sobreexpresión de c-Myc, betacatenina, relacionadas con la ruta Wnt, así como otras rutas involucradas en la tumorigénesis y además, rutas que contribuyen a mantener a las células cancerosas sin diferenciarse [53]. Se ha demostrado que la inhibición de gal-3 desencadena la acumulación de células en la fase G2/M [54], suprime la adhesión celular del tumor al endotelio y con ello previene la metástasis y los depósitos intravasculares [55]. Sin embargo, los inhibidores de gal-3 pueden utilizarse para otros fines, en particular, para prevenir la fibrosis. Esto es posible puesto que gal-3 activa multitud de factores profibróticos, promueve la proliferación y transformación de los fibroblastos, y modula la producción de colágeno. Se ha demostrado la importancia de gal-3 en la ibrogénesis de diferentes órganos, incluyendo el hígado, riñón, pulmón, y miocardio [56]. Concretamente, promueve la actividad de los fibroblastos, incluyendo la producción, secreción y maduración del colágeno [57, 58], y también estimula la secreción de las citoquinas proinflamatorias IL-1 e IL-6, así como fibronectina [59]. En investigaciones previas, los inventores pudieron identificar PSs bioactivos en cultivos en suspensión de células de cereales [60]. Exploraron la composición química y las propiedades físicas de PSs procedentes de trigo, que están representados por arabinogalactanos, y por xiloglucanos, arabinoxilanos y glucanos, de acuerdo a su composición en monosacáridos [61, 62]. Además, demostraron que la composición en monosacáridos cambiaba de forma significativa dependiendo del tipo y la concentración de fitohormonas en el medio de cultivo, así como el tiempo de cultivo en las diferentes etapas [63]. De la literatura se conoce que estos tipos de PSs se consideran aptos para su aplicación en medicina, incluido el tratamiento contra el cáncer [10]. Por lo tanto, los resultados sugieren que los arabinogalactanos [64], betaglucanos [65] y arabinoxilanos [66] tienen la capacidad de suprimir la proliferación de células cancerosas in vitro [66]. Por otro lado, experimentos previos con pectinas modificadas de cítricos, las cuales inhiben gal-3, previenen fibrosis cardiacas, inflamaciones, y otras alteraciones funcionales [67]. El estado de la técnica más cercano conocido por el solicitante se refleja en CN101705268 [68], que describe un método de extracción de polisacáridos de salvado de trigo con actividad antitumoral e inmunomoduladora. La composición de los monosacáridos extraídos consiste tan solo en arabinoxilanos, y la extracción consiste en un tratamiento de múltiples pasos: remojo en HCl, eliminación de almidón, enzimólisis con xilanasas (pasos que también modulan la composición de monosacáridos) , doble extracción con etanol, e inactivación de los productos de la enzimólisis. En la presente invención, se propone un método de extracción de PSs de cultivos celulares de trigo y su uso para el tratamiento, alivio y prevención del cáncer colorrectal y/o la fibrosis. En este método, se realizan modificaciones en la composición de fitohormonas y los tiempos de cultivo para obtener extractos con distinta composición. Los extractos obtenidos presentan baja toxicidad, lo que solventaría los problemas existentes con los tratamientos actuales, cuya actividad también perjudica a las células anas, provocando numerosos efectos secundarios. Por tanto, la utilización de extractos de PSs de cultivos celulares de trigo supone una alternativa efectiva y segura a los tratamientos actuales. BREVE DESCRIPCIÓN DE LA INVENCIÓN La presente invención se basa en la obtención y la utilización de extractos de polisacáridos de una especie vegetal del género Triticum, más concretamente, obtenidos de cultivos celulares de tejido de callos embriogénicos de la especie Triticum aestivum, en su variedad de trigo blando de primavera, para el tratamiento y la prevención del cáncer colorrectal y/o fibrosis. En contraste con los productos farmacéuticos obtenidos de hongos y plantas mencionados en los "Antecedentes de la invención" (lentinan, schizophyllan, Krestin, GanoPoly, astragalan, GCS-100 y PectaSol) , en la presente invención se han obtenido extractos de PSs cuya actividad contra las células cancerosas es efectiva a bajas concentraciones de entre 10 y 1600 ^g/ml (células de cáncer colorrectal, Tabla 1) , además de presentar una toxicidad baja para las células sanas. En consecuencia, el índice terapéutico de los extractos más efectivos se encontraría entre 9 y 70. El estado de la técnica más cercano conocido por el solicitante se refleja en CN101705268, como ya se ha mencionado en los "Antecedentes de la invención". Al compararlos con la presente invención, se encontraron las siguientes diferencias: • Fuente de obtención: en la patente CN101705268, los PSs se han aislado de salvado de trigo, que consiste en la capa exterior dura (aleurona y pericarpio) del grano maduro del cereal. Sin embargo, en la presente tecnología los polisacáridos se obtienen de un cultivo en suspensión de células de trigo capaz de mantener su potencial biosintético a largo plazo (varios años) mediante la realización de subcultivos in vitro. • Composición en monosacáridos: mientras que en la patente CN101705268 se determina que un extracto de polisacáridos de trigo con alta actividad antitumoral y baja toxicidad para el organismo consiste tan solo en arabinoxilanos (xilosa - 62, 25%, arabinosa - 33, 77%, glucosa - 4, 03%) , en la presente invención, dos de los extractos de polisacáridos con elevada actividad ntitumoral y baja toxicidad consisten principalmente en glucanos (glucosa -86-90%, arabinosa - 1, 5%, xilosa - 2-5%, galactosa - 1-2%, manosa - 1-2%, ácido glucurónico - 1%, ácido galacturónico - 1%) , como ya han publicado previamente [63]. • Método de extracción: el método de obtención de PSs en CN101705268 consiste en un tratamiento de múltiples pasos: remojo en HCl, eliminación de almidón, enzimólisis con xilanasas, doble extracción con etanol, e inactivación de los productos de la enzimólisis; mientras que el método aquí descrito requiere solo de un paso, y otro paso adicional de manera opcional, puesto que los PSs se secretan de forma natural al espacio extracelular. • Modulación de la composición de monosacáridos. En la patente CN101705268 se utilizan métodos químicos especiales para obtener la composición deseada: remojo en HCl, eliminación de almidón, enzimólisis para una adecuada bioactividad y estructura molecular. Por otro lado, en la presente invención la composición se modula usando un balance de fitohormonas óptimo y distintos tiempos de cultivo. • La actividad antitumoral de los polisacáridos obtenidos de salvado de trigo en la patente CN101705268 es complicado compararla con la obtenida con el uso de los extractos aquí descritos, dado que realizaron estudios in vivo en los que se inhibía al 50% de las células cancerosas con concentraciones de 400 mg/kg y 10 mg/kg, y esta tecnología se testeó in vitro, donde el rango de IC50 se encontraba entre 10 ^g/ml y 1600 ^g/ml. La presente invención se basa en: 1) El desarrollo de diferentes extractos de polisacáridos a partir de trigo blando de primavera Triticum aestivum, cultivados durante diferentes periodos de tiempo, y en presencia de diferentes fitohormonas, lo que da lugar a extractos con composiciones diferentes y distintas propiedades. Los extractos se obtienen a partir de embriones inmaduros cultivados en agar sólido durante 28 o 70 días en presencia de 2, 4-D 5, 0 mg/mL, para originar callos embriogénicos jóvenes o maduros, respectivamente, cuyas células serán cultivadas en suspensión durante una, tres o seis semanas en medio con diferentes fitohormonas: 2, 4-D 5, 0 mg/mL, o ABA 1, 0 mg/mL. Los polisacáridos se obtienen mediante extracción etanólica del medio extracelular. 2) La actividad antitumoral de los extractos de Tríticum aestivum cuando son testados en cultivos celulares de cáncer de colon humanos (células HCT-116) , utilizando como control la línea de fibroblastos de colon humanos CDD-18CO. Así mismo, se han estudiado los mecanismos de acción por los que los extractos actúan sobre las células tumorales para dilucidar las rutas moleculares que activan la muerte celular, inhiben el crecimiento celular e inducen la diferenciación celular. 3) La actividad antifibrótica de los extractos de Triticum aestivum cuando son testados en cultivos celulares de fibroblastos de colon humanos CDD-18CO. Así mismo, se han estudiado los mecanismos de acción por los que los extractos actúan sobre los fibroblastos para dilucidar las rutas moleculares que inhiben el crecimiento celular y activan la muerte celular. En definitiva, la tecnología aquí presentada muestra las siguientes ventajas técnicas respecto al estado de la técnica: • Todos los polisacáridos existentes en el mercado con propiedades anticancerígenas se obtienen de hongos y plantas medicinales que necesitan crecer en el suelo. Por lo tanto, una producción a gran escala requiere de grandes superficies, regado o, como mínimo, invernaderos. En muchos casos, hay una fuerte dependencia del clima y las estaciones. A la vez, la literatura muestra que también se pueden obtener PSs del cultivo celular de hongos. La ventaja de la presente tecnología es que permite obtener PSs durante todo el año, independientemente del clima y la estación del año, a través del cultivo celular en suspensión, en condiciones controladas (temperatura, intensidad lumínica, fotoperiodo, etc.) , sin necesitar grandes terrenos, regado o invernaderos. • La composición deseada de PSs existente en el mercado se consigue a través de una modificación química de varios pasos, seguida de una purificación también de varios pasos, lo que supone una gran inversión de tiempo y esfuerzo. Por otro lado, la presente invención es mucho más sencillo. La composición de PSs deseada se consigue simplemente cambiando el balance de fitohormonas del medio de cultivo y los tiempos de cultivo, sin necesitar hacer modificaciones químicas, y la purificación es de un solo paso gracias a ue los PSs se secretan al espacio extracelular. De acuerdo a la tecnología de obtención de PSs existente en el mercado, es necesario modificar el protocolo de aislamiento y purificación para cada especie diferente que actúe como organismo fuente. La tecnología aquí descrita funcionaría para cualquier cultivo de cereales (cebada, maíz, avena, arroz, centeno, sorgo, mijo proso) usando el cultivo de células de trigo como sistema modelo universal para cereales y hierbas. Además, la presente tecnología mejoraría la rentabilidad, además de por la simplificación del método de obtención, por la optimización, estandarización y aumento del rendimiento del mismo, así como a la posibilidad de dirigir la producción hacia los PSs deseados. Los PSs existentes en el mercado consiguen ser efectivos a través de la activación del sistema inmune, y se usan mayoritariamente como adyuvantes en los tratamientos de quimio- y radioterapia, y no como tratamiento directo, debido a su efecto negativo en células sanas. En la presente invención se ha demostrado que los PSs obtenidos del cultivo de células de trigo, preferentemente aquellos cultivados en suspensión con ácido abcísico (ABA) , actúan como inhibidores directos de las células cancerosas a concentraciones mucho más bajas que los PSs del mercado y su toxicidad en células sanas es mucho menor. Gracias a esto, los extractos más efectivos han obtenido índices terapéuticos que cumplen con los requisitos de los medicamentos antitumorales y se pueden usar a concentraciones mayores. Por último, al investigar el mecanismo de acción de los extractos de PSs de cultivos celulares de trigo, se ha visto que no solo se induce la apoptosis, sino que también se inhibe la proliferación y la diferenciación de las células. Al analizar los marcadores, se ha detectado una reducción de los niveles de betacatenina y c-Myc, con lo que la ruta Wnt/beta-catenina estaría inhibida. Estas observaciones, junto al hecho de que los PSs contienen galactosa, la cual es capaz de unirse al extremo terminal de unión de azúcares de la proteína gal-3, indican que los extractos de PSs de cultivos celulares, preferentemente aquellos cultivados en suspensión con 2, 4-diclorofenoxiacético (2, 4-D) , actúan como inhibidores de gal-3, que además de como agentes anticancerígenos, también son efectivos para la prevención de la fibrosis. BREVE DESCRIPCIÓN DE LOS DIBUJOS Para complementar la descripción que se está realizando y con objeto de ayudar a una mejor comprensión de las características de la invención, se acompaña como parte integrante de dicha descripción, un juego de dibujos en donde con carácter ilustrativo y no limitativo, se ha representado lo siguiente: Figura 1. Inhibición de la proliferación (en %) de la línea celular de cáncer de colon HCT-116 bajo la influencia de diferentes concentraciones de los extractos T-010, B-010 y UB-010. T01.- extracto completo, B-01.- extracto ácido/unido, UB-01.- extracto alcalino/no unido. Figura 2. Actividad inhibidora de los extractos de PSs en la línea celular sana CCD-18 CO en comparación con la inhibición en células de cáncer de colon HCT-116. Extractos T-010, T-b, T-f, A-b y A-f. Figura 3. Ciclo celular y apoptosis de células de cáncer de colon HCT-116 tratadas con extractos PSs de cultivos celulares de trigo . A - células sin tratar, B - extracto A-b, C - extracto T-010, D - extracto UB-010, E - extracto T-b (2xIC50) , F - extracto A-f, G - extracto T-f, H - ciclo celular, I - apoptosis, J - restos celulares. Figura 4. Micrografías en microscopio electrónico de transmisión de células HCT-116 tratadas con extractos PSs de cultivos celulares de trigo a concentraciones IC50. (Escala: a, b, e, j, k, l, m, n, o, p, q, r - 400 nm, c, d, f - 600 nm, g, h, I - 200 nm) , a - núcleos de células sin tratar, b, c - núcleos con cromatina condensada y poros nucleares, burbujas nucleares de células tratadas con el extracto T-010, d - núcleos de células tratadas con el extracto T-b, cromatina condensada, poros nucleares (2xIC50) , e - núcleos de células tratadas con el extracto A-b, f -burbujas en el espacio intercelular, entre las células tratadas con el extracto UB-01, g - mitocondrias de células sin tratar, h - mitocondrias tratadas con el extracto T-010, i - mitocondrias tratadas con el extracto T-b, j - aparato de Golgi de células sin tratar, k - aparato de Golgi hinchado en células tratadas con el extracto T-010, l - aparato de Golgi hinchado en células tratadas con el extracto A-b, m - aparato de Golgi hinchado en células tratadas con el extracto T-b, n - lisosomas y vacuola autofágica de células sin tratar, o - acumulación de múltiples vacuolas autofágicas con membrana doble y imple en células tratadas con el extracto T-010, p - acumulación de múltiples vacuolas autofágicas con membrana doble y triple, q - vesículas en células tratadas con el extracto T-b, r - vesícula autofágica grande con membrana doble en célula tratada con el extracto UB-010, A - diámetro de un corte transversal de mitocondrias, B - número de mitocondrias dañadas por imagen. N-núcleo, Np - poro nuclear, M-mitocondria, G- aparato de Golgi, L-lisosoma, av - vesícula autofágica; ALV-vesícula autofágica grande. Figura 5. Micrografías en microscopio electrónico de barrido de células HCT-116 tratadas con extractos de PSs. A: Aumento 3000x, 50^m: a - células sin tratar, b -extracto T-010, c - extracto A-b, d - extracto UB-010, e - extracto T-b a IC50, f -extracto T-b a IC50x2; Aumento 9975x, 10^m: g - células sin tratar, h - extracto T-010, i - extracto A-b, j - extracto UB-010, k - extracto T-b a IC50, l - extracto T-b a IC50x2. B - número de microvellosidades/10^m2. Figura 6. Inmunotransferencia de diferentes proteínas relacionadas con la proliferación del cáncer tras el tratamiento con diferentes extractos de PSs. La cuantificación fue normalizada con la señal de p-actina. Los datos se obtuvieron de experimentos independientes realizados por duplicado y se expresan como la media ± desviación estándar de tres experimentos independientes realizados por triplicado (****p < 0.0001, ***p < 0.001, **p < 0.01 y *p< 0.05 frente al control) . Figura 7. Esquema de la obtención de los extractos de PSs. DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Definiciones El término "extracto" en el contexto de este documento, cuando se utiliza en relación al objeto de la invención, hace referencia a una composición obtenida a partir de una especie vegetal, y su contenido comprende esencialmente polisacáridos. El término "tratamiento" o "tratar en el contexto de este documento se refieren al uso de polisacáridos según la invención en forma de extracto o composición para curar o aliviar una enfermedad, condición patológica o uno o más síntomas asociados con icha enfermedad o condición. "Tratamiento" también abarca la prevención, mejora o eliminación de las secuelas fisiológicas de la enfermedad. Concretamente, el concepto "tratar" se puede interpretar como: i. Inhibir o prevenir la enfermedad o condición patológica, es decir, detener su desarrollo; ii. Paliar síntomas o aliviar la enfermedad o la condición patológica, es decir, causa la regresión de la enfermedad o la condición patológica; iii. Estabilizar la enfermedad o la condición patológica. Así, en un primer aspecto, la invención se refiere a un procedimiento de extracción de polisacáridos, en adelante "procedimiento de la invención", que comprende la extracción etanólica de polisacáridos extracelulares a partir de un cultivo celular de tejido de callos embiogénicos de cereales. En una realización preferente, el cereal utilizado es trigo, y más preferentemente Triticum aestivum, y aún más preferentemente la variedad Kazakhstanskaya-10 En una realización particular, el procedimiento de la invención se refiere a un procedimiento de obtención de extractos de polisacáridos procedentes de cultivos celulares de cereales, que comprende las etapas de: a) Plantar un embrión inmaduro en medio de agar sólido para obtener un callo embriogénico b) Cultivar tejido de dicho callo embriogénico en medio de agar sólido c) Cultivar células del paso b) en suspensión con la adición de al menos una fitohormona d) Extracción de los polisacáridos extracelulares del paso c) mediante extracción etanólica En otra realización particular, el procedimiento cuenta con una etapa adicional de fraccionamiento del extracto de polisacáridos, para obtener el extracto alcalino. En otra realización preferente, el callo embriogénico de la etapa a) tiene una morfología friable, más preferentemente una morfología friable que se mantenga a largo plazo. En realizaciones preferidas, el procedimiento de la invención se lleva a cabo bajo las siguientes condiciones: • El callo embriogénico se cultiva durante entre 10 días y 24 meses, preferentemente entre 10 y 365 días, y más preferentemente durante 28 o 70 días, y/o • El callo embriogénico se cultiva en medio Murashige y Skoog en presencia de ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente 5, 0 mg/mL. • Las células se cultivan en medio de agar en suspensión Murashige y Skoog en presencia de al menos una de estas fitohormonas, preferentemente una de estas fitohormonas: o Ácido 2, 4-diclorofenoxiacético a concentración de entre 0, 1 y 20 mg/mL, preferentemente a 5, 0 mg/mL. o Ácido abcísico a concentración de entre 0, 1 y 10 mg/mL, preferentemente a 1, 0 mg/mL. • El cultivo para obtener las células de tejido de callo embriogénico se lleva a cabo durante un periodo de tiempo comprendido entre 5 días y 6 meses, más preferentemente durante 7, 21 o 42 días, y/o • El cultivo para obtener las células de tejido de callo embriogénico se lleva a cabo con un fotoperiodo de 16 horas. En un segundo aspecto, la invención se refiere a los extractos de polisacáridos extracelulares obtenidos u obtenibles mediante el procedimiento de la presente invención. Un tercer aspecto se refiere a la utilización de los extractos de polisacáridos en medicina, los extractos de polisacáridos para su uso como medicamento o para la fabricación de un medicamento. En una realización particular, los extractos son utilizados para la mejora, alivio, prevención y/o el tratamiento del cáncer. Preferentemente, el tipo de cáncer es cáncer colorrectal. En otra realización particular, los extractos son utilizados para la mejora, alivio, revención y/o tratamiento de la fibrosis. En un cuarto aspecto, la invención hace referencia a una composición farmacéutica que comprende en su formulación al menos un extracto de polisacáridos extracelulares de la presente invención. La composición puede comprender al menos un agente antitumoral adicional. Alternativamente, la composición puede comprender al menos un agente antifibrótico adicional. En una realización particular, la composición farmacéutica comprende uno o más excipientes o vehículos farmacéuticamente aceptables. Un último aspecto de la invención se refiere a la utilización de una composición farmacéutica según el aspecto anterior, para su uso como medicamento o para la fabricación de un medicamento. En una realización particular, la composición es utilizada para la mejora, alivio, prevención y/o el tratamiento del cáncer. Preferentemente, el tipo de cáncer es cáncer colorrectal. En otra realización particular, la composición es utilizada para la mejora, alivio, prevención y/o tratamiento de la fibrosis. Como en el caso del procedimiento de la invención, y en los otros aspectos de la invención que se describen más adelante, se prefieren las realizaciones que corresponden a extractos obtenidos a partir de trigo, preferiblemente Tríticum aestivum. A lo largo de la descripción y las reivindicaciones el término "comprende", que también podrá interpretarse como "consiste en", y sus variantes no pretenden excluir otras características técnicas, aditivos, componentes o pasos. Para los expertos en la materia, otros objetos, ventajas y características de la invención se desprenderán en parte de la descripción y en parte de la práctica de la invención. MODOS DE REALIZACIÓN Materiales y métodos Cultivo de células vegetales, extracción de polisacáridos y contenido en monosacáridos Se cultivaron células embriogénicas de callos de trigo blando de primavera (Triticum aestivum) en agar sólido (Murashige y Skoog) en presencia de 5, 0 mg/L de 2, 4-D durante cuatro semanas para obtener callos friables jóvenes, o diez semanas para obtener callos friables maduros. Después, el tejido del callo se introdujo en un medio de cultivo líquido (Murashige y Skoog) [69] en presencia de una fitohormona [63], bien 2, 4-D 5, 0 mg/L o ABA 1, 0 mg/L, siguiendo un ratio de 200 a 300 mg de tejido en 30 a 40 ml de medio. El cultivo se realizó en un agitador a 140 rpm manteniendo el callo a una temperatura de 26 ± 2 °C. Para obtener los distintos extractos, se hicieron cultivos durante 7 o 21 días para las células procedentes de callos jóvenes, y de 42 días para aquellas procedentes de callos maduros, todos ellos con un fotoperiodo de 16h. El medio líquido se filtró para eliminar las células y sus restos, y el líquido extracelular se concentró en un evaporador IKA WERKE (Alemania) para el aislamiento de los PSs. Estos fueron extraídos utilizando etanol al 70% v/v y posteriormente sometidos a una precipitación mediante centrifugación a 10.000 rpm durante 10 minutos a 8°C. Adicionalmente, se realizó un paso opcional de fraccionamiento mediante cromatografía de intercambio iónico utilizando un tampón Tris HCL en una columna de DEAE-Sepharose (Sigma, EEUU) [70], para separar los extractos en sus componentes ácidos (extracto unido) , y alcalinos (extracto no unido) . Los PSs fueron extraídos utilizando etanol al 70% v/v y posteriormente sometidos a una precipitación mediante centrifugación a 10.000 rpm durante 10 minutos a 8°C. La cantidad total de polisacáridos de todos los extractos se determinó mediante el método Dubois [71]. Los extractos, para facilitar su identificación, se nombraron T si durante el cultivo celular en suspensión estuvieron en presencia de 2, 4-D (Figura 1, medio 1) ; y A si fue en presencia de ABA (Figura 1, medio 2) . Según los tiempos de cultivo, fueron los siguientes: - Extractos T: o T-010. Cultivo a corto plazo: células de callo joven cultivadas en suspensión urante 7 días. o T-b. Cultivo a medio plazo: células de callo joven cultivadas en suspensión durante 21 días. o T-f. Cultivo a largo plazo: células de callo maduro cultivadas en suspensión durante 42 días - Extractos A: o A-b. Cultivo a corto plazo: células de callo joven cultivadas en suspensión durante 7 días. o A-f. Cultivo a largo plazo: células de callo maduro cultivadas en suspensión durante 42 días. Además, el extracto T-010 fue sometido a la etapa adicional anteriormente mencionada, de fraccionamiento en una columna DEAE-Sepharose, dando lugar a dos extractos: - Extracto B-010. Ácido, unido a la columna (bound) . - Extracto UB-010. Alcalino, no unido a la columna (unbound) . Caracterización de los extractos de polisacáridos En total, siete extractos de PSs se utilizaron para el estudio del efecto en células de CCR y su mecanismo de acción. Los extractos diferían unos de otros en términos de composición nutricional del medio de cultivo líquido (adición de 2, 4-D o ABA) , así como los tiempos de cultivo (Figura 1) , y se obtuvieron 5 extractos completos (T-010, T-b, T-f, A-b, A-f) , y 2 extractos por separación mediante cromatografía de intercambio iónico de uno de los extractos completos (UB-010, B-010) . El precipitado de cada extracto se disolvió en 0, 5 ml de agua ultrapura y se liofilizó. Para cada experimento, los extractos se diluyeron en Dulbeccos Modified Eagle Medium (DMEM; Sigma-Aldrich) para obtener las concentraciones deseadas. Líneas celulares Se obtuvieron líneas celulares de cáncer colorrectal HCT-116 y células sanas CDD-18CO de la American Type Culture Collection (ATCC) y se mantuvieron en DMEM suplementado con un 10% v/v de suero fetal bovino. La autenticidad de todas las líneas celulares fue analizada mediante identificación STR (Short-Tandem Repeat) y los pases se realizaron en menos de 6 meses. Se realizaron ensayos rutinarios de contaminación por micoplasmas. Ensayos de citotoxicidad in vitro El efecto de los extractos de PSs en la viabilidad de las células fue medido mediante un ensayo colorimétrico MTT (bromuro de 3- (4, 5-dimetiltiazol-2-ilo) -2, 5-difeniltetrazol; Sigma, EEUU) . Se sembraron 2, 5x103 células/pocillo en placas de 96 pocillos. Se incubaron durante 24 horas y luego se trataron con diferentes concentraciones de PSs. Tres días más tarde, los pocillos se aspiraron y se trataron con MTT durante 3 horas, con una posterior disolución con dimetil sulfóxido (DMSO) . Las células se analizaron usando un aparato Titertek Multiskan (Flow, Irvine, California) a 570 nm. Evaluamos la linealidad de los ensayos calculando el número de células en cada pocillo antes de cada experimento de crecimiento celular. La concentración inhibitoria del 50% (IC50) se calculó a partir de curvas dosis-respuesta semilogarítmicas mediante interpolación lineal [72]. Todos los experimentos se sembraron en pocillos por triplicado y se realizaron al menos tres veces. Apoptosis y ensayos de ciclo celular in vitro Las fases del ciclo celular (G0/G1, S o G2/M) se caracterizan por diferencias en el contenido de ADN. Dado que el tinte fluorescente yoduro de propidio (Sigma, EEUU) se une fuertemente al DNA a un ratio 1:1, la intensidad de fluorescencia por yoduro de propidio varía entre las distintas fases del ciclo celular. Las células HCT-116 fueron sembradas en placas de 6 pocillos, a una concentración de 200x103 células/pocillo, y se incubaron durante 48 horas. Posteriormente, se trataron durante 48 horas con los extractos de PSs a diferentes concentraciones, determinadas según los valores de IC50. Las células cultivadas en monocapa se recolectaron, se lavaron dos veces con PBS y se fijaron en etanol al 70% a 4°C. El sedimento celular se lavó dos veces en PBS y se resuspendió en una solución de extracción de DNA (pH = 7, 8) de ácido acético 0, 1 M, y fosfato de sodio dibásico anhidro 0, 2 M en PBS, y se incubó durante 15 minutos a 37°C. Las células sedimentaron y fueron lavadas una vez más con PBS, tras lo que se resuspendieron en una solución de PBS con yoduro de propidio 100 mg/ml y RNAsa 40 mg/ml en oscuridad durante 30 minutos a 37°C [73]. El porcentaje de células en las fases subG1, G0/G1, S and G2/M se determinó con un citómetro de flujo FACS Calibur (BD, Biosciences, EEUU) . Microscopía electrónica La línea celular HCT-116 se sembró en placas de 6 pocilios, a una concentración de 200x103 células/pocillo, y se incubaron durante 48 horas. Posteriormente, se trataron durante 48 horas con los extractos de PSs a diferentes concentraciones, determinadas según los valores del doble de IC50. Las células se lavaron con PBS frío, se fijaron y se prepararon para microscopía electrónica de transmisión (MET) de acuerdo al protocolo estándar [74]. Para microscopía electrónica de barrido (MEB) , la línea celular HCT-116 se sembró en placas de 24 pocillos, con 100x103 células/pocillo, y tras 48 horas se trataron con las mismas concentraciones de PSs durante 48h. Las células se fijaron y se prepararon muestras para MEB como se describe en [75]. Inmunotransferencia Las células HCT-116 (150000/pocillo) se sembraron en placas de 6 pocillos en medio DMEM. Tras 48 horas de tratamiento, el medio se retiró de las células, y estas se centrifugaron a 1500 rpm, se lavaron dos veces con PBS y luego se lisaron con tampón Laemmli. Se realizó una inmunotransferencia de los lisados de las células completas siguiendo los protocolos rutinarios [76]. Se utilizaron anticuerpos primarios para detectar las siguientes proteínas: • caspasa-3, dilución 1:1000 (Cell Signaling, Beverly, MA, EEUU) ; • caspasa-8, dilución 1:500 (caspase-8 (8CSP03) : sc-56070, Santa Cruz Biotechnology) ; • bax, dilución 1:500 (bax (B-9) : sc-7480, Santa Cruz Biotechnology) ; • citocromo c, dilución 1:500 (cytochrome c (7H8) : sc-13560, Santa Cruz Biotechnology) ; • p-actina, dilución 1:15000 (A2228, Sigma) ; • c-Myc, dilución 1:100 (c-Myc (9E10) : sc-40, Santa Cruz Biotechnology) ; • beta-catenina, dilución 1:100 (p-beta-catenin (1B11) : sc-57533, Santa Cruz Biotechnology) ; • NF-kB2 p100, dilución 1:1000, (NF-kB2 p100/p52, 4882, Cell signaling technology, USA) ; • CD44, dilución 1:200, (HCAM (DF1485) : sc-7297, Santa Cruz Biotechnology) Los anticuerpos secundarios utilizados incluían anti IgG de conejo conjugado con eroxidasa (Sigma, A0545) y anti IgG de ratón conjugada con peroxidasa (Sigma, A9044) - Los complejos proteína-anticuerpo se hicieron visibles usando quimioluminiscencia mejorada (ECL, Bonus, Amersham, Little Chalfont, UK) con el programa IMAGE READER LAS-4000 en un sistema LAS-4000. La interpretación de la intensidad de la señal se realizó utilizando el programa Image J. Los valores de cada banda se normalizaron dividiéndolos por el valor de su p-actina, y se relativizaron respecto a los de la muestra control, a los que se les asignó el valor 1. Análisis estadístico Los valores se expresaron como media ± desviación estándar (SD, standard deviation) . Se utilizó un test t-student para determinar la significancia de las diferencias entre los dos grupos, considerándose como significativos cuando el p-valor era menor o igual a 0, 05. Para elaborar las figuras se utilizó el programa GraphPrism 8. Resultados Efecto antiproliferativo e inhibidor selectivo de los polisacáridos de cultivos celulares de trigo en líneas de cáncer de colon Los análisis de viabilidad celular revelaron que los PSs inhiben a las células de cáncer de colon HCT-116 a diferentes dosis. Los ensayos MTT mostraron que el extracto T-010 inhibía un máximo del 47% de las células a concentraciones de 1600 |jg/ml (Figura 2) . El extracto fraccionado alcalino obtenido a partir de dicho extracto T-010, tenía un efecto antiproliferativo inhibiendo el 48% de las células a concentraciones de 1600 jg /m l. Estos valores se consideraron como IC50 dado que cualquier incremento en la concentración de los extractos no producía una mayor inhibición (Figura 3A, 3B) . Por otro lado, el extracto ácido indujo en un 40% la proliferación in vitro y fue excluido de los ensayos posteriores. El extracto T-b inhibe el 50% de las células HCT-116 a concentraciones de entre 50 jg /m l y 100 jg /m l, por lo que se ha considerado 75 jg /m l como IC50 (Figura 3C) . En cuanto a el extracto A-b, inhibe el 50% de las células a 160 jg /m l (Figure 3D) . El extracto T-f provocó la inhibición del 47% de las células a 800 jg /m l, y la muerte del 51% de las células a 1600 jg /m l. Puesto que el efecto a doble concentración es casi el mismo, se consideró como IC50 la concentración de 1600 jg /m l (Figura 3E) . El extracto A-f inhibió el 50% de células cancerosas a concentraciones de entre 10 y 80 jg /m l, y si se aumentaba de estos valores, se producía una ligera disminución de la nhibición (40-45% of inhibición) (Figura 3F) . También se determinó el valor de IC50 de cada extracto de PSs para las células de fibroblastos sanos de colon CCD-18CO. Se demostró para todos los extractos cultivados en suspensión con 2, 4-D que el efecto tóxico de los PSs en células sanas era mayor a concentraciones bajas, y disminuía cuando la concentración de PSs era mayor. Por ejemplo, el extracto T-010 inhibía el 35% de las células CCD-18CO a 50 jg /m l, sin embargo, un aumento a 100-400 |jg/ml provocaba una ligera disminución de la inhibición, a 25-27%, y a concentraciones altas se mantenía 20-22% (Figura 3A) . Por otro lado, el extracto T-b producía una inhibición de entre el 30-40% a bajas concentraciones 3, 12.- 12, 5 jg /m l, sin embargo, un aumento de la concentración (2.- 100 jg /m l) inhibió el 20-25% de las células sanas, y a 200 jg /m l se inhibía tan solo el 15% de estas células (Figura 3C) . La incubación de células sanas con el extracto T-f mostró la misma tendencia: a 50 jg /m l se observe un 36% de inhibición, mientras que en el rango de concentraciones entre 100-800 jg /m l la inhibición disminuye al 20-25%, y una mayor concentración (1600-2000 jg /m l) disminuyó ligeramente la inhibición, hasta el 12-18% (Figura 3E) . Debido a este efecto invertido, no se pudo calcular el IC50 para estas células. El extracto UB-010 causó un 30.- 47% de inhibición de las células CCD-18CO, que aumentaba según las concentraciones de 50 jg /m l hasta 1600 jg /m l, y una posterior disminución a 2000 jg /m l. El valor de IC50 de este extracto es de 800 jg /m l (Figura 3B) . Los extractos cultivados en suspensión en presencia de ABA mostraron una menor toxicidad a bajas concentraciones en comparación con las cultivadas en presencia de 2, 4-D. Por tanto, el cálculo del IC50 para estos extractos se hizo utilizando un programa GraphPrism. Por consiguiente, el IC50 para la inhibición de las células CCD-18CO se consigue a una concentración de 1480 jg /m l para el extracto A-b, y a 700 jg /m l para el extracto A-f (Figura 3D, 3F) . El efecto antiproliferativo selectivo de los extractos de PSs se estimó mediante el cálculo del índice terapéutico (Tabla 2) . *No medible: las células proliferaban NC = no calculable El índice terapéutico fue el mayor para el extracto A-f, seguido del extracto A-b (70 y 9, 25, respectivamente) . Estos extractos fueron efectivos en células cancerosas a concentraciones más bajas, y tenían un menor efecto tóxico sobre las células sanas que los extractos T-010, T-b, T-f y UB-010. Los extractos cultivados en suspensión con 2, 4-D tenían un IC50 elevado en células cancerosas, y en células sanas no pudo ser calculado. En consecuencia, no se determinó el índice terapéutico de estos extractos. Sin embargo, todos ellos mostraron que a concentraciones elevadas, su toxicidad hacia las células sanas disminuye (Figura 3) . Por ejemplo, el extracto T-b inhibe el 40-50% de células de cáncer de colon a concentraciones de entre 3 y 75 ^g/ml, y el 86% de las células a 100 ^g/ml. A su vez, este extracto inhibe el 40% de las células sanas a concentraciones bajas, pero si aumentamos la concentración a 100 ^g/ml, inhibe el 30%, y a 200 ^g/ml el 20%. Por lo tanto, para estos extractos, en lugar de calcular el índice terapéutico, los resultados se mostraron como una proporción del porcentaje de células cancerosas inhibidas a concentración IC50, dividido entre el porcentaje de células sanas inhibidas a la misma concentración. Por consiguiente, se pudo calcular que a niveles de IC50, los extractos T-010 (1600 ^g/ml) y T-f (800 ^g/ml) son, respectivamente, 2, 35 y 2, 5 veces más tóxicas para las células cancerosas que para las células sanas, y el extracto T-b a 100 ^g/ml es 2, 86 veces más tóxica para las células cancerosas que para las células sanas (Figura 3, Tabla 3) . Tabla 3. Proporción del porcentaje de células HCT-116 inhibidas a IC50 y el porcentaje de células CCD-18CO inhibidas a la misma concentración para los extractos cultivados en suspensión con 2, 4-D y no fraccionadas. Estos resultados confirman el efecto antitumoral de los PSs extraídos de cultivos celulares de trigo y su actividad antitumoral selectiva cuando se utilizan los extractos y las dosis óptimos para este fin. Existen extractos que a ciertas dosis muestran una actividad inhibidora de la proliferación incluso mayor en células de fibroblastos sanos CCD-18CO, especialmente cuando se utilizan los extractos T-010, UB-010 o T-f a dosis bajas (de hasta 100 o 400 jg /m l según el extracto) (Figura 3A, 3B, 3E) . Sería ideal dedicar unas líneas a incluir porcentajes de inhibición de estos extractos y sus concentraciones. De esta manera, se obtuvieron las primeras evidencias del potencial antifibrótico de estos extractos de polisacáridos. Inducción de la apoptosis y del arresto del ciclo celular El extracto B-010 se excluyó debido a que causaba la proliferación de las células cancerosas HCT-116 (Figura 2) . Se hicieron tests con el resto de extractos para estudiar su capacidad de inducir apoptosis y arresto del ciclo celular debido a que habían inhibido el crecimiento de las células cancerosas a la vez que eran menos tóxicas para las células sanas. Los resultados de citometría de flujo revelaron que el tratamiento de las células HCT-116 durante 48h con los extractos aumentaba la proporción de células en la fase G0/G1, y disminuía el porcentaje de células en la fase S (Figura 4) . De hecho, la proporción de células no tratadas en la fase G0/G1 era de alrededor del 60%, mientras que en las tratadas era de entre el 68% y el 74%. La influencia del extracto T-b la aumenta hasta el 74%, el extracto T-f al 69%, el extracto A-b al 70%, el extracto A-f al 71% y el extracto T-010 al 67, 5%. No hubo un cambio significativo en el porcentaje de células tratadas con el extracto UB-010 en comparación con el control. El porcentaje de células en la fase S era del alrededor del 30% en células control, mientras que en las células tratadas disminuyó a entre el 11% y el 21% (Figura 4H) . Todos los extractos disminuyeron de forma significativa el número de células en la fase S. El extracto T-b hasta el 17%, el extracto T-f al 21%, el extracto A-b al 13%, el extracto A-f al 18%, el extracto UB-010 al 20%, y el extracto T-010 al 11%. La presente investigación reveló que algunos extractos inducían la apoptosis (Figura 4I) . Los análisis de citometría de flujo mostraron que la fase apoptótica SubG1 se incrementaba cuando las células se trataban con los extractos T-b, A-b, UB-010 y T-010. Particularmente, los niveles de apoptosis más altos (48%) se obtuvieron tratando las células HCT-116 con el extracto T-010, en comparación con el control (4, 6%) . El extracto A-b mostró un efecto bastante fuerte dado que provocó muerte celular programada en el 40, 35% de las células cancerosas. Los extractos T-b y UB-010 mostraron un aumento moderado de células en la fase SubG1, del 20% y del 12, 5%, respectivamente. El porcentaje de fragmentos celulares fue también elevado en dichos extractos, de entre 20% y 60% dependiendo del extracto (Figura 4J) . Sin embargo, no se observó ningún cambio significativo en la fase SubG1 ni en la cantidad de fragmentos celulares tras el tratamiento con los extractos A-f ni T-f en comparación con el control (Figura 4I, 4J) . Microscopía electrónica de células HCT-116 tratadas con los polisacáridos de cultivos celulares de trigo Las imágenes de microscopía electrónica de transmisión revelaron cambios en el núcleo, citoplasma y el espacio intercelular de las células de cáncer de colon HCT-116 cuando se encontraban bajo la influencia de los extractos de polisacáridos de cultivos celulares de trigo (Figura 5) . Núcleo y ampollas. Tratar las células de cáncer de colon con el extracto T-010 llevó a una condensación mayor de la cromatina (Figura 5b) en comparación con las células no tratadas (Figura 5a) ; así como a la pérdida de la membrana nuclear y la presencia de ampollas junto a la célula (Figura 5c) . Cuando se incubaron con los extractos T-b y A-b, se observó que la cromatina se había fragmentado y se encontraba muy cerca de la membrana nuclear, y los poros nucleares eran muy visibles (Figura 5d, 5e) . El tratamiento con el extracto UB-010 provocó cambios similares en el núcleo, aunque la liberación de ampollas al espacio intercelular fue más intensa (Figura 5f) . Mitocondrias. Algunos extractos de polisacáridos de cultivos celulares de trigo mostraron efectos significativos en las mitocondrias, tales como daños y/o agrandamiento. En comparación con las células control (Figura 5g) , el efecto del extracto T-010 causó que las mitocondrias se agrandaran e hincharan, además de presentar sus membranas internas desorganizadas, con daños parciales, vesículas blancas casi vacías y crestas mitocondriales delgadas y apenas visibles (Figura 5h) . Por otro lado, el tratamiento con el extracto T-b también causó alteraciones (Figura 5i) : el tamaño de la mitocondria se duplicó respecto al control (Figura 5a) al visualizar cortes transversales (1000 nm frente a 500 nm) , y aumentó el número de mitocondrias dañadas y rotas (Figura 5b) . No hubo cambios perceptibles en cuanto a tamaño o daños cuando se utilizó el extracto A-b. Con el extracto UB-010, se observó un incremento moderado en el número de mitocondrias dañadas, pero no hubo cambios en su tamaño. Aparato de Golgi. En comparación con células no tratadas (Figura 5j) , el extracto T-010 indujo el hinchamiento del aparato de Golgi (Figura 5k) . El extracto A-b provocó un aumento moderado del tamaño de este orgánulo (Figura 5l) . La incubación de las células HCT-116 con el extracto T-b causó un aparato de Golgi agrandado y en degradación (Figura 5m) . No hubo cambios visibles cuando se utilizó el extracto UB-010. Otros cambios en el citoplasma. Incubar las células con el extracto T-010, al contrario que las células control (Figura 5n) , provocó la aparición de múltiples vacuolas autofágicas o cuerpos apoptóticos (400 x 400 nm y menos) junto a inclusiones de diferentes formas (Figura 5º) . El extracto A-b provocó la aparición de cuerpos multilaminares y vacuolas autofágicas con una triple membrana con inclusiones (600 x 400 nm y menos) (Figura 5p) . El efecto del extracto T-b difirió en que la célula tenía vesículas blancas vacías en el citoplasma además de vesículas con inclusiones (700 x 500 nm) o autofagosomas/autolisosomas (Figura 5q) . El extracto UB-010 contribuyó a la formación de vesículas autofágicas grandes de doble membrana (2000 x 800 nm) , que contenían múltiples orgánulos o vesículas (Figura 5r) . En general, se determine que los extractos T-010, T-b, A-b y UB-010 provocaban cambios significativos en las células cancerosas: dañando la mitocondria, ondensando la cromatina, eliminando la membrana nuclear, produciendo vesículas dentro y fuera (ampollas) de la membrana celular, y cuerpos multilaminares. Curiosamente, una variedad de vacuolas autofágicas de diferentes tamaños presentó inclusiones como gránulos y partes de orgánulos degradados. Se detectaron cambios notables en la morfología de células de cáncer de colon HCT-116 incubadas junto a los extractos T-010, A-b, T-b o UB-010 al analizarlas mediante MEB. Se observó que el efecto del extracto T-010, comparado con las células control (Figura 6A, a y b) disminuía el número de células cancerosas, provocaba que las células se aplanaran, reducía la frecuencia y longitud de las microvellosidades (Figura 6B) , y estimulaba la aparición de cuerpos apoptóticos (o hinchamiento en forma de bola de las células con pérdida de microvellosidades) (Figura 6A, c y d) . Incubar las células con el extracto A-b también modificó la morfología de las células cancerosas de manera similar a el extracto T-010, pero con hinchamiento en forma de bola de las células sin pérdida de microvellosidades. (Figura 6A, e y f) . Además de cambios similares, el extracto UB-010 contribuyó a la formación de dos tipos de cuerpos apoptóticos: con microvellosidades remanentes, y en ausencia de ellas (Figura 6A, g y h) . El tratamiento de células de cáncer de colon con el extracto T-b a concentraciones IC50 causó la aparición de cuerpos apoptóticos (Figura 6A, i y j) , pero a concentraciones elevadas, del doble de IC50, provocó que las células se secaran y solo permaneciera su membrana (Figura 6A, k y l) . Mecanismos moleculares de los extractos de polisacáridos de cultivos celulares de trigo Los ensayos de inmunotransferencia revelaron variaciones en las proteínas que participan en las rutas de apoptosis, ciclo celular y diferenciación (Figura 7) , lo que permitió predecir el mecanismo de acción de los extractos. c-Myc La expresión de la proteína c-Myc (Figura 7A) fue analizada respecto al valor relativo del control (1) . Los extractos T-f, A-f y UB-010 mostraron una disminución significativa en la expresión de esta proteína, con unos valores de 0, 6, 0, 7 y 0, 7 respectivamente. Otros extractos no provocaron ningún cambio significativo en la expresión de la proteína c-Myc. Beta-catenina Dos de los extractos (T-f y A-f) presentaron una menor expresión de beta-catenina (Figura 7B) en comparación con el valor del control (1) . El extracto T-f se redujo al 0, 5, y el extracto A-f hasta el 0, 7. El resto de extractos no mostraron cambios significativos. NFkB p100 Los extractos T-f, A-b, A-f y UB-010 redujeron la expresión de la proteína NFkB p100 (Figura 7C) , la forma temprana de la proteína NFkB p52. El extracto T-f disminuyó la expresión de esta proteína hasta un 0, 65, y los extractos A-b, A-f y UB-010 la disminuyeron hasta un 0, 8. Los extractos T-010 y T-b no tuvieron un efecto significativo en la expresión de NFkB p100. HCAM (CD44) Todos los extractos excepto T-010 provocaron una disminución significativa de la expresión de la proteína HCAM (CD44) (Figura 7D) . Los extractos T-b y UB-010 la disminuyeron hasta un valor de intensidad del 0, 5 en comparación con el control (1) . Los extractos T-f y A-b la disminuyeron hasta un 0, 2, y el extracto A-f hasta un 0, 7. Bax La activación de la proteína bax se consiguió con todos los extractos de PSs (Figura 7E) . Los extractos T-b, T-f, A-b y A-f la incrementaron hasta el doble (valor de 2) de la intensidad del control (1) . Los extractos UB-010 y T-010 provocaron un incremento mayor, del 3, 5 y del 5, 2, respectivamente. Citocromo C Los ensayos de inmunotransferencia permitieron detectar en qué medida se libera el citocromo C al citosol (Figura 7F) . La liberación fue provocada por cuatro extractos: T-b, T-f, A-b y T-010. El extracto T-b causó el doble de liberación, el extracto T-f la incrementó hasta 1, 6, el extracto A-b hasta 1, 7, y el extracto T-010 a 1, 6. Los extractos A-f y UB-010 no provocaron un cambio significativo. Caspasa3 El aumento de los valores normalizados de expresión de pro-caspasa 3 (Figura 7G) fueron mayores en comparación con el control (1) tras el tratamiento con cada uno de los extractos. Los valores obtenidos para las células tratadas con T-b, T-f, A-b, A-f, UB 010, T-010 fueron, respectivamente, de 1, 9; 2, 0; 1, 5; 1, 7; 1, 15 y 1, 25. Caspasa 8 En cuatro de los extractos, concretamente T-b, T-f, A-b y T-010, los valores de expresión de la caspasa 8 aumentaron hasta 1, 5; 1, 4; 1, 57; y 1, 3, respectivamente. Los extractos UB-010 y A-f no provocaron una mayor liberación de la caspasa 8 (Figura 7H) . Por lo tanto, todos los extractos mostraron una influencia en el aumento de la expresión de las proteínas bax y la caspasa 3. También se estableció que los extractos T-b, T-f, A-b, T-010 provocaban un aumento significativo en los niveles de citocromo C y caspasa 8. Los extractos T-f, UB-010 y A-f indujeron la reducción de la expresión de c-Myc. La expresión de beta-catenina fue inhibida por los extractos T-f y A-f. Tratar las células con los extractos A-f, T-f, UB-010 y A-b provocaron una reducción de la proteína NFkB p100. También hubo diferencias considerables en la expresión de NFkB p52 cuando se trató con los extractos B-010 y T-010 (no contemplado en las figuras) . Por último, todos los extractos disminuyeron la expresión de CD44. Discusión Es ampliamente conocido que los PSs naturales son a menudo caracterizados en base a su peso molecular, composición en monosacáridos, grupos funcionales, y enlaces químicos [77]. Todas estas características ayudan a predecir la actividad biológica de estos polisacáridos, aunque los procesos de aislamiento, purificación, y fraccionamiento pueden afectar [78]. Sin embargo, dada la dificultad de identificar con precisión la estructura de los PSs naturales debido a su complejidad y variabilidad, el análisis estructural puede omitirse para centrarse en determinar su bioactividad in vitro e in vivo [7]. Por lo tanto, en la presente invención el enfoque central ha sido determinar la importancia de las condiciones de crecimiento de los cultivos celulares para la obtención de PSs con diferentes efectos biológicos, concretamente sobre los procesos de apoptosis, diferenciación y proliferación celular. En este sentido, se obtuvieron distintos extractos de polisacáridos de cultivos en suspensión mediante la modificando los tiempos y medios de cultivo utilizando Triticum aestivum, cuyas propiedades fisicoquímicas, composición química, peso molecular, y diferencias en composición de los extractos tempranas han sido previamente studiadas [61, 62, 63]. Del resto de extractos, obtenidos tras un tiempo de cultivo mayor, no se han hecho análisis de composición de monosacáridos, siendo la prioridad conocer su actividad biológica. En estudios anteriores se ha discutido que el tiempo de cultivo celular de plantas podría alterar los compuestos químicos resultantes en el medio [79]. De hecho, cuando se cultivó arroz en suspensión durante 3 semanas, se consiguió un efecto antitumoral considerable, lo que los autores explicaron por la aparición de metabolitos secundarios durante cultivos prolongados [80]. Por lo tanto, se asumió que existiría una diferencia en la actividad de los PSs obtenidos de células de trigo cuando se cultivaran durante periodos más largos. Debido a que los diferentes extractos presentaron distintos niveles de actividad, se necesitaron diferentes dosis de las mismas para conseguir el efecto inhibidor en las células. En general, los extractos A fueron menos tóxicos para las células de fibroblastos sanos de manera dosis-dependiente, mientras que los extractos T mostraron un efecto dosis-respuesta invertido, donde las concentraciones menores inhiben en mayor medida a las células sanas, y viceversa. En este estudio se identificaron diferencias en los mecanismos de acción y en los cambios morfológicos a nivel celular que provocaban los diferentes extractos de PSs. Para la mayor parte de los extractos se pudo determinar el IC50, pudiendo conseguirse incluso a valores de concentración muy bajos, incluso de 10 ^g/ml para el extracto A-f, 160 ^g/ml para el extracto A-b, y entre 50 y 100 ^g/ml para el extracto T-b. Los extractos T-010, UB-010 y T-f mostraron un IC50 mucho más elevado (1600 ^g/ml) . En general, se encontró que los extractos A tienen índices terapéuticos considerables y eran menos tóxicos para las células sanas, y los extractos T afectaban entre 2, 35 y 2, 86 veces más a las células cancerosas que a las células sanas a concentraciones IC50. Además, durante los análisis de citometría de flujo, se reveló que el tratamiento de células de cáncer de colon con todos los extractos de polisacáridos provocaba un arresto del ciclo celular en la fase G0/G1. Además, los extractos A-f y T-f disminuyeron el porcentaje de células en la fase G2/M, mientras que los extractos A-b, UB-010 y T-010 lo aumentaron. En cuanto a los mecanismos moleculares, se hicieron ensayos de apoptosis que demostraron que los extractos A-f y T-f no provocaron cambios ni en el nivel de apoptosis ni el de fragmentación celular respecto al control. Mientras tanto, algunos extractos sí que indujeron apoptosis: tras 48h de exposición, el extracto T-010 a 1600 ^g/ml indujo apoptosis al 48% de las células; 160 ^g/ml del extracto A-b a un 40%; 1600 ^g/ml del extracto UB-010 al 13, 5%; y 100 ^g/ml del extracto T-b al 16, 7%; mientras que los controles solo presentaban un 4, 5% de apoptosis. El porcentaje de restos celulares varió entre el 20 y el 60%, mayor que en los controles (10%) . Los análisis de MET también confirmaron apoptosis en los extractos T-010, A-b, UB-010 y T-b. Se encontraron numerosos signos de apoptosis: fragmentación y condensación de la cromatina [29], mitocondrias grandes y dañadas con membranas desorganizadas, mitocondrias degradadas, vacuolas autofágicas con partículas en su interior, aparato de Golgi hinchado, ausencia de membrana nuclear, ampollas y cuerpos multilaminares. De acuerdo a los análisis de MET, la acumulación de vacuolas autofágicas con una membrana individual, doble o triple, podría significar el bloqueo de flujo autofágico, implicando que la célula está muriendo [81, 82]. Notablemente, el tamaño de las mitocondrias cambió significativamente por el extracto T-b, y el número de mitocondrias dañadas con ausencia o crestas dañadas aumentó con tres extractos (T-010, UB-010 y T-b) . Mediante MEB, se detectaron cuerpos apoptóticos y una disminución en el número de vellosidades bajo el efecto de PSs. En cuanto a los mecanismos moleculares, en este estudio se detectó el aumento de varias proteínas en células HCT-116: Bax y citocromo C liberado, relacionadas con la vía intrínseca; la caspasa 8, relacionada con la vía extrínseca; y el ejecutor final de la apoptosis de ambas rutas, la caspasa 3. Cuatro extractos, T-010, A-b, T-b y T-f, aumentaron el nivel de la caspasa 8, indicando que activan la ruta extrínseca de la apoptosis, a excepción del extracto T-f que, según los resultados de los ensayos sobre el ciclo celular, no provoca apoptosis. También se reveló que los extractos T-f y A-f inhibían la expresión de la proteína betacatenina, sugiriendo un bloqueo de la ciclina D1, la ruta génica APC, limitando la proliferación celular [38]. Estos mismos extractos, junto a el extracto UB-010, disminuyeron los niveles de c-Myc y confirmando así la inhibición del crecimiento elular en células de cáncer colorrectal HCT-116. Dado que los extractos T-f y A-f no presentaron signos de apoptosis u otro tipo de muerte celular, tendrían un rol activo en los procesos de diferenciación dada la disminución en c-Myc y beta-catenina. Estos mismos extractos también mostraron bajos niveles de CD44, confirmando este hecho. Además, también bloquean el ciclo celular en todos sus puntos: G0/G1, S y G2/M. El extracto T-f, por su parte, provocó una alta liberación de citocromo C sin causar ningún tipo de muerte celular, proteína que también puede participar en los procesos de diferenciación [44]. En cuanto a la proteína CD44, se encontró que todos los extractos excepto T-010 atenuaban su expresión, remarcando su capacidad de inducir la diferenciación de las células cancerosas, y además contribuyendo a disminuir la progresión y la metástasis. Finalmente, se demostró que los extractos T-f, A-f, A-b y UB-010 reducían los niveles de NFkB 2 p100, y T-010 y UB-010 los de la proteína p52, inhibiendo la ruta alternativa de NFkB y con ello inducirían también la diferenciación de las células cancerosas, junto a apoptosis en el caso de A-b y UB-010. En cuanto al potencial antifibrótico, los resultados obtenidos por los inventores mostraron que los extractos de PSs de cultivo celular de trigo, concretamente los extractos T-010, T-b, A-b y UB-010, inducían la acumulación de las células en la fase G2/M del ciclo celular. Además, confirmaron la apoptosis por la detección de la ruptura de las caspasas 3 y 8 en estos extractos. También mostraron que los niveles de betacatenina y c-Myc se encontraban reducidos. Por último, se ha demostrado que especialmente los extractos T-010, UB-010 y T-f inhiben el crecimiento de las células de fibroblastos CCD-18CO. Estas observaciones, junto al hecho de que los PSs contienen galactosa, la cual es capaz de unirse al extremo terminal de unión de azúcares de la proteína gal-3, indican que los extractos de PSs de cultivos celulares actúan como inhibidores de gal-3. Esto permite concluir que los diferentes extractos, los cuales se diferencian en el medio de cultivo (siendo extractos A o T) y en el tiempo de cultivo de los callos embriogénicos y posteriormente de las células en suspensión, presentan diferentes niveles de citotoxicidad y activan distintos procesos y rutas. Los extractos A tienden a ser más efectivos matando células cancerosas a concentraciones más bajas además de tener na menor citotoxicidad para las células sanas. Los extractos T necesitan de dosis más altas para combatir las células cancerosas, pero su efecto y el del extracto alcalino UB-010 en fibroblastos sanos evidencia un potencial prometedor para el tratamiento de la fibrosis. Los polisacáridos de los extractos derivados de los cultivos a corto y medio plazo inducen apoptosis mediante las vías intrínseca y extrínseca (a excepción de UB-010) , y contribuirían también a la diferenciación celular de células cancerosas. Los extractos de polisacáridos obtenidos tras el cultivo a largo plazo, inhiben las rutas APC, NFkB y reducen los niveles de CD44, sugiriendo su papel como agentes diferenciadores. Referencias 1. Diegues, G.; Ferro, C.;Pyenson, B. A Multi-Year Look at the Cost Burden of Cancer Care. New York: Millian. Inc. 2017, pp.1-4. 2. Sung, H.; Ferlay, J.; Siegel, RL.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2020. https://doi.org/10.3322/caac.21660 3. Marmol, I.; Sánchez-de-Diego C.; Pradilla Dieste A.; Cerrada E.; Rodriguez Yoldi M.J.; Colorectal Carcinoma: A General Overview and Future Perspectives in Colorectal Cancer. Int J Mol Sci. 2017, 18 (1) , 197, doi:10.3390/ijms18010197 4. Stewart, B.; Wild, C.P.; (Eds.) World Cancer Report 2014; International Agency for Research on Cancer (IARC) : Lyon, France, 2014, pp. 6-8. 5. Brody, H. Colorectal cancer. Nature.2015, 521, S1. doi: 10.1038/521S1a 6. Xu H.; Xu X. Polysaccharide, a Potential Anticancer Drug with High Efficacy and Safety. Journal of Oncology Research and Treatments, 2016, 1, 2. 7. Pang P.; Wang F.; L. Zhang. Dose matters: Direct killing or immunoregulator y effects of natural polysaccharides in cancer treatment. Carbohydrate Polymers, 2018, 195. pp. 243-256.https://doi.org/10.1016/j.carbpol.2018.04.100 8. Meng X.; Liang H.;Luo L. Antitumor polysaccharides from mushrooms: a review on the structural characteristics, antitumor mechanisms and immunomodulating activities. Carbohydr. Res.2016, 424, pp. 30-41. doi: 10.1016/j.carres.2016.02.008 9. Liu, J.; Willfor, S.; and Xu, C. A review of bioactive plant polysaccharides: biological activities, functionalization, and biomedical applications. Bioact.Carbohydr. Diet. Fibre.2015, 5, pp. 31-61. doi: 10.1016/j.ijbiomac.2016.06.086 10. KishanGopalRamawat, Jean-Michel Mérillon, Polysaccharides, bioactivity and biotechnology. Chapter 72. 2015. pp. 2179-2215. https://doi.org/10.1007/978-3-319-16298-0 11. Schepetkin I. A.; Quinn M. T. Botanical polysaccharides: macrophage immunomodulation and therapeutic potential. Int. Immunopharmacol.2006, 6, pp. 317 333. doi: 10.1016/j.intimp.2005.10.005 12. Caffall, K.H.; Mohnen, D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides. Carbohydr. Res.2009, 344, pp. 1879-1900. 13. Gorshkova, T.A.;KozlovaL.V.;Mikshina P.V. Spatial structure of plant cell wall polysaccharides and its functional significance. Biochemistr y , 2013, 78, pp. 836-853. 14. Li, N.; Wang, Ch.;Georgiev, M. I.; Bajpai, V. K.;Tundis, R.;Simal-Gandara, J.; Lu, X.;Xiao, J.;Tang, Xi.;Qiao, X.; Advances in dietar y polysaccharides as anticancer agents: Structure-activity relationship. Trends in Food Science & Technology. 2021, 111, pp. 360-377.https://doi.org/10.1016/j.tifs.2021.03.008 15. Shi J. J.; Zhang J. G.; Sun Y. H.; Qu J.; Li L.; Prasad C. et al. Physicochemical properties and antioxidant activities of polysaccharides sequentially extracted from peony seed dreg. Int. J. Biol. Macromol. 2016, 9, pp. 23-30. 10.1016/j.ijbiomac.2016.05.082 16. Mohammed, A.S.A.;Naveed, M. &Jost, N. Polysaccharides; Classification, ChemicalProperties, andFuturePerspectiveApplicationsinFieldsofPharmacologyandBiologicalMedicine (A Review of Current Applications and Upcoming Potentialities) . J PolymEnviron. 2021. https://doi.org/10.1007/s10924-021-02052-2 17. Wang, J.; Hu, S.; Nie, S.; Yu, Q.; Xie, M. Reviews on mechanisms of in vitro antioxidant activity of polysaccharides. Oxid Med Cell Longev. 2016. https://doi.org/10.1155/2016/5692852. 18. Muralikrishna, G.; SubbaRao, M. V.S.S.T. Cereal Non-Cellulosic Polysaccharides: Structure and Function Relationship - An Overview. Critical Reviews in Food Science and Nutrition. 2007. 6. pp. 599-610. 19. Cui, Steve W.; Wang, Qi, Cell wall polysaccharides in cereals: chemical structures and functional properties. Structural Chemistr y . 2009. 20:2, pp. 291-297. 20. Wang, Li; Li, Yulin; Zhu, Lidan; Yin, Ran; Wang, Ren; Luo, Xiaohu; Li, Yongfu; Li, Yanan; Chen, Zhengxing. Antitumor activities and Immunomodulator y of rice bran polysaccharides and its sulfates in vitro. Int. J. Biol. Macromolecules. 2016. 21. Wheat bran polysaccharide with antitumor and immune regulation activities and xtraction method thereof, patent CN101705268B, accessed 20.01.2019, https://patents.google.com/patent/CN101705268B/en 22. Gunter E.A., OvodovYu.S., Production of Polysaccharides by Silene vulgaris Callus Culture Depending on Carbohydrates of the Medium. Biochemistr y (Moscow) . 2003. 68: 8, pp. 882-889. 23. Mahmoudifar N., Chai E., Dunstan D., Lane A., Production and applications of novel plant cell culture polysaccharides. Part I. In Hydrocolloids. Ed. By Nishinari K., Publisher: Elsevier. 2000. pp. 135-138. 24. Gunter E.A., OvodovYu.S. KhimijaRastitelnogoSyrja [Chemistr y of plant raw materials] 2001, 2, pp. 57-62 (in Russian) . 25. Ochoa-Villarreal, M.; Aispuro-Hernández, E.; Martínez-Téllez A. and Vargas-Arispuro I. Plant cell wall polymers function, structure and biological activity of their derivatives. Chapter 4. In Polymerization, Ailton De Souza Gomes, Publisher: Intech, Croatia, 2012, pp. 63-74. DOI: 10.5772/46094. 26. Kieran P.M. Bioreactor design for plant cell suspension cultures. Chapter 14. In Multiphase Bioreactor design. Ed. by Joacuim M.S. Cabral, Publisher: Francis and Taylor, Lonfon, UK, 2001, pp.417-422. 27. García, M.A.; Carrasco, E.; Ramírez A.; Jiménez, G.; Elena L.-R.; PeránM.;Picón M.; Campos, J.; Boulaiz, H. and Marchal, J.A.Chapter 5. Apoptosis as a therapeutic target in cancer and cancer stem cells: novel strategies and futures perspectives, InApoptosis and medicine, Ntuli, T.M. (Ed.) , Intech, New York, 2012, pp. 111-117, 10.5772/48267 28. Hanahan, D; Weinberg, R. The hallmarks of cancer, Cell, 2000, 100, pp. 57-70. 29. Balvan, J.; Krizova, A.; Gumulec J.; Raudenska M.; Sladek Z.; Sedackova M. et al. Multimodal Holographic Microscopy: Distinction between Apoptosis and Oncosis. PloS ONE, 2015, 10 (3) e0121674. pmid:25803711 30. Zhou Y.; Zhou X.; Huang X.; Hong N.; Zhang K.; Qi W.; Guo M.; and Nie Sh. Lysosome-Mediated Cytotoxic Autophagy Contributes to Tea Polysaccharide-Induced Colon Cancer Cell Death via mTOR-TFEB Signaling, Journal of Agricultural and Food Chemistr y . 2021, 69 (2) , pp. 686-697 DOI: 10.1021/acs.jafc.0c07166 31. Kerr, J.F.; Wyllie, A.H.; Currie, A.R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer, 1972, 26, pp. 239-257. 32. Ledoux, A.; Perkins, D. N.; NF-kB and the cell cycle. Biochemical Society Transactions, 2014, 42, pp. 76-81. 33. Sun, Y.; Liu, W. Z.; Liu, T.; Feng, X.; Yang, N.; Zhou, H. F. Signaling pathway f MAPK/ERK in cell proliferation, differentiation, migration: Senescence and apoptosis. Journal of Receptor and Signal Transduction Research, 2015, 35, pp. 600 604. 34. Xiong, W.; Li, J.; Jiang, R.; Li, D.; Liu, Z.; Chen, D. Research on the effect of ginseng polysaccharide on apoptosis and cell cycle of human leukemia cell line K562 and its molecular mechanisms. Experimental and Therapeutic Medicine, 2017, 13, pp. 924-934. 35. Abraha, A.M.; Ketema, E.B. Apoptotic pathways as a therapeutic target for colorectal cancer treatment. World J. Gastro. Oncol. 2016, 8, pp. 583-591. 36. Pfeffer, C.M.; Singh, A.T.K. Apoptosis: A Target for Anticancer Therapy. Int. J. Mol. Sci.2018, 19, 448. 37. Mcllwain, D.R.; Berger, T.; Mak, T.W. Caspase functions in cell death and disease. Cold Spring Harb. Perspect. Biol.2015, 7. 38. Tetsu, O.; McCormick, F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature, 1999, 398, pp. 422-426. 39. Saifo, M. S.; Rempinski, D. R.; Rustum, Y. M., &Azrak, R. G. Targeting the oncogenic protein beta-catenin to enhance chemotherapy outcome against solid human cancers. Molecular cancer, 2010, 9, 310. doi:10.1186/1476-4598-9-310 40. He, T.C.; Sparks, A.B.; Rago, C.; Hermeking, H., Zawel, L., Da Costa, L.T.; Morin P.J.; Vogelstein B and Kinzler KW: Identification of c-MYC as a Target of the APC Pathway. Science, 1998, 281 (5382) , pp. 1509-1512. 41. Demeterco, C; Itkin-Ansari, P.; Tyrberg, B.; Ford, L.P.; Jarvis, R.A. et al. c-Myc controls proliferation versus differentiation in human pancreatic endocrine cells. J ClinEndocrinolMetab. 2002, 87, pp. 3475-3485. 42. Leu, W.J.; Chang, H. S.; Chan, S. H.; Hsu, J. L.; Yu, C. C.; Hsu, L. C.; Guh, J. H.; Reevesioside A, a cardenolide glycoside, induces anticancer activity against human hormone-refractor y prostate cancers through suppression of c-myc expression and induction of G1 arrest of the cell cycle. PloS one, 2014., 9 (1) , e87323. doi:10.1371/journal.pone.0087323. 43. Jakoby, M.; Schnitter A. Cell cycle and differentiation. Current Opinion in Plant Biology. 2004. 7:6, pp. 661-669. 44. Garrido, C.; Galluzzi, L.; Brunet, M.; Puig, P E.; Didelot, C.; Kroemer, G.; Mechanisms of cytochrome c release from mitochondria, Cell Death and Differentiation, 2006, 13, pp. 1423-1433, https://doi.org/10.1038/sj.cdd.4401950 45. Su, Y.J.; Lai, H.M.; Chang, Y.W.; Chen, G.Y.; Lee, J.L. Direct reprogramming f stem cell properties in colon cáncer cells by CD44. EMBO J. 2011, 30 (15) , pp. 3186 3199. 46. Xu, H.; Tian, Y.; Yuan, X. et al. The role of CD44 in epithelial-mesenchymal transition and cáncer development. Onco Targets Ther. 2015, 8, pp. 3783-3792. doi:10.2147/OTT.S95470; 47. Pham, P.V.; Phan, N.L.; Nguyen, N.T. et al. Differentiation of breast cancer stem cells by knockdown of CD44: promising differentiation therapy. J Transl Med. 2011, 9, 209. doi:10.1186/1479-5876-9-209 48. Merga, Y. J.; et al. Importance of the alternative NF-KappaB activation pathway in inflammation-associated gastrointestinal carcinogenesis. American journal of physiology. Gastrointestinal and liver physiology, 2016, 310, pp. 1081-1090, doi:10.1152/ajpgi.00026.2016 49. Weber C.K.; Liptay, S.; Wirth, T.; Adler, G.; Schmid, R. M.Suppression of NF-kappaB activity by sulfasalazine is mediated by direct inhibition of IkappaB kinases alpha and beta. Gastroenterology, 2000, 119, pp. 120.- 1218. 50. Horst, D.; Budczies, J.; Brabletz, T.; Kirchner, T.; Hlubek, F. Invasion associated up-regulation of nuclear factor kappaB target genes in colorectal cancer. Cancer. 2009, 115, pp. 4946-58. 51. Kendall, R.T. and Feghali-Bostwick, C.A. Fibroblasts in fibrosis: novel roles and mediators. Front. Pharmacol. 2014, 5, 123. doi: 10.3389/fphar.2014.00123 52. Nakajima K, Balan V., Raz A., Galectin-3: an immune checkpoint target for musculoskeletal tumor patients. Cancer and Metastasis Reviews. 2021, 40:297-302 53. Nangia-Makker P., Hogan V., Raz A., Galectin-3 and cancer stemness. Glycobiology. 2018. V.28, N4, pp. 172-181 54. Hsieh T., Wu J.M. Changes in cell growth, cyclin/kinase, endogenous phosphoproteins and nm23 gene expression in human prostatic JCA-1 cells treated with modified citrus pectin. Biochem. Mol. Biol. Int. 1995;37:833-841. 55. Lehr J.E., Pienta K.J. Preferential adhesion of prostate cancer cells to a human bone marrow endothelial cell line. J. Natl. Cancer Inst. 1998;90:118-123. doi: 10.1093/jnci/90.2.118. 56. Li L-C, Li J, Gao J. Functions of galectin-3 and its role in fibrotic diseases. J Pharmacol Exp Ther. 2014;351: 336-343. 57. Eliaz I., Raz A., Pleiotropic effect of modified citrus pectin. Nutrients. 2019. 11, 2619 58. Yu L., Ruifrok W.P., Meissner M., Bos E.M., van Goor H., Sanjabi B., van der Harst P., Pitt B., Goldstein I.J., Koerts J.A. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis. Circ. Heart Fail. 2013;6:107-117. doi: 10.1161/CIRCHEARTFAILURE.112.971168. 59. Martínez-Martínez E., López-Ándres N., Jurado-López R., Rousseau E., Bartolomé M.V., Fernández-Celis A., Rossignol P., Islas F., Antequera A., Prieto S. Galectin-3 participates in cardiovascular remodeling associated with obesity. Hypertension. 2015;66:961-969. doi: 10.1161/HYPERTENSIONAHA.115.06032. 60. Bishimbayeva, N.K. Cytophysiological basis of biotechnology of long-term plant regeneration in the tissue culture of cereals, Thesis for doctor of biological sciences, Almaty, 2007, p. 38 (In Russian) . 61. Bishimbayeva, N.K.; Sartbayeva, I.A.; Murtazina, A.S.; Gunter, E.A. Chemical composition of polysaccharides from wheat cell culture. International Journal of Biology and Chemistr y , 2015, 8 (2) , pp. 1.- 17. 62. Kazybekova, S. K.; Bishimbayeva, N. K.; Murtazina, A. S., Tazhibaeyva, S. M., Miller, R. Physico-chemical properties of physiologically active polysaccharides from wheat tissue culture. International Journal of Biology and Chemistr y , 2015, 8 (2) , pp. 18-22, ISSN 2409-370X. 63. Bishimbayeva, N.K.; Murtazina, A.S.; McDougall, G.J. Influence of phytohormones on monosaccharide composition of polysaccharides from wheat suspension culture. Eurasian Chemico-Technological Journal, 2017, 19, pp. 251-257. 64. Bento, J.F.; Noleto G.R.; Oliveira Petkowicz C.L. Isolation of an arabinogalactan from Endopleura uchi bark decoction and its effect on HeLa cells. Carbohydr. Polym., 2014.101, pp. 871-877 65. Vetvicka V.; Vetvickova J. Glucans and cancer: comparison of commercially available beta-glucans - Part IV. Anticancer research.2018. 38. pp. 1327-1333. 66. Cao, L., Liu, X.; Qian, T, ; Sun, G.;Guo, Y.; Chang, F.; Zhou, S.; Sun, X. Antitumor and immunomodulator y activity of arabinoxylans: A major constituent of wheat bran. International journal of biological macromolecules. 2011.48. pp. 160-4. 67. Ibarrola J., Matilla L., Martínez-Martínez E., Gueret A., Fernández-Celis A., Henr y J.-P., Nicol L., Jaisser F., Mulder P., Ouvrard-Pascaud A. Myocardial Injur y After Ischemia/Reperfusion Is Attenuated By Pharmacological Galectin-3 Inhibition. Sci. Rep. 2019;9:9607. doi: 10.1038/s41598-019-46119-6. 68. Cao, Li. y otros.- "Wheat bran polysaccharide with antitumor and immune regulation activities and extraction method thereof" . CN101705268A. 69. Murashige, T.; Skoog, F. A revised médium for rapid growth and bioassays with tobacco tissue cultures, Phisiol. Plant. 1962, 15, pp. 473-497. 70. Austin, C., Stewart, D., Allwood, J.W., McDougall G.J. Extracts from the edible seaweed Ascophyllum nodosum inhibit lipase activity in vitro: contributions of phenolic and polysaccharide components. 2018. Food Funct 9 (1) , pp. 502-510 71. Dubois, M.; Gilles, K.A.; Hamilton, J.K.; Rebers, P.A.; Smith F. Colometric Method for Determination of Sugars and Related Substances, Analytical Chemistr y , 1956, 28, 3. pp. 350-356. 72. Ramírez, A.; Boulaiz, H.; Morata-Tarifa, C. et al. HER2-signaling pathway, JNK and ERKs kinases, and cancer stem-like cells are targets of Bozepinib. Oncotarget, 2014, 5 (11) , pp. 3590-3606; 73. Marchal, J.A.; Boulaiz, H.; Suarez, I.; Saniger, E.; Campos, J.; Carrillo, E.; Prados, J.; Gallo, M.A.; Espinosa, A.; Aranega, A. Growth inhibition, G (1) -arrest, and apoptosis in MCF-7 human breast cancer cells by novel highly lipophilic 5-fluorouracil derivatives. Invest New Drugs. 2004, 22 (4) , pp. 379-389. 74. Boulaiz, H.; Prados, J.; Melguizo, C.; García, A.M.; Marchal, J.A.; Ramos, J.L.; Carrillo, E; Vélez, C.; Aranega, A. Inhibition of growth and induction of apoptosis in human breast cancer by transfection of gef gene. Br J Cancer. 2003, 7, 89 (1) , pp. 192 8. PubMed PMID: 12838323; PubMed Central PMCID: PMC2394231. 75. Cáceres, B.; Ramirez, A.; Carrillo, E.; Jimenez, G.; Griñán-Lisón, C.; López-Ruiz, E.; Jiménez-Martínez, Y.; Marchal, J.A.; Boulaiz, H. Deciphering the Mechanism of Action Involved in Enhanced Suicide Gene Colon Cancer Cell Killer Effect Mediated by Gef and Apoptin. Cancers (Basel) .2019, 23, 11 (2) . 76. Ramírez, A.;Boulaiz, H.;Morata-Tarifa, C.; Perán, M.; Jiménez, G.;Picon-Ruiz, M.;Agil, A.; Cruz-López, O.;Conejo-García, A.; Campos, J.M.; Sánchez, A.;García, M.A.;Marchal, J.A.; HER2-signaling pathway, JNK and ERKs kinases, and cancer stem-like cells are targets of Bozepinib small compound. Oncotarget. 2014, 15, 5 (11) , pp. 3590-606. 77. Ferreira, S.S.; Passos, C.P.; Madureira P.; Vilanova M.; Coimbra M.A. Structure-function relationships of immunostimulator y polysaccharides: a review. Carbohydr. Polym., 2015. 132., pp. 378-396 78. Friedman M., Mushroom Polysaccharides: Chemistr y and Antiobesity, Antidiabetes, Anticancer, and Antibiotic Properties in Cells, Rodents, and Humans. Foods. 2016. 29;5 (4) ., pp. 80. doi: 10.3390/foods5040080. PubMed PMID: 28231175; PubMed Central PMCID: PMC5302426. 79. Efferth, T., Biotechnology applications of plant callus cultures. Engineering. 2019. 5 (1) . pp. 50-59. 80. Deshpande A, Dhadi SR, Hager EJ, Ramakrishna W. Anticancer activity of rice callus suspensión culture. Phytother Res 2012;26 (7) :1075-81. 81. Taylor, R.C.; Cullen, S.P.; Martin, S.J.; Apoptosis: controlled demolition at the cellular level. Nat Rev Mol Cell Biol.2008, 9, pp. 231-241. 82. Pan, H.; Wang, Y.; Na, K. et al. Autophagic flux disruption contributes to Ganoderma lucidum polysaccharide-induced apoptosis in human colorectal cancer cells via MAPK/ERK activation. Cell Death Dis. 2019, 10, p. 456. https://doi.org/10.1038/s41419-019-1653-7.
Publicaciones:
ES2956393 (20/12/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 12/05/2022 se realizó Registro Instancia de Solicitud
En fecha 13/05/2022 se realizó 3003_Registro Doc. Subsanación Defectos en Admisión a Trámite Patente Invención
En fecha 18/08/2022 se realizó Publicación Defectos Admisión a Trámite
En fecha 26/08/2022 se realizó Admisión a Trámite
En fecha 26/08/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 15/09/2022 se realizó Superado examen de oficio
En fecha 18/04/2023 se realizó Realizado IET
En fecha 20/04/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 20/12/2023 se realizó Publicación Solicitud
En fecha 20/12/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 04/04/2024 se realizó Validación petición y/o pago de examen sustantivo no conforme
En fecha 04/04/2024 se realizó Retirada
En fecha 04/04/2024 se realizó 1108P_Notificación retirada solicitud por no petición y/o pago de examen sustantivo
En fecha 10/04/2024 se realizó Publicación retirada solicitud por no petición y/o pago de examen sustantivo
Pagos:
13/06/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 27/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419
El registro de patente nacional por EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419 fue solicitada el 12/05/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419 fue solicitada por UNIVERSIDAD DE GRANADA. El registro [modality] por EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419 está clasificado como C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419 está clasificado con la clasificación C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91 por lo que si se desea conocer más registros con la clasificación C12P 19/04,A61K 36/899,A61K 31/715,A61P 35/00,C12R 1/91 clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12
Es posible conocer todas las patentes registradas en la clase C12 (BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUT) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12P
Es posible conocer todas las patentes registradas en la clase C12P (PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DA) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61
Es posible conocer todas las patentes registradas en la clase A61 (CIENCIAS MEDICAS O VETERINARIAS; HIGIENE) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61K
Es posible conocer todas las patentes registradas en la clase A61K (PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO ) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61P
Es posible conocer todas las patentes registradas en la clase A61P (ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12R
Es posible conocer todas las patentes registradas en la clase C12R (SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C-C12Q, RELATIVO A LOS MICROORGANISMOS) entre las que se encuentra la patente EXTRACTOS DE POLISACÁRIDOS DE CEREAL, MÉTODO PARA OBTENERLOS, COMPOSICIÓN FARMACÉUTICA QUE LO CONTIENE Y SU USO COMO AGENTE ANTITUMORAL Y/O ANTIFIBRÓTICO con el número P202230419. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.


 P202230413
P202230413