- Home /
- Publicaciones de patentes /
- PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG
Patente nacional por "PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG"
Este registro ha sido solicitado por
Persona física
a través del representanteNICOLÁS ESCUDERO PRIETO
Contacto
- Estado: A punto de caducar
- País:
- España
- Fecha solicitud:
- 01/04/2022
- Número solicitud:
-
P202230300
- Número publicación:
-
ES2915325
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
Nicolás ESCUDERO PRIETO
- Clasificación Internacional de Patentes:
- G16B 5/00
- Clasificación Internacional de Patentes de la publicación:
- G16B 5/00
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2915325_A11.- Procedimiento implementable por ordenador de caracterización de interacciones dinámicas de fármacos con los canales de Ik o hERG, donde dicho procedimiento comprende la realización de las siguientes etapas: - se modeliza de la interacción entre la Ik o hERG y los fármacos, donde dicha modelización comprende generar un modelo de cadena de Markov; - se selecciona un conjunto de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos, distribuidos en grupos con diferentes cinéticas y afinidades a los estados conformacionales del canal Ik o hERG, donde la distribución de los grupos se basa en los siguientes criterios: o los estados a los que el fármaco se une y se desune y el estado de unión preferente; o la relación entre la tasa de disociación (en inglés, "dissociation rate") del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; o la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto; - se define una pluralidad de protocolos de fijación de voltaje de estimulación eléctrica celular, obteniéndose sus distribuciones de concentración-respuesta correspondientes; estando el procedimiento caracterizado por que comprende, además, las siguientes etapas: - se obtienen los valores de concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (IC50) y de las constantes de tiempo (t) de la corriente de cola normalizada al aplicar un valor de concentración de fármaco sustancialmente igual al IC50 correspondientes para cada protocolo de fijación de voltaje y para la pluralidad de compuestos simulados en la etapa de modelización de fármacos; - se interpolan los valores de IC50 a una línea, en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, y de su estado de unión preferente; - se interpolan los valores de t a una línea, en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, y de su estado de unión preferente; - se clasifican los compuestos realizando las siguientes subetapas, realizadas mediante SVMs e interpolación lineal: o se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que se une cada compuesto, y se clasifican los compuestos , compuesto se asigna al grupo correspondiente a la línea interpolada más cercana; o se asigna cada compuesto al grupo correspondiente a la línea interpolada de su constante de tiempo (t) más cercana, calculándose la distancia entre cada compuesto y todas las líneas, y determinándose si el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica; y o se asigna cada compuesto a una clase, caracterizándolo en función de los estados a los que se une y se desune, y de su estado de unión preferente, según los resultados obtenidos en las subetapas anteriores. 2. - Procedimiento según la reivindicación anterior donde, durante la etapa de selección de fármacos, el criterio de distribución de grupos relativo a la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto comprende la formulación de un modelo de cadena Markov al que llamamos desdoblado si se posee dicha capacidad, o de un modelo de cadena de Markov al que llamamos ramificado en caso contrario. 3. - Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de modelización de la interacción k ro hERG comprende la implementación de un modelo de cadena de Markov con cinco estados sin fármaco: tres estados cerrados (C3 , C2 , Ci) , un estado abierto (O) , y un estado inactivado (I) , y hasta cinco estados adicionales con fármaco (C3d, C2d, Cid, Od e Id) . 4. - Procedimiento según la reivindicación anterior, donde la distribución de grupos durante la etapa de modelización de fármacos comprende se basa en los siguientes criterios: - los estados a los que el fármaco se une y se desune y el estado de unión preferente; - la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; - la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, distinguiendo entre modelo ramificado y modelo desdoblado. 5. - Procedimiento según la reivindicación anterior, donde la distinción de los compuestos según su estado de unión comprende las siguientes clases: Abierto, Inactivado, Cerrado, Abiertol, InactivadoO, OI, AbiertoC, CerradoO, CO, AbiertoCI, InactivadoCO, CerradoOl y COI. 6. - Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de modelización de la interacción Ik o hERG comprende crear grupos adicionales de comprobación ompuesto pueden cambiar de estado o no sin desligarse. 7. Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de definición de los protocolos de estimulación eléctrica comprende el uso de protocolos que comprenden, para un valor de temperatura y un valor de concentración de potasio intracelular y extracelular dados: - un pulso de acondicionamiento de voltaje variable; - un pulso de prueba; - opcionalmente, un prepulso; 8. - Procedimiento según la reivindicación anterior, donde los protocolos de estimulación eléctrica comprenden los protocolos P40, P0 y P-80. 9. - Procedimiento según cualquiera de las reivindicaciones 7-8, donde la etapa de definición de los protocolos de estimulación eléctrica comprende la obtención de distribuciones de concentración-respuesta mediante el trazado del pico normalizado de la corriente de cola en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco, y se analiza el pico normalizado de la corriente Ik a la concentración IC50, en función del número de pulsos o del tiempo. 10. - Procedimiento según cualquiera de las reivindicaciones anteriores, que comprende una etapa adicional de optimización donde, una vez caracterizados los compuestos, se calculan las constantes de asociación y disociación para cada estado en el que cada compuesto interacciona con el canal y se procesan mediante un algoritmo de optimización iterativa. 11. - Procedimiento según la reivindicación anterior, donde el algoritmo de optimización iterativa está basado en el algoritmo Nelder-Mead simplex. 12. - Procedimiento según cualquiera de las reivindicaciones anteriores, que comprende el uso de m utaciones en los canales de IKr o hERG. 13. - Procedim iento según cualquiera de las re ivindicaciones anteriores, donde la pluralidad de com puestos correspondientes a los fárm acos com prende com puestos reales, y/o com puestos virtuales cuya form ulación se genera de form a aleatoria o pseudoaleatoria bajo una o más reglas com putacionales. . -para implementar un procedimiento según cualquiera de las reivindicaciones anteriores. 15. - Programa de ordenador que comprende instrucciones configuradas para la ejecuci en un procedimiento según cualquiera de las reivindicaciones 1-13 en un sistema según la reivindicación 14.
Los productos y servicios protegidos por este registro son:
G16B 5/00
Descripciones:
+ ES-2915325_A1 PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE Ikr O HERG CAMPO DE LA INVENCIÓN La presente invención se enmarca en el campo de las de las tecnologías de desarrollo de fármacos y de las ciencias de computación. Más concretamente, la invención se refiere a un procedimiento de modelización y caracterización de interacciones dinámicas de compuestos con los canales de Ik (corriente retardada rectificadora de potasio o, en inglés, "delayed rectifier potassium current") o de hERG (gen humano éter-a-go-go o, en inglés, "human ether-a-go-gorelated gene") . ANTECEDENTES DE LA INVENCIÓN El descubrimiento y el desarrollo de nuevos fármacos ha estado basado, tradicionalmente, en procedimientos de tipo ensayo-error. No obstante, en la práctica estos procedimientos resultan, muchas veces ineficientes, excesivamente dilatados en el tiempo o arriesgados, tanto desde un punto de vista sanitario como desde la inversión en investigación privada o pública. Ello se debe a que, en el caso de muchos medicamentos desarrollados, éstos no llegan al mercado por sus efectos secundarios perjudiciales para la salud y, específicamente para el corazón, debido a potenciales efectos adversos tales como las arritmias ventriculares. Hasta ahora, la evaluación preclínica de la seguridad cardíaca de los nuevos fármacos se ha basado, principalmente, en el estudio del bloqueo in vitro en el gen hERG (que codifica la subunidad a formadora de poros del componente rápido de los canales de la corriente Ik en humanos) producido por el compuesto bajo estudio, y la prolongación in vivo del intervalo QT (medida de tiempo entre el comienzo de la onda Q y el final de la onda T en un electrocardiograma) . Ambos fenómenos han sido relacionados con la aparición de la taquicardia ventricular polimoría ("Torsades de Pointes" o TdP) . Aunque estas pruebas de seguridad han tenido éxito en evitar que fármacos potencialmente peligrosos llegasen al mercado, también han evitado el desarrollo de compuestos con potencial de ser útiles. De hecho, existen fármacos como el verapamil, reconocido como un potente bloqueador de la corriente kr, que no está asociado al desarrollo de TdP. mejora cuando se tienen en cuenta las dinámicas y cinéticas de los mismos. Por ejemplo, la dependencia de la interacción entre un compuesto y un canal determinado con el estado conformacional en el que éste se encuentre puede alterar significativamente los valores de la concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (denominada dicha concentración como IC50) . A su vez, dichos valores también pueden variar dependiendo del protocolo de estimulación y de fijación del potencial de membrana (en inglés, "voltaje-damp") utilizado para medirlo. Por otra parte, en los últimos años ha surgido la iniciativa "Comprehensive In vitro Proarrhythmia Assay (CiPA) , liderada por la Food and Drug Administration (FDA) estadounidense, que persigue mejorar las técnicas de descubrimiento y desarrollo de fármacos mediante la definición de nuevos paradigmas, basados en modelos computacionales que se proponen como herramientas principales para predecir el riesgo de arritmias inducidas por los nuevos fármacos. Esta iniciativa también pone énfasis en un componente farmacodinámico más detallado. Tradicionalmente, la formulación de las acciones de los fármacos en los canales iónicos se simplifican mediante un modelo de bloqueo de poro simple, denominado modelo estático, que utiliza los coeficientes IC50 y coeficientes de Hill para reducir la conductancia de cada corriente iónica. Estos modelos estáticos son sencillos, pero no excesivamente realistas ya que, como se ha mencionado anteriormente, la potencia de bloqueo de los compuestos depende de las condiciones experimentales utilizadas para dilucidarlo. En este ámbito, los modelos dinámicos que modelizan la cinética de unión y separación del fármaco al canal en los distintos estados, como los modelos de Markov, se consideran más realistas y proporcionan información intrínseca que no depende del protocolo experimental. En este sentido resultan relevantes los artículos publicados por Z. Li et al. "Improving the in silico assessment of proarrhythmia risk by combining hERG (human ether- a-go- go- related gene) channel- drug binding kinetics and multichannel pharmacology", Circ. Arrhythm. Electrophysiol. 10, e004628 (2017) y Z. Li et al. "Quantitative Systems Pharmacology Models for a New International Cardiac Safety Regulator y Paradigm: An Overview of the Comprehensive In Vitro Proarrhythmia Assay In Silico Modeling Approach", CPT Pharmacometrics, Syst, Pharmacol (2019) , 8, 371-379. Así pues, la técnica actual propuesta por CiPA para la obtención de modelos dinámicos de los fármacos que bloquean la Ik o hERG utiliza una única cadena de Markov, de la cual deben ajustarse ciertos parámetros (tales como Kmax, Ku, EC50n, N, Vhalf-trap) , lo que permite distinguir fármacos con diferentes cinéticas de unión capturadas por un protocolo de fijación de potencial de membrana dinámico. No obstante, esta técnica está mostrando muchos problemas. Por ejemplo, muchos de los modelos de los fármacos propuestos no logran el bloqueo total de la arámetros resultan, en general, excesivamente complejos y, además, la dependencia con la semilla utilizada para obtener los mismos puede condicionar sus resultados, lo que limita su utilización a personas familiarizadas previamente con métodos de ajuste de parámetros. Finalmente, los protocolos CiPA de fijación de potencial de membrana involucran tiempos bastantes largos en comparación con los tiempos típicos de estabilidad de las células en esas circunstancias. Como consecuencia de estas limitaciones, resulta necesario, en el presente campo técnico, desarrollar nuevos procedimientos y sistemas de modelización alternativos a los conocidos que permitan, entre otras características y ventajas: - Obtener los modelos dinámicos de la interacción de forma automática, sin necesidad de la intervención de personal experto en modelización o en ajuste de parámetros. - Generar los modelos en tiempos reducidos y sin necesidad de una gran exigencia en recursos de computación. - Proporcionar una variedad amplia de los modelos generados. - Consideración de que la unión y desunión del fármaco y del canal se puede producir en cualquier estado del canal. - Implementar protocolos de fijación del potencial de membrana (en inglés, "voltaje-damp") más adecuados que los utilizados actualmente para producir los modelos de los fármacos. La presente invención está destinada a solventar la citada necesidad, mediante un novedoso procedimiento y sistema de modelización automática y caracterización de las interacciones dinámicas de los fármacos con los canales de Ik o hERG. DESCRIPCIÓN BREVE DE LA INVENCIÓN Como se ha descrito en el apartado de antecedentes, para resolver las limitaciones del estado de la técnica anteriormente descritas, la presente invención tiene por objeto proporcionar una tecnología mejorada para caracterizar y modelizar, de forma automática, las interacciones dinámicas de nuevos fármacos con los canales de Ik o hERG. La presente invención también puede utilizarse para modelizar las interacciones dinámicas de cualquier agente con los canales de IKr o hERG. El término agente incluye fármacos, anticuerpos, moléculas pequeñas, compuestos farmacéuticos, péptidos o proteínas, entre otros. Su utilización tampoco queda omo por ejemplo, el estudio de la eficacia de los fármacos antiarrítmicos. Más concretamente, un primer objeto de la invención se refiere a un procedimiento implementable por ordenador de caracterización de interacciones dinámicas de fármacos con los canales de Ik o hERG, donde dicho procedimiento comprende la realización de las siguientes etapas: - se modeliza de la interacción entre la Ik o hERG y los fármacos, donde dicha modelización comprende generar un modelo de cadena de Markov; - se selecciona un conjunto de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos, distribuidos en grupos con diferentes cinéticas y afinidades a los estados conformacionales del canal Ik o hERG, donde la distribución de los grupos se basa en los siguientes criterios: o los estados a los que el fármaco se une y se desune y el estado de unión preferente; o la relación entre la tasa de disociación (en inglés, "dissociation rate") del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; o la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto; - se define una pluralidad de protocolos de fijación de voltaje de estimulación eléctrica celular, obteniéndose sus distribuciones de concentración-respuesta correspondientes. Ventajosamente, el procedimiento de la invención comprende, además, las siguientes etapas: - se obtienen los valores de concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (IC50) y de las constantes de tiempo (t) de la corriente de cola normalizada al aplicar un valor de concentración de fármaco sustancialmente igual al IC50 correspondientes para cada protocolo de fijación de voltaje y para la pluralidad de compuestos simulados en la etapa de modelización de fármacos; - se interpolan los valores de IC50 a una línea en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, los estados a los que el fármaco se une y se desune y de su estado de unión preferente; - se interpolan los valores de t a una línea en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, los estados a los que el fármaco se une y se desune y de su estado de unión preferente; SVMs e interpolación lineal: o se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que se une cada compuesto, y se clasifican los compuestos por su tasa de disociación respecto al estado de unión no preferente, donde cada compuesto se asigna al grupo correspondiente a la línea interpolada más cercana; o se asigna cada compuesto al grupo correspondiente a la línea interpolada de su constante de tiempo (t) más cercana, calculándose la distancia entre cada compuesto y todas las líneas, y determinándose si el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica; y o se asigna cada compuesto a una clase, caracterizándolo en función de los estados a los que se une y se desune, y de su estado de unión preferente, según los resultados obtenidos en las subetapas anteriores. En una realización preferente de la invención, durante la etapa de selección de fármacos, el criterio de distribución de grupos relativo a la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto comprende la formulación de un modelo de cadena Markov al que llamamos ramificado ("stuck", de su término en inglés) si se posee dicha capacidad, o de un modelo de cadena de Markov al que llamamos desdoblado ("unstuck") en caso contrario. En una realización preferente de la invención, la etapa de modelización de la interacción con Ik o hERG comprende la implementación de un modelo de cadena de Markov con cinco estados sin fármaco: tres estados cerrados (C3 , C2 , Ci) , un estado abierto (O) , y un estado inactivado (I) , y hasta cinco estados adicionales con fármaco (C3d, C2d, Cid, Od e Id) . Más preferentemente, la distribución de grupos durante la etapa de modelización de fármacos comprende los siguientes criterios: - los estados a los que el fármaco se une y se desune y el estado de unión preferente; - la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; - la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, distinguiendo entre modelo desdoblado ("unstuck") y modelo ramificado ("stuck") . su estado de unión comprende las siguientes clases: Abierto, Inactivado, Cerrado, AbiertoI, InactivadoO, OI, AbiertoC, CerradoO, CO, AbiertoCI, InactivadoCO, CerradoOI y COI, donde dichas clases corresponden a los siguientes estados de unión: Abierto, Inactivado y Cerrado son compuestos que interactúan sólo en los estados abierto, inactivado y cerrado, respectivamente. AbiertoI, InactivadoO y OI son fármacos que se unen a los estados abierto e inactivado, con preferencia por el estado abierto, inactivado, y con la misma preferencia por ambos estados, respectivamente. AbiertoC, CerradoO y CO representan fármacos que se unen a los estados cerrado y abierto simultáneamente, pero con mayor afinidad por el estado abierto, cerrado y con igual afinidad por ambos estados, respectivamente. Por último, AbiertoCI, InactivadoCO, CerradoOI y COI son compuestos que se unen simultáneamente a los tres estados con mayor afinidad a los estados abierto, inactivado o cerrado y con la misma afinidad a todos ellos, respectivamente. En otra realización preferente de la invención, la etapa de modelización de la interacción con la I Kr o hERG comprende crear grupos adicionales de comprobación utilizando una semilla aleatoria y generándose variantes en las que los canales unidos al compuesto pueden cambiar de estado o no sin desligarse. En otra realización preferente de la invención, la etapa de definición de los protocolos de estimulación eléctrica comprende el uso de protocolos que comprenden, para un valor de temperatura y un valor de concentración de potasio intracelular y extracelular dados: - un pulso de acondicionamiento de voltaje variable; - un pulso de prueba; - opcionalmente, un prepulso. Más preferentemente, los protocolos de estimulación eléctrica comprenden los protocolos P40, P0 y P-80. Aún más preferentemente, la etapa de definición de los protocolos de estimulación eléctrica comprende la obtención de distribuciones de concentración-respuesta mediante el trazado del pico normalizado de la corriente de cola ("normalized peak tail curren" en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco, y se analiza la evolución del pico normalizado de la corriente de cola de kr o hERG a la concentración IC50, en función del número de pulsos o del tiempo. de optimización donde, una vez caracterizados los compuestos, se calculan las constantes de asociación y disociación para cada estado en el que cada compuesto interacciona con el canal y se procesan mediante un algoritmo de optimización iterativa. Más preferentemente en el método de la invención, el algoritmo de optimización iterativa está basado en el algoritmo Nelder-Mead simplex. Un segundo objeto de la invención se refiere a un sistema de computación que comprende medios software y/o hardware adaptados para implementar un procedimiento según cualquiera de las realizaciones descritas en el presente documento. Un tercer objeto de la invención se refiere a un programa de ordenador que comprende instrucciones configuradas para la ejecución en un procedimiento según cualquiera de las realizaciones descritas en el presente documento, en un sistema de computación correspondiente. En el ámbito de interpretación de la invención, la expresión "sustancialmente", referida a cualquier término, se entenderá como idéntica a dicho término o comprendida dentro de un margen de variación de ±25%. Asimismo, si bien las realizaciones principales descritas en el presente documento se refieren a valores específicos de concentraciones de potasio, el método reivindicado se puede aplicar, de forma equivalente en la invención, para cualesquiera otros valores de dichas concentraciones, sin restricción de su alcance. Así pues, el uso de IC50 ha de considerarse como extensivo a otros valores de concentración en el ámbito de interpretación de la invención. En este mismo sentido, también es posible modificar, sin pérdida de equivalencia, el método descrito incluyendo el uso de mutaciones en los canales de IKr o hERG. Del mismo modo, las realizaciones preferentes del método de la invención se refieren a una selección de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos. En este sentido, dicha selección de fármacos se considera aplicable tanto a compuestos conocidos (o reales) , como a compuestos virtuales (por ejemplo, cuya formulación se genera de forma aleatoria, o pseudoaleatoria bajo determinadas reglas computacionales) , sin limitación del alcance de protección de la invención. Así pues, y de modo equivalente al de las citadas realizaciones preferentes, en el caso de utilizarse compuestos reales se aplicarían, preferentemente, los protocolos de fijación de voltaje de estimulación eléctrica de manera experimental, para obtener los valores de IC50 y de t, que serán los datos de entrada del método descrito. Y, adicionalmente, también es posible obtener el valor de t a partir de la evolución de la corriente de cola. Las anteriores y otras características y ventajas se comprenderán más plenamente a partir de la descripción detallada de la invención, así como de los ejemplos de realización preferente referidos a los dibujos adjuntos, en los que: - La Figura 1 muestra diferentes modelos de Markov de Ik utilizados en el procedimiento de la invención, según una realización preferente de la misma. Más concretamente, la figura representa los estados unidos al fármaco (C3d, C2d, C1d, Od e Id) y los estados sin fármaco (C3 , C2 , C1, O e I) . kc, ko y ki son las tasas de difusión en los estados cerrado, abierto e inactivado respectivamente. Rc, ro y n son las tasas de disociación en los estados cerrado, abierto e inactivado respectivamente. D es la concentración del fármaco. La columna de la izquierda representa los nombres de las posibles interacciones entre los fármacos y los canales para cada modelo. - La Figura 2 muestra diferentes gráficas que representan los efectos de los tres protocolos de fijación del potencial de membrana: P0 (arriba) , P40 (centro) y P-80 (abajo) , representación de los protocolos de voltaje (izquierda) , gráficos de Hill de un determinado compuesto virtual con los tres protocolos (centro) y la evolución del pico de la corriente de cola (normalizado) a la concentración IC50 correspondiente (derecha) . - La Figura 3 corresponde un diagrama de flujo de las diferentes etapas de un clasificador utilizado en el procedimiento de la invención, según una realización preferente de la misma. - La Figura 4 muestra diferentes ejemplos de representaciones tridimensionales de los parámetros extraídos de las simulaciones de los fármacos mediante el procedimiento de la invención, según una realización preferente de la misma. En ella se representan las constantes de tiempo de un subconjunto de compuestos de cada clase y las líneas interpoladas correspondientes (colores) utilizadas en el segundo y tercer paso del clasificador (Figura 4a) y valores de los IC50 de otro subconjunto de compuestos junto con dos superficies de decisión (Figura 4b) . DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Se expone, a continuación, una descripción detallada de la invención basada en las Figuras del presente documento. Dicha descripción se aporta con fines ilustrativos, pero no limitativos, de la invención reivindicada. Según lo descrito en apartados precedentes, un primer objeto de la invención se refiere a un procedimiento de modelización de interacciones dinámicas de compuestos con los canales de kr o hERG. Dicho procedimiento comprende, ventajosamente, la realización de las siguientes etapas: - Modelización de la interacción kr. - Selección de los compuestos. - Definición de protocolos de estimulación. - Obtención de resultados (constantes de tiempo y valores de IC50) . - Clasificación. - Optimización (opcional) . A continuación se procede a explicar cada una de las etapas involucradas en el procedimiento, para una realización preferente del mismo aplicado a la interacción de compuestos con el canal de IKr (si bien la interacción con el canal hERG sería equivalente, mediante las variaciones necesarias, si bien dichas variaciones se consideran accesibles al experto en la materia no siendo, en sí mismas, un objeto novedoso de la invención, sino las etapas generales del procedimiento aplicado a cualquiera de dichos canales kr o hERG) . Modelización de la interacción del fármaco con la kr: En la realización preferente descrita, la kr se simula utilizando un modelo de cadena de Markov de I Kr del ventrículo humano como, por ejemplo, el propuesto en M. Fink et al., "Contributions of HERG K+ Current to Repolarization of the Human Ventricular Action Potential", Prog. Biophys. Mol. Biol. (2008) , vol. 96, pp. 357-376, si bien otros modelos basados en cadenas de Markov son igualmente implementables sin salir del ámbito de la invención. Dicho modelo comprende, en esta realización, cinco estados: tres estados cerrados, (C3 , C2 , C1) , un estado abierto (O) , y un estado inactivado (I) . Asimismo, para simular la interacción entre el fármaco y el canal (en este caso, el canal kr) se incluyen cinco nuevos estados (C3d, C2d, C1d, Od e Id) , propuesto por ejemplo en J. Gomis-Tena et al., "When Does the IC50 Accurately Assess the Blocking Potency of a Drug?", J. Chem. Inf. Model (2020) , 60, 3, 1779-1790. Todas las configuraciones de los canales consideradas se muestran en la Figura 1. Selección de los compuestos: El siguiente paso del procedimiento comprende una simulación de los fármacos que, en el ejemplo de realización descrito, se basa en un conjunto de 26000 fármacos virtuales, distribuidos IKr. Estos grupos se generan, preferentemente teniendo en cuenta tres aspectos: i) los estados a los que el fármaco se une y se desune y el estado de unión preferente, lo que da lugar a trece clases, ii) la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente a 3, 10, 30 o 100 como valores umbral de referencia (si bien otras selecciones son igualmente implementables) y, por último, iii) la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, de modo que se formula un modelo desdoblado si se posee esta capacidad y un modelo ramificado si no se posee (en inglés, "stuck" y "unstuck", respectivamente) . Las trece clases se nombran según el estado de unión: Abierto ("Open") , Inactivado ("Inactivated") y Cerrado ("Closed") son compuestos que interactúan sólo en los estados abierto, inactivado y cerrado, respectivamente. Abiertol ("OpenI") , InactivadoO ("InactivatedO") y OI son fármacos que se unen a los estados abierto e inactivado, con preferencia por el estado abierto, inactivado, y con la misma preferencia por ambos estados, respectivamente. AbiertoC ("OpenC") , CerradoO ("ClosedO") y CO representan fármacos que se unen a los estados cerrado y abierto simultáneamente, pero con mayor afinidad por el estado abierto, cerrado y con igual afinidad por ambos estados, respectivamente. Por último, AbiertoCI ("OpenCI") , InactivadoCO ("InactiveCO") , CerradoOI ("ClosedOI") y COI son compuestos que se unen simultáneamente a los tres estados con mayor afinidad a los estados abierto, inactivado o cerrado y con la misma afinidad a todos ellos, respectivamente. Adicionalmente, en una realización particular de la invención, es posible crear grupos adicionales de comprobación, para verificar el funcionamiento del sistema utilizando otra semilla aleatoria. Así, en el ejemplo propuesto anteriormente, se crean otros ocho conjuntos diferentes de 650 compuestos de comprobación (variantes en las que los canales unidos al compuesto pueden cambiar de estado o no sin desligarse (modelo desdoblado y modelo ramificado, respectivamente) de 13 clases y 50 fármacos por clase) . Protocolos de estimulación: En esta etapa del procedimiento, se definen los protocolos de fijación de voltaje utilizados para la simulación. En el ejemplo descrito en esta realización de la invención, se utilizan tres protocolos de fijación de voltaje conocidos y publicados en el artículo Gomis-Tena et al. (2020) previamente referido, denominados P40, P0 y P-80, que maximizan la probabilidad de que los canales ocupen cada estado conformacional (ver Figura 2, columna izquierda) . Dichos protocolos consisten, esencialmente, en un pulso de acondicionamiento de voltaje variable (en el ejemplo, de 5 s para P0 y P40 y de 4.5 s para P-80) , seguido de un pulso de prueba (en el ejemplo, un pulso de 0.2 s a -60 mV, repetido a intervalos de 5.4 s desde un potencial de -80 mV) . Asimismo, espectivamente. En el caso de P-80, se incorpora un prepulso de 0.5 ms a 20 mV y el pulso de prueba de 0.2 s se fija a -50 mV. Dentro de la definición de los protocolos se fija el valor de la temperatura (22 °C en el ejemplo) , la concentración de potasio intracelular (130 mM en el ejemplo) y la extracelular (4 mM) en el ejemplo. Los valores de tiempos, potenciales, temperaturas y concentraciones pueden variar en diferentes realizaciones de la invención, sin limitación del alcance de la misma. A partir de los protocolos de fijación de voltaje, se obtienen los gráficos concentración-respuesta correspondientes, también denominados como gráficos de Hill. En el ejemplo descrito, estos gráficos se crean trazando el pico normalizado de la corriente de cola en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco (ver en Figura 2, columna central) , siguiendo lo descrito en la publicación Gomis-Tena et al. (2020) . Adicionalmente, se analiza el pico normalizado de la corriente de cola de Ik a la concentración IC50, en función del número de pulsos o del tiempo (Figura 2, columna derecha) . Obtención de resultados: Los tres valores de la constante de tiempo de inactivación (tp-80, tp0 , TP40) y los tres valores de IC50 (IC50, p-80, IC50, p0 , IC50, p40) para todos los compuestos de entrenamiento se calculan a partir de los parámetros de simulación previamente definidos, representándose en gráficos dispersos en 3D (ver Figura 3a y 3b, respectivamente) . En la realización preferente aquí descrita a modo de ejemplo, se aprecia que las distribuciones del valor de IC50 y las constantes de tiempo de todas las clases se asemejan a tendencias lineales. Estos parámetros se utilizan para entrenar un clasificador que, en esta realización comprende tres subetapas según lo representado en el esquema de la Figura 4. Para ello, se requieren el IC50 y los valores de la constante de tiempo, y se utilizan preferentemente máquinas de vectores de apoyo (en inglés, "support vector machines", o SVMs) e interpolación de rectas. Las citadas subetapas se detallan a continuación: - En primer lugar, se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que el canal interactúa con el compuesto. Se clasifican los compuestos por su tasa de disociación respecto al estado de unión no preferente (en el presente ejemplo, 3R, 10R, 30R y 100R cuando la tasa de disociación del compuesto es 3, 10, 30 o 100 veces mayor para el estado de unión no preferente, respectivamente) . Para esta etapa se utiliza el valor de IC50 interpolándose a una línea utilizando todos los puntos para cada una de las 104 clasificaciones posibles (3R, 10R, 30R o 100R, si los canales unidos al compuesto pueden cambiar de estado o no y las 13 a clasificación es la distancia entre el punto definido por los tres valores de IC50 correspondientes al compuesto y todas las líneas interpoladas, donde el compuesto se asigna al grupo correspondiente a la línea interpolada más cercana. Tras esta subetapa, se determina por tanto la relación de las tasas de disociación (ver Figura 4b) . - En segundo lugar, se averigua si el compuesto permite que los canales unidos al él puedan cambiar de estado o no sin desligarse del fármaco. En esta subetapa se utilizan las constantes de tiempo (t) , y el método es similar al utilizado en la primera subetapa. En este caso, se interpolan las líneas para cada una de las 26 posibilidades (que los canales unidos al compuesto cambien de estado o no y las 13 clases, esto es, 2x16=26) . En la Figura 3a se muestra una representación tridimensional de las constantes de tiempo y las líneas interpoladas para los fármacos 30R, en las variantes que permiten cambiar de estado a los canales unidos al fármaco. Se calcula la distancia entre el compuesto y todas las líneas y se decide que el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica. Después de esta subetapa, el compuesto se asigna a uno de ocho grupos, que resultan de los cuatro ratios y de la posibilidad de que el compuesto permita cambiar de estado al canal sin desligarse o no (4x2=8) . - En tercer lugar, se asigna la clase entre las 13 posibilidades, según los criterios anteriores. En el ejemplo de realización particular de la invención, el clasificador completo según los pasos anteriores clasificó correctamente el 88, 39% de los compuestos, dependiendo si permitían el cambio de estado en los canales unidos al compuesto y adivinó la clase en el 92, 05% de los casos. Optimizador: Una vez identificadas las características de los compuestos, se calculan las tasas de asociación y disociación para cada estado en el que el compuesto interacciona con el canal. Para ello se utiliza, preferentemente, una herramienta de optimización iterativa, estando por ejemplo basada en el algoritmo Nelder-Mead simplex. Los parámetros de dicha herramienta se calculan teniendo en cuenta las características encontradas por el clasificador en la etapa anterior. El optimizador ajusta los modelos de los compuestos con las cuatro posibilidades: 3R, 10R, 30R and 100R. Una vez completada la optimización de las constantes de asociación y disociación de las cuatro En todos los casos, la solución proporcionada por la herramienta de optimización es la que tiene la relación correcta de las tasas de disociación. Además del procedimiento de la invención, también es un objeto principal de la misma un sistema de computación (por ejemplo, un ordenador, aunque sin limitación a otros equipos con capacidad de almacenamiento y de procesamiento de datos, tales como redes o "c lusters" de com putación, unidades de procesam iento gráfico (GPUs) , etc.) que comprende medios software y/o hardware adaptados para implementar un procedimiento según cualquiera de las realizaciones aquí descritas. Finalmente, un tercer objeto de la invención se refiere a un programa de ordenador que comprende instrucciones configuradas para la ejecución en un procedimiento según cualquiera de las realizaciones descritas en el presente documento, en un sistema de computación correspondiente.
Publicaciones:
ES2915325 (21/06/2022) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 01/04/2022 se realizó Registro Instancia de Solicitud
En fecha 05/04/2022 se realizó Admisión a Trámite
En fecha 05/04/2022 se realizó Aceptación Tramitación CAP
En fecha 05/04/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 07/04/2022 se realizó Superado examen de oficio
En fecha 13/04/2022 se realizó 3406X_Solicitud Correcciones
En fecha 13/04/2022 se realizó 1551X_Notificación Correcciones Admitidas
En fecha 09/06/2022 se realizó Realizado IET
En fecha 14/06/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 21/06/2022 se realizó Publicación Solicitud
En fecha 21/06/2022 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 16/09/2022 se realizó Registro Documentación no Identificada
En fecha 16/09/2022 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
En fecha 06/10/2022 se realizó Validación petición y/o pago de examen sustantivo conforme
En fecha 28/04/2023 se realizó El solicitante ha contestado pero existen nuevas objeciones a la concesión de la solicitud
En fecha 28/04/2023 se realizó Elaboración de examen sustantivo
En fecha 28/04/2023 se realizó 6120P_Notificación de examen sustantivo
En fecha 08/05/2023 se realizó Publicación de examen sustantivo
En fecha 10/07/2023 se realizó 5127P_Subsanación a defectos en examen sustantivo
En fecha 08/03/2024 se realizó 6120P_Notificación de examen sustantivo
En fecha 14/03/2024 se realizó Publicación de examen sustantivo
Pagos:
01/04/2022 - Pago Tasas IET
+ ES-2915325_A11.- Procedimiento implementable por ordenador de caracterización de interacciones dinámicas de fármacos con los canales de Ik o hERG, donde dicho procedimiento comprende la realización de las siguientes etapas: - se modeliza de la interacción entre la Ik o hERG y los fármacos, donde dicha modelización comprende generar un modelo de cadena de Markov; - se selecciona un conjunto de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos, distribuidos en grupos con diferentes cinéticas y afinidades a los estados conformacionales del canal Ik o hERG, donde la distribución de los grupos se basa en los siguientes criterios: o los estados a los que el fármaco se une y se desune y el estado de unión preferente; o la relación entre la tasa de disociación (en inglés, "dissociation rate") del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; o la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto; - se define una pluralidad de protocolos de fijación de voltaje de estimulación eléctrica celular, obteniéndose sus distribuciones de concentración-respuesta correspondientes; estando el procedimiento caracterizado por que comprende, además, las siguientes etapas: - se obtienen los valores de concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (IC50) y de las constantes de tiempo (t) de la corriente de cola normalizada al aplicar un valor de concentración de fármaco sustancialmente igual al IC50 correspondientes para cada protocolo de fijación de voltaje y para la pluralidad de compuestos simulados en la etapa de modelización de fármacos; - se interpolan los valores de IC50 a una línea, en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, y de su estado de unión preferente; - se interpolan los valores de t a una línea, en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, y de su estado de unión preferente; - se clasifican los compuestos realizando las siguientes subetapas, realizadas mediante SVMs e interpolación lineal: o se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que se une cada compuesto, y se clasifican los compuestos , compuesto se asigna al grupo correspondiente a la línea interpolada más cercana; o se asigna cada compuesto al grupo correspondiente a la línea interpolada de su constante de tiempo (t) más cercana, calculándose la distancia entre cada compuesto y todas las líneas, y determinándose si el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica; y o se asigna cada compuesto a una clase, caracterizándolo en función de los estados a los que se une y se desune, y de su estado de unión preferente, según los resultados obtenidos en las subetapas anteriores. 2. - Procedimiento según la reivindicación anterior donde, durante la etapa de selección de fármacos, el criterio de distribución de grupos relativo a la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto comprende la formulación de un modelo de cadena Markov al que llamamos desdoblado si se posee dicha capacidad, o de un modelo de cadena de Markov al que llamamos ramificado en caso contrario. 3. - Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de modelización de la interacción k ro hERG comprende la implementación de un modelo de cadena de Markov con cinco estados sin fármaco: tres estados cerrados (C3 , C2 , Ci) , un estado abierto (O) , y un estado inactivado (I) , y hasta cinco estados adicionales con fármaco (C3d, C2d, Cid, Od e Id) . 4. - Procedimiento según la reivindicación anterior, donde la distribución de grupos durante la etapa de modelización de fármacos comprende se basa en los siguientes criterios: - los estados a los que el fármaco se une y se desune y el estado de unión preferente; - la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; - la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, distinguiendo entre modelo ramificado y modelo desdoblado. 5. - Procedimiento según la reivindicación anterior, donde la distinción de los compuestos según su estado de unión comprende las siguientes clases: Abierto, Inactivado, Cerrado, Abiertol, InactivadoO, OI, AbiertoC, CerradoO, CO, AbiertoCI, InactivadoCO, CerradoOl y COI. 6. - Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de modelización de la interacción Ik o hERG comprende crear grupos adicionales de comprobación ompuesto pueden cambiar de estado o no sin desligarse. 7. Procedimiento según cualquiera de las reivindicaciones anteriores, donde la etapa de definición de los protocolos de estimulación eléctrica comprende el uso de protocolos que comprenden, para un valor de temperatura y un valor de concentración de potasio intracelular y extracelular dados: - un pulso de acondicionamiento de voltaje variable; - un pulso de prueba; - opcionalmente, un prepulso; 8. - Procedimiento según la reivindicación anterior, donde los protocolos de estimulación eléctrica comprenden los protocolos P40, P0 y P-80. 9. - Procedimiento según cualquiera de las reivindicaciones 7-8, donde la etapa de definición de los protocolos de estimulación eléctrica comprende la obtención de distribuciones de concentración-respuesta mediante el trazado del pico normalizado de la corriente de cola en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco, y se analiza el pico normalizado de la corriente Ik a la concentración IC50, en función del número de pulsos o del tiempo. 10. - Procedimiento según cualquiera de las reivindicaciones anteriores, que comprende una etapa adicional de optimización donde, una vez caracterizados los compuestos, se calculan las constantes de asociación y disociación para cada estado en el que cada compuesto interacciona con el canal y se procesan mediante un algoritmo de optimización iterativa. 11. - Procedimiento según la reivindicación anterior, donde el algoritmo de optimización iterativa está basado en el algoritmo Nelder-Mead simplex. 12. - Procedimiento según cualquiera de las reivindicaciones anteriores, que comprende el uso de m utaciones en los canales de IKr o hERG. 13. - Procedim iento según cualquiera de las re ivindicaciones anteriores, donde la pluralidad de com puestos correspondientes a los fárm acos com prende com puestos reales, y/o com puestos virtuales cuya form ulación se genera de form a aleatoria o pseudoaleatoria bajo una o más reglas com putacionales. . -para implementar un procedimiento según cualquiera de las reivindicaciones anteriores. 15. - Programa de ordenador que comprende instrucciones configuradas para la ejecuci en un procedimiento según cualquiera de las reivindicaciones 1-13 en un sistema según la reivindicación 14.
Los productos y servicios protegidos por este registro son:
G16B 5/00
Descripciones:
+ ES-2915325_A1 PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE Ikr O HERG CAMPO DE LA INVENCIÓN La presente invención se enmarca en el campo de las de las tecnologías de desarrollo de fármacos y de las ciencias de computación. Más concretamente, la invención se refiere a un procedimiento de modelización y caracterización de interacciones dinámicas de compuestos con los canales de Ik (corriente retardada rectificadora de potasio o, en inglés, "delayed rectifier potassium current") o de hERG (gen humano éter-a-go-go o, en inglés, "human ether-a-go-gorelated gene") . ANTECEDENTES DE LA INVENCIÓN El descubrimiento y el desarrollo de nuevos fármacos ha estado basado, tradicionalmente, en procedimientos de tipo ensayo-error. No obstante, en la práctica estos procedimientos resultan, muchas veces ineficientes, excesivamente dilatados en el tiempo o arriesgados, tanto desde un punto de vista sanitario como desde la inversión en investigación privada o pública. Ello se debe a que, en el caso de muchos medicamentos desarrollados, éstos no llegan al mercado por sus efectos secundarios perjudiciales para la salud y, específicamente para el corazón, debido a potenciales efectos adversos tales como las arritmias ventriculares. Hasta ahora, la evaluación preclínica de la seguridad cardíaca de los nuevos fármacos se ha basado, principalmente, en el estudio del bloqueo in vitro en el gen hERG (que codifica la subunidad a formadora de poros del componente rápido de los canales de la corriente Ik en humanos) producido por el compuesto bajo estudio, y la prolongación in vivo del intervalo QT (medida de tiempo entre el comienzo de la onda Q y el final de la onda T en un electrocardiograma) . Ambos fenómenos han sido relacionados con la aparición de la taquicardia ventricular polimoría ("Torsades de Pointes" o TdP) . Aunque estas pruebas de seguridad han tenido éxito en evitar que fármacos potencialmente peligrosos llegasen al mercado, también han evitado el desarrollo de compuestos con potencial de ser útiles. De hecho, existen fármacos como el verapamil, reconocido como un potente bloqueador de la corriente kr, que no está asociado al desarrollo de TdP. mejora cuando se tienen en cuenta las dinámicas y cinéticas de los mismos. Por ejemplo, la dependencia de la interacción entre un compuesto y un canal determinado con el estado conformacional en el que éste se encuentre puede alterar significativamente los valores de la concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (denominada dicha concentración como IC50) . A su vez, dichos valores también pueden variar dependiendo del protocolo de estimulación y de fijación del potencial de membrana (en inglés, "voltaje-damp") utilizado para medirlo. Por otra parte, en los últimos años ha surgido la iniciativa "Comprehensive In vitro Proarrhythmia Assay (CiPA) , liderada por la Food and Drug Administration (FDA) estadounidense, que persigue mejorar las técnicas de descubrimiento y desarrollo de fármacos mediante la definición de nuevos paradigmas, basados en modelos computacionales que se proponen como herramientas principales para predecir el riesgo de arritmias inducidas por los nuevos fármacos. Esta iniciativa también pone énfasis en un componente farmacodinámico más detallado. Tradicionalmente, la formulación de las acciones de los fármacos en los canales iónicos se simplifican mediante un modelo de bloqueo de poro simple, denominado modelo estático, que utiliza los coeficientes IC50 y coeficientes de Hill para reducir la conductancia de cada corriente iónica. Estos modelos estáticos son sencillos, pero no excesivamente realistas ya que, como se ha mencionado anteriormente, la potencia de bloqueo de los compuestos depende de las condiciones experimentales utilizadas para dilucidarlo. En este ámbito, los modelos dinámicos que modelizan la cinética de unión y separación del fármaco al canal en los distintos estados, como los modelos de Markov, se consideran más realistas y proporcionan información intrínseca que no depende del protocolo experimental. En este sentido resultan relevantes los artículos publicados por Z. Li et al. "Improving the in silico assessment of proarrhythmia risk by combining hERG (human ether- a-go- go- related gene) channel- drug binding kinetics and multichannel pharmacology", Circ. Arrhythm. Electrophysiol. 10, e004628 (2017) y Z. Li et al. "Quantitative Systems Pharmacology Models for a New International Cardiac Safety Regulator y Paradigm: An Overview of the Comprehensive In Vitro Proarrhythmia Assay In Silico Modeling Approach", CPT Pharmacometrics, Syst, Pharmacol (2019) , 8, 371-379. Así pues, la técnica actual propuesta por CiPA para la obtención de modelos dinámicos de los fármacos que bloquean la Ik o hERG utiliza una única cadena de Markov, de la cual deben ajustarse ciertos parámetros (tales como Kmax, Ku, EC50n, N, Vhalf-trap) , lo que permite distinguir fármacos con diferentes cinéticas de unión capturadas por un protocolo de fijación de potencial de membrana dinámico. No obstante, esta técnica está mostrando muchos problemas. Por ejemplo, muchos de los modelos de los fármacos propuestos no logran el bloqueo total de la arámetros resultan, en general, excesivamente complejos y, además, la dependencia con la semilla utilizada para obtener los mismos puede condicionar sus resultados, lo que limita su utilización a personas familiarizadas previamente con métodos de ajuste de parámetros. Finalmente, los protocolos CiPA de fijación de potencial de membrana involucran tiempos bastantes largos en comparación con los tiempos típicos de estabilidad de las células en esas circunstancias. Como consecuencia de estas limitaciones, resulta necesario, en el presente campo técnico, desarrollar nuevos procedimientos y sistemas de modelización alternativos a los conocidos que permitan, entre otras características y ventajas: - Obtener los modelos dinámicos de la interacción de forma automática, sin necesidad de la intervención de personal experto en modelización o en ajuste de parámetros. - Generar los modelos en tiempos reducidos y sin necesidad de una gran exigencia en recursos de computación. - Proporcionar una variedad amplia de los modelos generados. - Consideración de que la unión y desunión del fármaco y del canal se puede producir en cualquier estado del canal. - Implementar protocolos de fijación del potencial de membrana (en inglés, "voltaje-damp") más adecuados que los utilizados actualmente para producir los modelos de los fármacos. La presente invención está destinada a solventar la citada necesidad, mediante un novedoso procedimiento y sistema de modelización automática y caracterización de las interacciones dinámicas de los fármacos con los canales de Ik o hERG. DESCRIPCIÓN BREVE DE LA INVENCIÓN Como se ha descrito en el apartado de antecedentes, para resolver las limitaciones del estado de la técnica anteriormente descritas, la presente invención tiene por objeto proporcionar una tecnología mejorada para caracterizar y modelizar, de forma automática, las interacciones dinámicas de nuevos fármacos con los canales de Ik o hERG. La presente invención también puede utilizarse para modelizar las interacciones dinámicas de cualquier agente con los canales de IKr o hERG. El término agente incluye fármacos, anticuerpos, moléculas pequeñas, compuestos farmacéuticos, péptidos o proteínas, entre otros. Su utilización tampoco queda omo por ejemplo, el estudio de la eficacia de los fármacos antiarrítmicos. Más concretamente, un primer objeto de la invención se refiere a un procedimiento implementable por ordenador de caracterización de interacciones dinámicas de fármacos con los canales de Ik o hERG, donde dicho procedimiento comprende la realización de las siguientes etapas: - se modeliza de la interacción entre la Ik o hERG y los fármacos, donde dicha modelización comprende generar un modelo de cadena de Markov; - se selecciona un conjunto de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos, distribuidos en grupos con diferentes cinéticas y afinidades a los estados conformacionales del canal Ik o hERG, donde la distribución de los grupos se basa en los siguientes criterios: o los estados a los que el fármaco se une y se desune y el estado de unión preferente; o la relación entre la tasa de disociación (en inglés, "dissociation rate") del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; o la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto; - se define una pluralidad de protocolos de fijación de voltaje de estimulación eléctrica celular, obteniéndose sus distribuciones de concentración-respuesta correspondientes. Ventajosamente, el procedimiento de la invención comprende, además, las siguientes etapas: - se obtienen los valores de concentración de fármaco a la cual se produce la mitad del bloqueo de una corriente iónica (IC50) y de las constantes de tiempo (t) de la corriente de cola normalizada al aplicar un valor de concentración de fármaco sustancialmente igual al IC50 correspondientes para cada protocolo de fijación de voltaje y para la pluralidad de compuestos simulados en la etapa de modelización de fármacos; - se interpolan los valores de IC50 a una línea en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, los estados a los que el fármaco se une y se desune y de su estado de unión preferente; - se interpolan los valores de t a una línea en función de cada uno de los valores umbral, de si los canales unidos al compuesto pueden cambiar de estado o no mientras el compuesto está unido, los estados a los que el fármaco se une y se desune y de su estado de unión preferente; SVMs e interpolación lineal: o se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que se une cada compuesto, y se clasifican los compuestos por su tasa de disociación respecto al estado de unión no preferente, donde cada compuesto se asigna al grupo correspondiente a la línea interpolada más cercana; o se asigna cada compuesto al grupo correspondiente a la línea interpolada de su constante de tiempo (t) más cercana, calculándose la distancia entre cada compuesto y todas las líneas, y determinándose si el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica; y o se asigna cada compuesto a una clase, caracterizándolo en función de los estados a los que se une y se desune, y de su estado de unión preferente, según los resultados obtenidos en las subetapas anteriores. En una realización preferente de la invención, durante la etapa de selección de fármacos, el criterio de distribución de grupos relativo a la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto comprende la formulación de un modelo de cadena Markov al que llamamos ramificado ("stuck", de su término en inglés) si se posee dicha capacidad, o de un modelo de cadena de Markov al que llamamos desdoblado ("unstuck") en caso contrario. En una realización preferente de la invención, la etapa de modelización de la interacción con Ik o hERG comprende la implementación de un modelo de cadena de Markov con cinco estados sin fármaco: tres estados cerrados (C3 , C2 , Ci) , un estado abierto (O) , y un estado inactivado (I) , y hasta cinco estados adicionales con fármaco (C3d, C2d, Cid, Od e Id) . Más preferentemente, la distribución de grupos durante la etapa de modelización de fármacos comprende los siguientes criterios: - los estados a los que el fármaco se une y se desune y el estado de unión preferente; - la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente en una pluralidad de valores umbral; - la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, distinguiendo entre modelo desdoblado ("unstuck") y modelo ramificado ("stuck") . su estado de unión comprende las siguientes clases: Abierto, Inactivado, Cerrado, AbiertoI, InactivadoO, OI, AbiertoC, CerradoO, CO, AbiertoCI, InactivadoCO, CerradoOI y COI, donde dichas clases corresponden a los siguientes estados de unión: Abierto, Inactivado y Cerrado son compuestos que interactúan sólo en los estados abierto, inactivado y cerrado, respectivamente. AbiertoI, InactivadoO y OI son fármacos que se unen a los estados abierto e inactivado, con preferencia por el estado abierto, inactivado, y con la misma preferencia por ambos estados, respectivamente. AbiertoC, CerradoO y CO representan fármacos que se unen a los estados cerrado y abierto simultáneamente, pero con mayor afinidad por el estado abierto, cerrado y con igual afinidad por ambos estados, respectivamente. Por último, AbiertoCI, InactivadoCO, CerradoOI y COI son compuestos que se unen simultáneamente a los tres estados con mayor afinidad a los estados abierto, inactivado o cerrado y con la misma afinidad a todos ellos, respectivamente. En otra realización preferente de la invención, la etapa de modelización de la interacción con la I Kr o hERG comprende crear grupos adicionales de comprobación utilizando una semilla aleatoria y generándose variantes en las que los canales unidos al compuesto pueden cambiar de estado o no sin desligarse. En otra realización preferente de la invención, la etapa de definición de los protocolos de estimulación eléctrica comprende el uso de protocolos que comprenden, para un valor de temperatura y un valor de concentración de potasio intracelular y extracelular dados: - un pulso de acondicionamiento de voltaje variable; - un pulso de prueba; - opcionalmente, un prepulso. Más preferentemente, los protocolos de estimulación eléctrica comprenden los protocolos P40, P0 y P-80. Aún más preferentemente, la etapa de definición de los protocolos de estimulación eléctrica comprende la obtención de distribuciones de concentración-respuesta mediante el trazado del pico normalizado de la corriente de cola ("normalized peak tail curren" en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco, y se analiza la evolución del pico normalizado de la corriente de cola de kr o hERG a la concentración IC50, en función del número de pulsos o del tiempo. de optimización donde, una vez caracterizados los compuestos, se calculan las constantes de asociación y disociación para cada estado en el que cada compuesto interacciona con el canal y se procesan mediante un algoritmo de optimización iterativa. Más preferentemente en el método de la invención, el algoritmo de optimización iterativa está basado en el algoritmo Nelder-Mead simplex. Un segundo objeto de la invención se refiere a un sistema de computación que comprende medios software y/o hardware adaptados para implementar un procedimiento según cualquiera de las realizaciones descritas en el presente documento. Un tercer objeto de la invención se refiere a un programa de ordenador que comprende instrucciones configuradas para la ejecución en un procedimiento según cualquiera de las realizaciones descritas en el presente documento, en un sistema de computación correspondiente. En el ámbito de interpretación de la invención, la expresión "sustancialmente", referida a cualquier término, se entenderá como idéntica a dicho término o comprendida dentro de un margen de variación de ±25%. Asimismo, si bien las realizaciones principales descritas en el presente documento se refieren a valores específicos de concentraciones de potasio, el método reivindicado se puede aplicar, de forma equivalente en la invención, para cualesquiera otros valores de dichas concentraciones, sin restricción de su alcance. Así pues, el uso de IC50 ha de considerarse como extensivo a otros valores de concentración en el ámbito de interpretación de la invención. En este mismo sentido, también es posible modificar, sin pérdida de equivalencia, el método descrito incluyendo el uso de mutaciones en los canales de IKr o hERG. Del mismo modo, las realizaciones preferentes del método de la invención se refieren a una selección de fármacos a caracterizar, mediante una simulación de una pluralidad de compuestos. En este sentido, dicha selección de fármacos se considera aplicable tanto a compuestos conocidos (o reales) , como a compuestos virtuales (por ejemplo, cuya formulación se genera de forma aleatoria, o pseudoaleatoria bajo determinadas reglas computacionales) , sin limitación del alcance de protección de la invención. Así pues, y de modo equivalente al de las citadas realizaciones preferentes, en el caso de utilizarse compuestos reales se aplicarían, preferentemente, los protocolos de fijación de voltaje de estimulación eléctrica de manera experimental, para obtener los valores de IC50 y de t, que serán los datos de entrada del método descrito. Y, adicionalmente, también es posible obtener el valor de t a partir de la evolución de la corriente de cola. Las anteriores y otras características y ventajas se comprenderán más plenamente a partir de la descripción detallada de la invención, así como de los ejemplos de realización preferente referidos a los dibujos adjuntos, en los que: - La Figura 1 muestra diferentes modelos de Markov de Ik utilizados en el procedimiento de la invención, según una realización preferente de la misma. Más concretamente, la figura representa los estados unidos al fármaco (C3d, C2d, C1d, Od e Id) y los estados sin fármaco (C3 , C2 , C1, O e I) . kc, ko y ki son las tasas de difusión en los estados cerrado, abierto e inactivado respectivamente. Rc, ro y n son las tasas de disociación en los estados cerrado, abierto e inactivado respectivamente. D es la concentración del fármaco. La columna de la izquierda representa los nombres de las posibles interacciones entre los fármacos y los canales para cada modelo. - La Figura 2 muestra diferentes gráficas que representan los efectos de los tres protocolos de fijación del potencial de membrana: P0 (arriba) , P40 (centro) y P-80 (abajo) , representación de los protocolos de voltaje (izquierda) , gráficos de Hill de un determinado compuesto virtual con los tres protocolos (centro) y la evolución del pico de la corriente de cola (normalizado) a la concentración IC50 correspondiente (derecha) . - La Figura 3 corresponde un diagrama de flujo de las diferentes etapas de un clasificador utilizado en el procedimiento de la invención, según una realización preferente de la misma. - La Figura 4 muestra diferentes ejemplos de representaciones tridimensionales de los parámetros extraídos de las simulaciones de los fármacos mediante el procedimiento de la invención, según una realización preferente de la misma. En ella se representan las constantes de tiempo de un subconjunto de compuestos de cada clase y las líneas interpoladas correspondientes (colores) utilizadas en el segundo y tercer paso del clasificador (Figura 4a) y valores de los IC50 de otro subconjunto de compuestos junto con dos superficies de decisión (Figura 4b) . DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Se expone, a continuación, una descripción detallada de la invención basada en las Figuras del presente documento. Dicha descripción se aporta con fines ilustrativos, pero no limitativos, de la invención reivindicada. Según lo descrito en apartados precedentes, un primer objeto de la invención se refiere a un procedimiento de modelización de interacciones dinámicas de compuestos con los canales de kr o hERG. Dicho procedimiento comprende, ventajosamente, la realización de las siguientes etapas: - Modelización de la interacción kr. - Selección de los compuestos. - Definición de protocolos de estimulación. - Obtención de resultados (constantes de tiempo y valores de IC50) . - Clasificación. - Optimización (opcional) . A continuación se procede a explicar cada una de las etapas involucradas en el procedimiento, para una realización preferente del mismo aplicado a la interacción de compuestos con el canal de IKr (si bien la interacción con el canal hERG sería equivalente, mediante las variaciones necesarias, si bien dichas variaciones se consideran accesibles al experto en la materia no siendo, en sí mismas, un objeto novedoso de la invención, sino las etapas generales del procedimiento aplicado a cualquiera de dichos canales kr o hERG) . Modelización de la interacción del fármaco con la kr: En la realización preferente descrita, la kr se simula utilizando un modelo de cadena de Markov de I Kr del ventrículo humano como, por ejemplo, el propuesto en M. Fink et al., "Contributions of HERG K+ Current to Repolarization of the Human Ventricular Action Potential", Prog. Biophys. Mol. Biol. (2008) , vol. 96, pp. 357-376, si bien otros modelos basados en cadenas de Markov son igualmente implementables sin salir del ámbito de la invención. Dicho modelo comprende, en esta realización, cinco estados: tres estados cerrados, (C3 , C2 , C1) , un estado abierto (O) , y un estado inactivado (I) . Asimismo, para simular la interacción entre el fármaco y el canal (en este caso, el canal kr) se incluyen cinco nuevos estados (C3d, C2d, C1d, Od e Id) , propuesto por ejemplo en J. Gomis-Tena et al., "When Does the IC50 Accurately Assess the Blocking Potency of a Drug?", J. Chem. Inf. Model (2020) , 60, 3, 1779-1790. Todas las configuraciones de los canales consideradas se muestran en la Figura 1. Selección de los compuestos: El siguiente paso del procedimiento comprende una simulación de los fármacos que, en el ejemplo de realización descrito, se basa en un conjunto de 26000 fármacos virtuales, distribuidos IKr. Estos grupos se generan, preferentemente teniendo en cuenta tres aspectos: i) los estados a los que el fármaco se une y se desune y el estado de unión preferente, lo que da lugar a trece clases, ii) la relación entre la tasa de disociación del estado preferente y de los no preferentes, que se fija arbitrariamente a 3, 10, 30 o 100 como valores umbral de referencia (si bien otras selecciones son igualmente implementables) y, por último, iii) la capacidad de los canales unidos para cambiar su estado conformacional sin desligarse del compuesto, de modo que se formula un modelo desdoblado si se posee esta capacidad y un modelo ramificado si no se posee (en inglés, "stuck" y "unstuck", respectivamente) . Las trece clases se nombran según el estado de unión: Abierto ("Open") , Inactivado ("Inactivated") y Cerrado ("Closed") son compuestos que interactúan sólo en los estados abierto, inactivado y cerrado, respectivamente. Abiertol ("OpenI") , InactivadoO ("InactivatedO") y OI son fármacos que se unen a los estados abierto e inactivado, con preferencia por el estado abierto, inactivado, y con la misma preferencia por ambos estados, respectivamente. AbiertoC ("OpenC") , CerradoO ("ClosedO") y CO representan fármacos que se unen a los estados cerrado y abierto simultáneamente, pero con mayor afinidad por el estado abierto, cerrado y con igual afinidad por ambos estados, respectivamente. Por último, AbiertoCI ("OpenCI") , InactivadoCO ("InactiveCO") , CerradoOI ("ClosedOI") y COI son compuestos que se unen simultáneamente a los tres estados con mayor afinidad a los estados abierto, inactivado o cerrado y con la misma afinidad a todos ellos, respectivamente. Adicionalmente, en una realización particular de la invención, es posible crear grupos adicionales de comprobación, para verificar el funcionamiento del sistema utilizando otra semilla aleatoria. Así, en el ejemplo propuesto anteriormente, se crean otros ocho conjuntos diferentes de 650 compuestos de comprobación (variantes en las que los canales unidos al compuesto pueden cambiar de estado o no sin desligarse (modelo desdoblado y modelo ramificado, respectivamente) de 13 clases y 50 fármacos por clase) . Protocolos de estimulación: En esta etapa del procedimiento, se definen los protocolos de fijación de voltaje utilizados para la simulación. En el ejemplo descrito en esta realización de la invención, se utilizan tres protocolos de fijación de voltaje conocidos y publicados en el artículo Gomis-Tena et al. (2020) previamente referido, denominados P40, P0 y P-80, que maximizan la probabilidad de que los canales ocupen cada estado conformacional (ver Figura 2, columna izquierda) . Dichos protocolos consisten, esencialmente, en un pulso de acondicionamiento de voltaje variable (en el ejemplo, de 5 s para P0 y P40 y de 4.5 s para P-80) , seguido de un pulso de prueba (en el ejemplo, un pulso de 0.2 s a -60 mV, repetido a intervalos de 5.4 s desde un potencial de -80 mV) . Asimismo, espectivamente. En el caso de P-80, se incorpora un prepulso de 0.5 ms a 20 mV y el pulso de prueba de 0.2 s se fija a -50 mV. Dentro de la definición de los protocolos se fija el valor de la temperatura (22 °C en el ejemplo) , la concentración de potasio intracelular (130 mM en el ejemplo) y la extracelular (4 mM) en el ejemplo. Los valores de tiempos, potenciales, temperaturas y concentraciones pueden variar en diferentes realizaciones de la invención, sin limitación del alcance de la misma. A partir de los protocolos de fijación de voltaje, se obtienen los gráficos concentración-respuesta correspondientes, también denominados como gráficos de Hill. En el ejemplo descrito, estos gráficos se crean trazando el pico normalizado de la corriente de cola en el estado estacionario, como una función del logaritmo decimal de la concentración del fármaco (ver en Figura 2, columna central) , siguiendo lo descrito en la publicación Gomis-Tena et al. (2020) . Adicionalmente, se analiza el pico normalizado de la corriente de cola de Ik a la concentración IC50, en función del número de pulsos o del tiempo (Figura 2, columna derecha) . Obtención de resultados: Los tres valores de la constante de tiempo de inactivación (tp-80, tp0 , TP40) y los tres valores de IC50 (IC50, p-80, IC50, p0 , IC50, p40) para todos los compuestos de entrenamiento se calculan a partir de los parámetros de simulación previamente definidos, representándose en gráficos dispersos en 3D (ver Figura 3a y 3b, respectivamente) . En la realización preferente aquí descrita a modo de ejemplo, se aprecia que las distribuciones del valor de IC50 y las constantes de tiempo de todas las clases se asemejan a tendencias lineales. Estos parámetros se utilizan para entrenar un clasificador que, en esta realización comprende tres subetapas según lo representado en el esquema de la Figura 4. Para ello, se requieren el IC50 y los valores de la constante de tiempo, y se utilizan preferentemente máquinas de vectores de apoyo (en inglés, "support vector machines", o SVMs) e interpolación de rectas. Las citadas subetapas se detallan a continuación: - En primer lugar, se obtiene la diferencia en las tasas de disociación entre el estado preferente y los otros estados en los que el canal interactúa con el compuesto. Se clasifican los compuestos por su tasa de disociación respecto al estado de unión no preferente (en el presente ejemplo, 3R, 10R, 30R y 100R cuando la tasa de disociación del compuesto es 3, 10, 30 o 100 veces mayor para el estado de unión no preferente, respectivamente) . Para esta etapa se utiliza el valor de IC50 interpolándose a una línea utilizando todos los puntos para cada una de las 104 clasificaciones posibles (3R, 10R, 30R o 100R, si los canales unidos al compuesto pueden cambiar de estado o no y las 13 a clasificación es la distancia entre el punto definido por los tres valores de IC50 correspondientes al compuesto y todas las líneas interpoladas, donde el compuesto se asigna al grupo correspondiente a la línea interpolada más cercana. Tras esta subetapa, se determina por tanto la relación de las tasas de disociación (ver Figura 4b) . - En segundo lugar, se averigua si el compuesto permite que los canales unidos al él puedan cambiar de estado o no sin desligarse del fármaco. En esta subetapa se utilizan las constantes de tiempo (t) , y el método es similar al utilizado en la primera subetapa. En este caso, se interpolan las líneas para cada una de las 26 posibilidades (que los canales unidos al compuesto cambien de estado o no y las 13 clases, esto es, 2x16=26) . En la Figura 3a se muestra una representación tridimensional de las constantes de tiempo y las líneas interpoladas para los fármacos 30R, en las variantes que permiten cambiar de estado a los canales unidos al fármaco. Se calcula la distancia entre el compuesto y todas las líneas y se decide que el fármaco permite que los canales unidos al él puedan cambiar de estado si la línea más cercana se corresponde con compuestos que tienen esta característica. Después de esta subetapa, el compuesto se asigna a uno de ocho grupos, que resultan de los cuatro ratios y de la posibilidad de que el compuesto permita cambiar de estado al canal sin desligarse o no (4x2=8) . - En tercer lugar, se asigna la clase entre las 13 posibilidades, según los criterios anteriores. En el ejemplo de realización particular de la invención, el clasificador completo según los pasos anteriores clasificó correctamente el 88, 39% de los compuestos, dependiendo si permitían el cambio de estado en los canales unidos al compuesto y adivinó la clase en el 92, 05% de los casos. Optimizador: Una vez identificadas las características de los compuestos, se calculan las tasas de asociación y disociación para cada estado en el que el compuesto interacciona con el canal. Para ello se utiliza, preferentemente, una herramienta de optimización iterativa, estando por ejemplo basada en el algoritmo Nelder-Mead simplex. Los parámetros de dicha herramienta se calculan teniendo en cuenta las características encontradas por el clasificador en la etapa anterior. El optimizador ajusta los modelos de los compuestos con las cuatro posibilidades: 3R, 10R, 30R and 100R. Una vez completada la optimización de las constantes de asociación y disociación de las cuatro En todos los casos, la solución proporcionada por la herramienta de optimización es la que tiene la relación correcta de las tasas de disociación. Además del procedimiento de la invención, también es un objeto principal de la misma un sistema de computación (por ejemplo, un ordenador, aunque sin limitación a otros equipos con capacidad de almacenamiento y de procesamiento de datos, tales como redes o "c lusters" de com putación, unidades de procesam iento gráfico (GPUs) , etc.) que comprende medios software y/o hardware adaptados para implementar un procedimiento según cualquiera de las realizaciones aquí descritas. Finalmente, un tercer objeto de la invención se refiere a un programa de ordenador que comprende instrucciones configuradas para la ejecución en un procedimiento según cualquiera de las realizaciones descritas en el presente documento, en un sistema de computación correspondiente.
Publicaciones:
ES2915325 (21/06/2022) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 01/04/2022 se realizó Registro Instancia de Solicitud
En fecha 05/04/2022 se realizó Admisión a Trámite
En fecha 05/04/2022 se realizó Aceptación Tramitación CAP
En fecha 05/04/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 07/04/2022 se realizó Superado examen de oficio
En fecha 13/04/2022 se realizó 3406X_Solicitud Correcciones
En fecha 13/04/2022 se realizó 1551X_Notificación Correcciones Admitidas
En fecha 09/06/2022 se realizó Realizado IET
En fecha 14/06/2022 se realizó 1109P_Comunicación Traslado del IET
En fecha 21/06/2022 se realizó Publicación Solicitud
En fecha 21/06/2022 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 16/09/2022 se realizó Registro Documentación no Identificada
En fecha 16/09/2022 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
En fecha 06/10/2022 se realizó Validación petición y/o pago de examen sustantivo conforme
En fecha 28/04/2023 se realizó El solicitante ha contestado pero existen nuevas objeciones a la concesión de la solicitud
En fecha 28/04/2023 se realizó Elaboración de examen sustantivo
En fecha 28/04/2023 se realizó 6120P_Notificación de examen sustantivo
En fecha 08/05/2023 se realizó Publicación de examen sustantivo
En fecha 10/07/2023 se realizó 5127P_Subsanación a defectos en examen sustantivo
En fecha 08/03/2024 se realizó 6120P_Notificación de examen sustantivo
En fecha 14/03/2024 se realizó Publicación de examen sustantivo
Pagos:
01/04/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 09/05/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300
El registro de patente nacional por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300 fue solicitada el 01/04/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300 fue solicitada por UNIVERSITAT POLITÈCNICA DE VALÈNCIA mediante los servicios del agente Nicolás ESCUDERO PRIETO. El registro [modality] por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300 está clasificado como G16B 5/00 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes G16B 5/00.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300 está clasificado con la clasificación G16B 5/00 por lo que si se desea conocer más registros con la clasificación G16B 5/00 clicar aquí.Otras invenciones solicitadas a través del representante NICOLÁS ESCUDERO PRIETO
Es posible conocer todas las invenciones solicitadas a través del agente NICOLÁS ESCUDERO PRIETO entre las que se encuentra el registro patente nacional por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300. Si se desean conocer más invenciones solicitadas a través del agente NICOLÁS ESCUDERO PRIETO clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase G
Es posible conocer todas las patentes registradas en la clase G (FISICA) entre las que se encuentra la patente PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase G16
Es posible conocer todas las patentes registradas en la clase G16 (TECNOLOGÍAS DE LA INFORMACIÓN Y DE LA COMUNICACIÓN [TIC] ESPECIALMENTE ADAPTADAS PARA ÁREAS DE APLIC) entre las que se encuentra la patente PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase G16B
Es posible conocer todas las patentes registradas en la clase G16B (BIOINFORMATICA, es decir, TECNOLOGIAS DE LA INFORMACION Y DE LA COMUNICACION [TIC] ESPECIALMENTE ADA) entre las que se encuentra la patente PROCEDIMIENTO Y SISTEMA DE CARACTERIZACIÓN DE INTERACCIONES DINÁMICAS DE FÁRMACOS CON LOS CANALES DE IKR O HERG con el número P202230300. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.


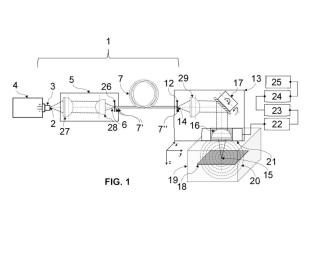
 P202230298
P202230298