- Home /
- Publicaciones de patentes /
- Péptido para el tratamiento de enfermedades cardiacas
Patente nacional por "Péptido para el tratamiento de enfermedades cardiacas"
Este registro ha sido solicitado por
Persona física
Contacto
- Estado: Vigente
- País:
- España
- Fecha solicitud:
- 25/09/2023
- Número solicitud:
-
P202330798
- Número publicación:
-
ES2953301
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
- Clasificación Internacional de Patentes:
- C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09
- Clasificación Internacional de Patentes de la publicación:
- C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2953301_A11. Péptido que consiste en la secuencia de aminoácidos de SEQ ID NO: 2. 2. Péptido según la reivindicación 1 que consiste en la secuencia de aminoácidos de SEQ ID NO: 3. 3. Péptido según cualquiera de las reivindicaciones 1-2 para su uso como medicamento. 4. Péptido según la reivindicación 3 para su uso como medicamento en enfermedades cardiacas. 5. Péptido según la reivindicación 4 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1. 6. Péptido según la reivindicación 5 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil. 7. Molécula de ADNc que codifica un péptido definido en las reivindicaciones 1-2. 8. Molécula de ADNc según la reivindicación 7 que se selecciona de entre las secuencias descritas en SEQ ID NO: 5-19. 9. Molécula de ADNc que consiste en SEQ ID NO: 5. 10. Molécula de ADNc según cualquiera de las reivindicaciones 7-9 para su uso como medicamento. 11. Molécula de ADNc según la reivindicación 10 para su uso como medicamento en nfermedades cardiacas. 12. Molécula de ADNc según la reivindicación 11 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1. 13. Molécula de ADNc según la reivindicación 12 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil. 14. Vector que incluye una molécula de ADNc definida en cualquiera de las reivindicaciones 7-9. 15. Célula eucariota o procariota que contiene cualquiera de los péptidos, moléculas de ADNc o vectores definidos en las reivindicaciones 1, 2, 7-9, 14. 16. Composición farmacéutica que comprende el péptido de cualquiera de las reivindicaciones 1-2 y un excipiente farmacéuticamente aceptable. 17. Composición farmacéutica que comprende la molécula de cualquiera de las reivindicaciones 7-9 y un excipiente farmacéuticamente aceptable. 18. Composición farmacéutica que comprende el vector, y/o la célula de cualquiera de las reivindicaciones 14-15 y un excipiente farmacéuticamente aceptable. 19. Composición farmacéutica según cualquiera de las reivindicaciones 16-18 para su uso en la prevención y/o el tratamiento de enfermedades cardiacas. 20. Composición farmacéutica según la reivindicación 19 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de unción de los canales Nav1.5 o Kir2.1. 21. Composición farmacéutica según la reivindicación 20 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil.
Los productos y servicios protegidos por este registro son:
C07K 7/06 - C07K 14/47 - A61K 38/08 - A61P 9/06 - C12N 15/09
Descripciones:
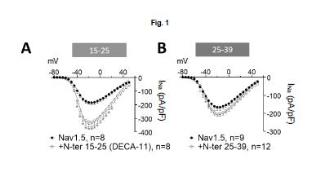
+ ES-2953301_A1 Péptido para el tratamiento de enfermedades cardiacas SECTOR DE LA TÉCNICA La presente invención se encuadra en el sector de la biotecnología con aplicación en el sector farmacéutico. Más concretamente, se refiere a un péptido con propiedades moduladoras de las corrientes iónicas en los cardiomiocitos. ANTECEDENTES DE LA INVENCIÓN La insuficiencia cardiaca (IC) es un síndrome muy prevalente caracterizado por una alta morbilidad y mortalidad (alrededor del 50% en los 5 primeros años) . Las arritmias ventriculares son alteraciones del ritmo cardiaco que pueden desencadenar fibrilación ventricular y muerte súbita (MSC) . La MSC de origen arrítmico es responsable de hasta el 50% de las muertes en pacientes con IC. En los pacientes con IC y arritmias ventriculares potencialmente mortales, la implantación de un desfibrilador o resincronizador ha demostrado disminuir la incidencia de la MSC por arritmias ventriculares y fibrilación ventricular. Sin embargo, son dispositivos muy costosos, que causan importantes efectos adversos (riesgo de infecciones, descargas inapropiadas, aumento de la mortalidad con el número de choques, etc.) que limitan la calidad de vida de los pacientes. En los pacientes con IC se produce una modificación de las propiedades eléctricas de los cardiomiocitos que consiste en la disminución de las corrientes tanto de Na como de K con rectificación interna (INa e Ik1) como consecuencia del descenso en el número de canales Navl.5 y Kir2.1, que son los que generan dichas corrientes, respectivamente. Estos cambios producidos por la IC se denominan "remodelado eléctrico" . El remodelado eléctrico favorece la aparición de arritmias ventriculares potencialmente mortales. Los fármacos antiarrítmicos (FFAA) actualmente aprobados y disponibles en la terapéutica producen efectos proarrítmicos y éstos son tanto más marcados cuanto mayor es el riesgo arrítmico del paciente. Así, en los pacientes con IC, el remodelado léctrico, anatómico e histológico promueve la aparición de arritmias, disminuye el efecto de los FFAA y aumenta la sensibilidad a sus acciones proarrítmicas. Los FFAA del grupo I (hidroxiquinidina, procainamida, disopiramida, lidocaína, propafenona, y flecainida) inhiben la INa bloqueando los canales Nav1.5 y, como consecuencia de ello, pueden dar lugar a efectos proarrítmicos peligrosos. De hecho, están contraindicados en los pacientes con IC porque disminuyen mucho la excitabilidad cardiaca en pacientes que ya la tienen comprometida como consecuencia del remodelado eléctrico. Por ello, aumentan la mortalidad en pacientes con IC y arritmias. Los FFAA del grupo II (antagonistas de los receptores p-adrenérgicos o betabloqueantes) antagonizan los efectos proarrítmicos de la activación del sistema nervioso simpático y, exceptuando en aquellos pacientes en los que están contraindicados (p. ej. asmáticos) , se utilizan para el tratamiento de la IC. A pesar de que se consideran parte del tratamiento óptimo de la IC según las guías terapéuticas, la mortalidad de los pacientes con IC (>50% en los 5 primeros años tras diagnóstico) por causa arrítmica (>50% de la mortalidad total) sigue siendo muy alta. Los FFAA del grupo III (amiodarona, dronedarona, sotalol) prolongan la repolarización ventricular. La dronedarona está contraindicada en pacientes con IC y el sotalol no se utiliza (a no ser que el paciente porte un desfibrilador) porque prolonga excesivamente la repolarización (el intervalo QT del electrocardiograma) induciendo la aparición de arritmias ventriculares en pacientes que, como consecuencia del remodelado eléctrico, ya tienen el QT muy prolongado. Sólo la amiodarona está indicada, pero produce numerosas y graves reacciones adversas que obligan a su retirada en el plazo máximo de 2 años y aumentan la mortalidad por causas no cardiacas. Los FFAA del grupo IV (verapamilo y diltiazem) bloquean los canales de calcio y están contraindicados en los pacientes con IC porque deprimen la contractilidad. Los FFAA de los grupos I, III y IV actúan inhibiendo las corrientes iónicas cardiacas por bloquear los canales que las generan. En diversas patologías cardíacas sería necesario poder aumentar la INa y/o la Ik1 de los cardiomiocitos humanos. Esta necesidad es especialmente perentoria en los pacientes con IC, pero no se limita a llos. La disminución de la iNa deprime la excitabilidad del miocardio haciendo que la conducción del impulso eléctrico cardiaco sea más lenta, lo que favorece la aparición de arritmias. La disminución de la Ik1 , además de disminuir la excitabilidad, prolonga la repolarización cardiaca, lo que prolonga el intervalo QT del electrocardiograma, siendo un factor adicional que promueve también la aparición de arritmias. Sin embargo, en el momento actual, no se dispone de herramientas farmacológicas específicas capaces de aumentar ni la Iki ni la W Desde el punto de vista del tratamiento farmacológico de las arritmias ventriculares potencialmente mortales, los pacientes con IC son huérfanos terapéuticos. Se ha descrito cómo dos compuestos utilizados en el tratamiento de la diabetes tipo 2 (dapagliflozina y empagliflozina) disminuyen la morbi- mortalidad de los pacientes con IC y se sospecha que, además, pueden tener efecto antiarrítmico (Braunwald E. Gliflozins in the Management of Cardiovascular Disease. N Engl J Med. 2022;386:2024-2034) . Por otra parte, se ha demostrado que la incubación de cardiomiocitos sanos humanos con esos compuestos, aumenta la corriente de Na+ y K+ (Dago, M. et al. Empagliflozin and Dapagliflozin Increase Na+ and Inward Rectifier K+ Current Densities in Human Cardiomyocytes Derived from Induced Pluripotent Stem Cells (hiPSC-CMs) Cells 2022;11:3707) . Los autores proponen, que el aumento de la INa y la I ki podría contribuir al efecto cardioprotector. EXPLICACIÓN DE LA INVENCIÓN Péptido para el tratamiento de enfermedades cardiacas. Dada la necesidad de buscar una nueva vía terapéutica para tratar enfermedades cardiacas como las arritmias ventriculares en pacientes con IC, entre otras, se decidió profundizar en el estudio del canal de sodio cardiaco Navl.5, codificado por el gen SCN5A. El análisis de la proteína nos ha permitido identificar una señal de localización nuclear (NLS) en el extremo N-terminal de Navl.5 (número de referencia de la secuencia de la proteína en NCBI: NP_000326.2) . Dicha señal está localizada entre los aminoácidos 13 y 37 de Navl.5 (SEQ ID NO: 1) y está incluida en un péptido de 132 aminoácidos, descrito por Matamoros, M. et al. (Nav1.5 N-terminal domain binding to a1-syntrophin increases membrane density of human Kir2.1, Kir2.2 and Nav1.5 channels. Cardiovasc Res. 2016;110:279-290) . Este péptido de 132 aminoácidos contiene además un sitio de unión a la a1-sintrofina y ejerce un efecto tipo chaperona aumentando la densidad de los canales Nav1.5, Kir2.1 y Kir2.2 en la membrana citoplasmática. Con el objetivo de modular la expresión de SCN5A y del gen que codifica Kir2.1 (KCNJ2) , se ha diseñado un péptido que mantiene la NLS pero que es de menor tamaño para facilitar su acceso al núcleo de la célula. En concreto, es un péptido de 11 aminoácidos localizado entre las posiciones 15 y 25 (SEQ ID NO: 2) , ambas incluidas, de Nav1.5. Esta secuencia aminoacídica es RX1X2RESLAX3X4X5 , siendo X 1= F, Y o W; X2= T, S, C o M; X3= A, G, V, L o I; X4= I, G, A, V o L y Xa= E o D y, preferentemente, es SEQ ID NO: 3 (denominado internamente, y también en esta memoria, DECA-11) . Al analizar el efecto de SEQ ID NO: 2, y más concretamente de SEQ ID NO: 3, sobre el promotor de SCN5A y la consecuente transcripción del gen, no se ha podido observar ningún efecto significativo. Sin embargo, el péptido de 11 aminoácidos es capaz de activar la transcripción de KCNJ2 ejerciendo un efecto protranscripcional sobre el promotor mínimo del gen KCNJ2 humano. Este resultado sorprendente nos animó a analizar los efectos del péptido SEQ ID NO: 2, y más concretamente de SEQ ID NO: 3, sobre la INa y la Ik1 en un modelo de IC en ratón obteniendo resultados positivos. Otro aspecto de la invención se refiere a SEQ ID NO: 2, preferentemente SEQ ID NO: 3, para su uso como medicamento, más concretamente para su uso como medicamento en enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. Un tercer aspecto de la invención se refiere a una molécula de ADN que codifica el péptido de 11 aminoácidos, es decir, a las moléculas de ADNc que codifican los péptidos de las variantes de la secuencia SEQ ID NO: 2 (SEQ ID NO: 5-19) , y referentemente a la molécula de ADNc que codifica DECA-11 (SEQ ID NO: 5) . Otro aspecto de la invención se refiere a SEQ ID NO: 5-19, preferentemente SEQ ID NO: 5, para su uso como medicamento, más concretamente para su uso como medicamento en enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. La invención también se refiere a vectores que incluyen cualquiera de estas moléculas de ADNc (SEQ ID NO: 5-19) y a células eucariotas o procariotas que los contienen esos vectores, o cualquiera de las secuencias de ADNc (SEQ ID NO: 5-19) , o cualquiera de las secuencias peptídicas de SEQ ID NO: 2, preferentemente SEQ ID NO: 3. Un aspecto más de la invención se refiere a una composición farmacéutica que comprende un péptido de secuencia SEQ ID NO: 2, preferentemente SEQ ID NO: 3, y un excipiente farmacéuticamente aceptable. Asimismo, la invención también se refiere a una composición farmacéutica que comprende cualquiera de las moléculas de ADNc definidas por SEQ ID NO: 5-19 y un excipiente farmacéuticamente aceptable. Otro aspecto de la invención hace referencia a composiciones farmacéuticas que incluyen vectores como los descritos más arriba, es decir, que comprenden cualquiera de estas moléculas de ADNc (SEQ ID NO: 5-19) y un excipiente farmacéuticamente aceptable. También hace referencia composiciones farmacéuticas que incluyen células eucariotas o procariotas que los contienen estos vectores, o cualquiera de las secuencias de ADNc (SEQ ID NO: 5-19) , o cualquiera de las secuencias peptídicas de SEQ ID NO: 2, preferentemente SEQ ID NO: 3, y un excipiente farmacéuticamente aceptable. Otro aspecto de la invención se refiere a cualquiera de las composiciones armacéuticas descritas en esta memoria descriptiva para su uso en la prevención y/o el tratamiento de enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. Tabla de secuencias BREVE DESCRIPCIÓN DE LOS DIBUJOS Para complementar la descripción que se está realizando y con objeto de ayudar a una mejor comprensión de las características de la invención, se acompaña como parte integrante de dicha descripción un juego de figuras en donde, con carácter ilustrativo y no limitativo, se ha representado lo siguiente: Figura 1. Densidad de la corriente generada por los canales Nav1.5 humanos en función del potencial de membrana del pulso test en presencia o ausencia de dos péptidos de diferente tamaño que forman parte del extremo N-terminal del canal Nav1.5. En cada panel se nombra el péptido estudiado describiendo la posición del primer y último aminoácido de la secuencia del canal Nav1.5 humano. Figura 2. Densidad de la corriente generada por los canales Kir2.1 humanos en función del potencial de membrana del pulso test en presencia o ausencia del péptido 15-25 que es DECA-11 (SEQ ID NO: 3) . Figura 3. Relaciones densidad de la INa (Fig. 3A) e Ik1 (Fig. 3B) en función del potencial de membrana del pulso aplicado registradas en cardiomiocitos humanos derivados de células madre pluripotentes inducidas. Figura 4. Trazos de INa sostenida o "late" (iNaL) registrados en cardiomiocitos humanos derivados de células madre pluripotentes inducidas en presencia (Fig. 4B) o ausencia (control) de DECA-11 (Fig. 4A) . Se consideró INaL la corriente sostenida sensible a tetrodotoxina TTX (10 ^M) y se cuantificó como porcentaje del pico de corriente (Fig. 4C) . Figura 5. Ensayos de luciferasa para analizar el efecto de DECA-11 (SEQ ID NO: 3) sobre la transcripción de SCN5A (Fig. 5A) y KCNJ2 (Fig. 5B) . La luminiscencia relativa se expresa en unidades arbitrarias (AU) . Figura 6. Esquema del protocolo seguido para la generación del modelo murino con ICfeR. El tiempo se expresa en semanas (S) . Se indican las semanas en la cuales se realizaron los ecocardiogramas basales (ECO1) y finales (ECO2) antes del traslado a nuestro laboratorio. Los animales a los que se les practicó la cirugía sin la ligadura de la aorta se denominan Sham y a los que se les ligó la aorta, TAC. Figura 7. Capacitancia (pF) de los cardiomiocitos disociados de ratones Sham y TAC tratados con Aav-dt-T (control) o Aav-DECA-11 (Aav-SEQ ID NO: 5) . Figura 8. Relaciones densidad de la INa-voltaje obtenidas en cardiomiocitos disociados de ratones Sham tratados o no con DECA-11 (A) y ratones TAC tratados o no con DECA-11 (B) ; resumen de resultados (C) . En el panel C, C significa Control y D11, DECA-11. Figura 9. Relaciones densidad de la IK1-voltaje obtenidas en cardiomiocitos disociados de ratones Sham tratados o no con DECA-11 (A) y ratones TAC tratados o no con DECA-11 (B) ; resumen de resultados (C) . En el panel C, C significa Control y D11 DECA-11 REALIZACIÓN PREFERENTE DE LA INVENCIÓN La presente invención se ilustra mediante los siguientes ejemplos, que no pretenden ser limitativos de su alcance. Ejemplo 1. Diseño de péptidos Entre otras herramientas, en el análisis de Nav1.5 (NCBI: NP_000326.2) , se utilizó un algoritmo de predicción de sitios de localización nuclear (Nguyen Ba AN, et al. NLStradamus: a simple Hidden Markov Model for nuclear localization signal prediction. BMC Bioinformatics. 2009;10:202) con el que se identificó una NLS (SEQ ID NO: 1) entre los aminoácidos 13 y 37, ambos incluidos, de Nav1.5. Si bien el tamaño de la NLS no es excesivo, se diseñaron péptidos de menor tamaño buscando identificar un fragmento mínimo capaz de acceder al núcleo de las células y de aumentar la INa y la Ik1. Entre ellos se seleccionaron un péptido de 11 aminoácidos (SEQ ID NO: 3) y otro de 15 aminoácidos (SEQ ID NO: 4) , que se generaron en el laboratorio. El péptido de 11 aminoácidos se seleccionó con vistas a dejar en el extremo N terminal un residuo Arginina (R) para en caso necesario facilitar la ciclación el péptido para aumentar su estabilidad biológica. Ejemplo 2. Análisis de densidad de corriente generada Además de su capacidad para entrar en el núcleo de las células, buscábamos péptidos capaces de aumentar la densidad de corriente generada por los canales Nav1.5 y Kir2.1 humanos, por lo que analizamos ambos aspectos. Ejemplo 2.1. Densidad de corriente generada por los canales Nav1.5 humanos Para analizar el efecto de los péptidos diseñados en el ejemplo 1 sobre la INa y la Ik1 , el ADNc que codifica SEQ ID NO: 3 o bien SEQ ID NO: 4, descritos en SEQ ID NO: 5 y 20, respectivamente, se clonaron en un vector pcDNA3.1 (+) ® (Invitrogen) para la transfección de células de ovario de hámster chino (CHO) que eran a su vez transfectadas con el ADNc que codifica los canales Navl.5 humanos (SEQ ID NO: 21) . Las células CHO fueron además cotransfectadas con el vector EBO-pcD leu 2 (0.5 |jg) , que codifica la expresión del antígeno de superficie CD8. La posterior adición de anticuerpo anti-CD8, unido a microesferas Dynabeads M450®, permitió identificar las células que habían sido transfectadas. Transcurridas 48 h, una alícuota de la suspensión de células transfectadas se colocaba en la cámara montada sobre la platina de un microscopio invertido (TMS, Nikon) y se perfundía a la velocidad de 1 ml/min con solución externa (en mM) : NaCl 50, CsCl 80, CaCl2 1, M gCh 1.5, HEPES 5 y glucosa 5 (pH 7.35 con CsOH) . Las micropipetas se obtuvieron a partir de capilares de borosilicato (mod. GD-1, Narishige) utilizando un estirador horizontal programable (Sutter mod. P-2000) y puliéndose su boca mediante calor en una microforja (mod. MF-83, Narishige) . Las micropipetas (resistencia de punta de <1.5 M) se llenaron con una solución interna que contenía (mM) : NaF 10, CsF 110, CsCl 20, HEPES 10 y EGTA 10 (pH 7.35 con CsOH) . Las micropipetas se acercaron utilizando un micromanipulador Narishige MO-103 a la membrana de la célula y tras aplicar una pequeña succión, la porción de membrana incluida en la luz de la pipeta se invaginaba, formándose un sello de alta resistencia [del orden de GQ, configuración de "célula unida" (cell attached) ]. Tras la formación del sello, la membrana del parche se rompía mediante una pequeña succión adicional, lo que permitía el registro de la corriente mediante la configuración de "célula entera" de la técnica del "parche de membrana" (whole-cell patch-clamp) . Las corrientes se registraron a 20-22°C mediante un amplificador Axopatch 200B, se filtraban a la mitad de la frecuencia de muestreo y se almacenaban en un ordenador para su posterior análisis. La adquisición e los datos, el análisis de los mismos y los protocolos de pulsos fueron controlados mediante el programa pclamp. Los artefactos de corriente capacitiva generados tras la aplicación de pulsos desde 0 mV a +10 mV se registraron a 50 kHz (filtrados a 10 kHz) para calcular la capacitancia de la célula, la resistencia de acceso y la impedancia de entrada. La frecuencia de muestreo fue de 50 kHz y los datos, filtrados a una frecuencia de 25 kHz, se almacenaban en discos duros para su posterior análisis utilizando la aplicación Clampfit del programa pclamp. La ÍNa se registró aplicando pulsos de 50 ms desde un potencial de fijación de -120 mV a potenciales entre -80 y +50 mV en incrementos de 5 mV. La amplitud del pico de la ÍNa se normalizó a la capacitancia de cada célula calculando así la densidad de la ÍNa (pA/pF) . Las curvas densidad de la ÍNa -voltaje se obtuvieron al representar la densidad de la ÍNa en función del potencial de membrana del pulso aplicado. En la Figura 1, se representan las curvas densidad de la ÍNa -volta je en células que expresaban los canales Nav1.5 (símbolos negros) y en células que expresaban los canales Nav1.5 junto con el ADNc que codifica el fragmento que contiene los aminoácidos 15-25 descritos en SEQ ÍD NO: 3 (SEQ ÍD NO: 5) o el que codifica los aminoácidos 25-39, descritos en SEQ ÍD NO: 4, (SEQ ÍD NO: 20) (símbolos blancos) . Como se puede observar, el fragmento que contiene los aminoácidos 15-25 (SEQ ÍD NO: 3) era capaz de aumentar significativamente la densidad de la ÍNa a diversos potenciales de membrana. Por el contrario, el fragmento que contiene los aminoácidos 25-39 (SEQ ÍD NO: 4) no lo hacía. Cada punto representa la media±EEM de "n" experimentos obtenidos de al menos 3 placas de células CHO diferentes. ANOVA de una vía seguida de Tukey test. * P<0.05 vs. células transfectadas solo con canales Nav1.5. Ejemplo 2.2. Densidad de corriente generada por los canales Kir2.1 humanos. Vistos los resultados del ejemplo 2.1, en este ejemplo se analizó únicamente el péptido descrito en SEQ ÍD NO: 3 utilizando su ADNc (SEQ ÍD NO: 5) . Para ello, se transfectaron células CHO con el ADNc que codifica los canales cardiacos humanos (Kir2.1) que generan la ÍK1 (Origene, USA) (SEQ ÍD NO: 22) cotransfectando las células, o no, con el ADNc descrito en SEQ ÍD NO: 5. En estos experimentos la solución externa que bañaba a las células y la interna que rellenaba las micropipetas tenían la siguiente composición (mM) : NaCl 136, KCl 4, CaCL 1.8, MgCL 1, HEPES 10 y glucosa 10 (pH=7.4 con NaOH) y K-aspartato 80, KCl 50, KH2PO4 10, MgATP 3, HEPES 10, EGTA 5 (pH=7.25 con KOH) , respectivamente. La frecuencia de muestreo fue de 4 kHz y los datos, filtrados a una frecuencia de 2 kHz, se almacenaban en discos duros para su posterior análisis utilizando la aplicación Cl a m p f it del programa pc l a m p . La corriente ( ^ 2.1) se registró aplicando pulsos de 250 ms desde -120 hasta +20 mV partiendo de un potencial de fijación de -60 mV. La densidad de la misma se obtuvo al normalizar la amplitud de la Ik¡í2.1 al final del pulso por la capacitancia de cada célula (pA/pF) . En la Figura 2 se muestra la densidad de Ik¡í2.1 en función del potencial de membrana (mV) del pulso aplicado en células transfectadas con el ADNc que codifica los canales Kir2.1 y cotransfectadas o no con el ADNc que codifica el péptido SEQ ID NO: 3. Como en el ejemplo 2.1, cada punto representa la media±EEM de "n" experimentos obtenidos de al menos 3 placas de células CHO diferentes. ANOVA de una vía seguida de Tukey test. * P<0.05 vs. células transfectadas solo con canales Kir2.1. De nuevo SEQ ID NO: 3 fue capaz de aumentar significativamente la densidad de la I Kir2.1. Ejemplo 2.3. Densidad de corriente generada en cardiomiocitos humanos Infectamos cardiomiocitos humanos derivados de células madre pluripotentes inducidas (hiPSC-CM) con el virus adenoasociado serotipo 9 Ad-td-Tomato (control) o con un virus adenoasociado serotipo 9 que contenía el ADNc del péptido 15-25 (SEQ ID NO: 5) y el de td-Tomato (Aav-DECA-11; Aav-SEQ ID NO: 5) . Se utilizaron hiPSC-CM comerciales (iCell Cardiomyocytes®) que fueron descongeladas y mantenidas en cultivo durante 10 días siguiendo los protocolos descritos por el fabricante (Cellular Dynamics, EEUU) . La infección con el Ad-td-Tomato (proteína roja fluorescente) o Ad-DECA-11 se realizó 48 h antes de proceder con los registros de las corrientes mediante la técnica de patch-clamp en la configuración de célula entera (whole-cell) . La solución externa que bañaba a los cardiomiocitos y la interna que rellenaba las micropipetas tenían la siguiente composición cuando se registraba la iNa (mM) : NaCl 20, MgCh 1.5, CaCl2 1, CsCl 115, HEPES 5, glucosa 10 y nifedipino (1 ^M) (pH= 7.35 con CsOH) y NaF 10, CsF 110, EGTA 10, CsCl 20 y HEPES 10 (pH=7.35 con CsOH) , respectivamente. Para registrar la Ik1, la composición de la solución externa era (mM) : NaCl 148, MgCl2 1, CaCh 1.8, KCl 5.4, NaH2 PO4 0.4, HEPES 15, glucosa 11 y nifedipino (5 ^M) (pH= 7.35 con NaOH) y la de la interna (mM) : KCl 148, MgCh 1, EGTA 5, Creatina 2, Mg-ATP 5, fosfocreatina 5, HEPES 5 (pH=7.2 con KOH) . En la Figura 3, se comprueba que la infección con el virus que codifica DECA-11 es capaz e aumentar significativamente la densidad de la iNa y la Iki registradas en cardiomiocitos humanos derivados de iPSC. En esta figura, cada punto representa la media±EEM de "n" experimentos/ cardiomiocitos obtenidos de al menos 3 placas de cultivo diferentes. * P<0.05 frente a cardiomiocitos infectados con Ad-td-Tomato. ANOVA de una vía seguida de Tukey test. En pacientes con IC aumenta el componente sostenido de la INa denominado INaL. Este aumento produce un incremento de las concentraciones intracelulares de Na+ lo que, a su vez, altera el manejo del Ca2+ intracelular y prolonga la duración de los potenciales de acción provocando efectos proarrítmicos. Por ello, quisimos ver si DECA-11 modificaba la INaL. Para ello, en cardiomiocitos humanos derivados de iPSC se aplicaron pulsos de 500 ms de duración desde -120 hasta -45 mV y se registró la INa y la INaL utilizando las soluciones "externa" e "interna" que se acaban de describir. La INaL se describe como el componente de la corriente sostenida que es sensible a tetrodotoxina (TTX) (10 ^M) y para cuantificarla se midió como porcentaje del pico de corriente (%) . En la Figura 4 se muestra que DECA-11 no aumenta la INaL. Todos los datos presentados hasta el momento demuestran que SEQ ID NO: 3 es capaz de aumentar la densidad de la INa y la Iki en sistemas de expresión heterólogos y en cardiomiocitos humanos sin modificar la de la INaL. Ejemplo 3. Efecto protranscripcional de DECA-11 Para estudiar el efecto protranscripcional, se sembraron células HEK-293 en placas de 96 pocillos y se transfectaron con 300 ng de vectores LightSwitch-Prom luciferase que codificaban el promotor mínimo humano («1000 pares de bases) de los genes SCN5A o KCNJ2 (Active Motif) y se cotransfectaban o no con el vector que contenía el ADNc del péptido 15-25 (SEQ ID NO: 5) . 48 h tras la transfección, se realizaron los ensayos de luciferasa utilizando el reactivo LightSwitch Luciferase Assay, también de Active Motif, y un luminómetro Berthold. Todos los ensayos se realizaron por triplicado y cada punto representa la media de cada triplicado técnico. Se comprobó que el péptido descrito en SEQ ID NO: 3 no ejerce un efecto significativo sobre el promotor mínimo del gen SCN5A humano (Figura 5) , sin embargo, sí ejerce un efecto protranscripcional sobre el promotor mínimo del gen KCNJ2 humano, lo que implica que aumenta la expresión de los canales Kir2.1. Ejemplo 4. Ensayos en modelo murino de IC Se utilizó un modelo murino de IC con fracción de eyección reducida (ICfeR) para analizar el efecto de SEQ ID NO: 3 sobre la disminución de la iNa y la Iki producida por el remodelado eléctrico asociado a la IC. Se trata de ratones a los que se les provoca una coartación aórtica transversa mediante ligadura (Transverse aortic constriction, TAC) ; la sobrecarga de presión provoca la aparición de hipertrofia cardiaca e IC. Los ratones fueron generados en el Centro de Investigación Médica de la Universidad de Navarra (CIMA) , bajo la dirección de la Dra. Aránzazu González Miqueo. Se utilizaron ratones de 8 semanas de edad a los que se administraron 3.5*1010 partículas de virus adenoasociados tipo 9 que codificaban o bien el reportero fluorescente td-Tomato (Aav-dt-T) sólo, o bien, el reportero y el péptido DECA-11. A las 12 semanas de edad se realizó un control ecocardiográfico (basal) y en la semana 13 se les practicó una cirugía en la que se les ligaba la aorta (animales TAC) o no (animales Sham) . En la parte superior de la Figura 6 se muestra cada uno de los procedimientos a los que fueron sometidos los animales en función de su edad (en semanas) ; en la parte inferior se muestran los cuatro grupos de animales sometidos a cirugía con ligadura (TAC) o no (Sham) . En la semana 19 de vida se les practicó un nuevo control ecocardiográfico (ECO) que demostraba que los animales TAC presentaban ICfeR, tal y como se esperaba. Esa misma semana se enviaron al animalario de la UCM. A continuación, los ratones fueron heparinizados y anestesiados y luego sacrificados por dislocación cervical, a razón de uno por día, practicándose una toracotomía para extraer el corazón que fue montado a través de la aorta en una cánula conectada a un aparato de Langerdorff para la disociación enzimática de los miocitos cardíacos. Tras la extracción del corazón, éste se canulaba a través de la aorta y se colocaba en un aparato de Langerdorff. En primer lugar, se perfundían los corazones con una solución de Tyrode modificada (composición en mM: NaCl 136, KCl 4, MgCh 2, CaCl21.8, HEPES 10, glucosa 10, Ac. pirúvico 3 y tiamina 0.1, pH=7.4 con NaOH) burbujeada con oxígeno y a 37° C durante 3-5 minutos. Posteriormente, se perfundían otros 8 minutos con la misma solución que no contenía CaCE Transcurridos 1 o 2 minutos, el corazón deja de latir. A continuación, se perfundían con la solución de Tyrode sin CaCl2 suplementada con 120 u/mL de colagenasa tipo II de Worthington y 0.5 u/mL de proteasa XIV de Sigma. Por último, los corazones eran perfundidos con una solución denominada de la iguiente composición (mM) : KCl 25, KH2 PO410, MgCl2 2, EGTA-K 0.5, HEPES-K 5, ac. glutámico 100, ac. aspártico 10, taurina 20, creatina 5 y glucosa 10 (pH=7.2 con KOH) . Transcurrido todo este proceso, se descolgaba el corazón de la cánula y se agitaba en alíquotas de solución K donde se iban disgregando los miocitos que se almacenaban en la nevera durante al menos una hora antes de comenzar los registros electrofisiológicos. En la Figura 7 se muestra la capacitancia (pF) de los miocitos cardiacos disociados de los cuatro grupos de ratones (12 en total) . La capacitancia es una medida indirecta y fiable del tamaño de las células. Como se puede observar, no había diferencias significativas en la capacitancia de los miocitos de los animales Sham, hubieran sido éstos infectados con Ad-td-Tomato (control) o con Aav-DECA-11. Por el contrario, la capacitancia de los cardiomiocitos de los animales sometidos al procedimiento TAC resultó significativamente mayor (P<0.05) que la de los animales Sham control y DECA-11. Este resultado concuerda con lo esperado, puesto que los animales TAC presentan hipertrofia cardiaca y, por tanto, el tamaño de sus cardiomiocitos es mayor que el de los de corazones normales. La capacitancia de los miocitos de los animales TAC tratados con DECA-11 resultó ser significativamente menor que la de los animales TAC no tratados lo que indica que la administración de DECA-11 previene la aparición de hipertrofia de los cardiomiocitos asociada a la ICfeR. Para registrar la INa en cardiomiocitos de ratón, la composición de la solución externa fue (mM) : NaCl 4, MgCb 1, CaCh 1, CdCb 0.1, CsCl 133.5, HEPES 2 0 y glucosa 11 (pH=7.35 con CsOH) y la que rellenaba la micropipeta de registro (mM) : NaF 10, CsF 110, CsCl 20, HEPES 10 y EGTA 10 (pH 7.35 con CsOH) . El resto de protocolos y condiciones eran iguales a los utilizados para el registro de la INa en cardiomiocitos humanos derivados de iPSC (según el Ejemplo 2.3) . Como se muestra en la Figura 9, en animales con ICfeR, y como consecuencia del remodelado eléctrico, la densidad de la INa registrada en cardiomiocitos de ratones TAC control fue significativamente menor a la de los ratones Sham control. El pretratamiento con DECA-11 aumentó la densidad de la INa de los cardiomiocitos de los animales Sham y, más importante, aumentó de forma significativa y marcada la densidad de la INa de los cardiomiocitos TAC. Este resultado demuestra que la administración de DECA-11 previene la isminución de la densidad de la iNa producida por la ICfeR en un modelo murino. Como ya se ha indicado, en los cardiomiocitos de ratones de los cuatro grupos también se registró la Ik1. Para ello, la composición de la solución externa era (mM) : NaCl 140, MgCl21, CaCl21, KCl 4, HEPES 10, 4-aminopiridina 2, nifedipino (1 M) , atropina (0.1 M) , glibenclamida (10 M) y glucosa 10, (pH= 7.35 con NaOH) y la de la interna (mM) : K-aspartato 80, KCl 50, KH2PO4 10, MgATP 3, HEPES 10, EGTA 5 (pH=7.25 con KOH) . Como consecuencia del remodelado eléctrico asociado a la ICfeR producida por la constricción transversal de la aorta, la densidad de la Iki fue significativamente menor en los cardiomiocitos de los animales TAC control que en la de los Sham control (Figuras 9A y 9B) . Tanto en animales Sham como en animales TAC la administración de DECA-11 aumenta significativamente la Iki. De hecho, la densidad de la Iki en los animales TAC pretratados con DECA-11 no es diferente de la que se registra en animales Sham. Estos resultados demuestran que la administración de DECA-11 previene la disminución de la densidad de la Iki producida por la ICfeR en un modelo murino.
Publicaciones:
ES2953301 (10/11/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 25/09/2023 se realizó Registro Instancia de Solicitud
En fecha 25/09/2023 se realizó Admisión a Trámite
En fecha 25/09/2023 se realizó Aceptación Tramitación CAP
En fecha 25/09/2023 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 06/10/2023 se realizó Superado examen de oficio
En fecha 27/10/2023 se realizó Realizado IET
En fecha 31/10/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 10/11/2023 se realizó Publicación Solicitud
En fecha 10/11/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 23/11/2023 se realizó PETEX_Petición de examen sustantivo
En fecha 26/02/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
25/09/2023 - Pago Tasas IET
+ ES-2953301_A11. Péptido que consiste en la secuencia de aminoácidos de SEQ ID NO: 2. 2. Péptido según la reivindicación 1 que consiste en la secuencia de aminoácidos de SEQ ID NO: 3. 3. Péptido según cualquiera de las reivindicaciones 1-2 para su uso como medicamento. 4. Péptido según la reivindicación 3 para su uso como medicamento en enfermedades cardiacas. 5. Péptido según la reivindicación 4 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1. 6. Péptido según la reivindicación 5 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil. 7. Molécula de ADNc que codifica un péptido definido en las reivindicaciones 1-2. 8. Molécula de ADNc según la reivindicación 7 que se selecciona de entre las secuencias descritas en SEQ ID NO: 5-19. 9. Molécula de ADNc que consiste en SEQ ID NO: 5. 10. Molécula de ADNc según cualquiera de las reivindicaciones 7-9 para su uso como medicamento. 11. Molécula de ADNc según la reivindicación 10 para su uso como medicamento en nfermedades cardiacas. 12. Molécula de ADNc según la reivindicación 11 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1. 13. Molécula de ADNc según la reivindicación 12 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil. 14. Vector que incluye una molécula de ADNc definida en cualquiera de las reivindicaciones 7-9. 15. Célula eucariota o procariota que contiene cualquiera de los péptidos, moléculas de ADNc o vectores definidos en las reivindicaciones 1, 2, 7-9, 14. 16. Composición farmacéutica que comprende el péptido de cualquiera de las reivindicaciones 1-2 y un excipiente farmacéuticamente aceptable. 17. Composición farmacéutica que comprende la molécula de cualquiera de las reivindicaciones 7-9 y un excipiente farmacéuticamente aceptable. 18. Composición farmacéutica que comprende el vector, y/o la célula de cualquiera de las reivindicaciones 14-15 y un excipiente farmacéuticamente aceptable. 19. Composición farmacéutica según cualquiera de las reivindicaciones 16-18 para su uso en la prevención y/o el tratamiento de enfermedades cardiacas. 20. Composición farmacéutica según la reivindicación 19 donde las enfermedades cardiacas pertenecen al grupo formado por: arritmias ventriculares asociadas a la hipertrofia cardiaca, insuficiencia cardiaca y/o a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de unción de los canales Nav1.5 o Kir2.1. 21. Composición farmacéutica según la reivindicación 20 donde los síndromes hereditarios pertenecen al grupo formado por: el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) y el Síndrome de Andersen-Tawil.
Los productos y servicios protegidos por este registro son:
C07K 7/06 - C07K 14/47 - A61K 38/08 - A61P 9/06 - C12N 15/09
Descripciones:
+ ES-2953301_A1 Péptido para el tratamiento de enfermedades cardiacas SECTOR DE LA TÉCNICA La presente invención se encuadra en el sector de la biotecnología con aplicación en el sector farmacéutico. Más concretamente, se refiere a un péptido con propiedades moduladoras de las corrientes iónicas en los cardiomiocitos. ANTECEDENTES DE LA INVENCIÓN La insuficiencia cardiaca (IC) es un síndrome muy prevalente caracterizado por una alta morbilidad y mortalidad (alrededor del 50% en los 5 primeros años) . Las arritmias ventriculares son alteraciones del ritmo cardiaco que pueden desencadenar fibrilación ventricular y muerte súbita (MSC) . La MSC de origen arrítmico es responsable de hasta el 50% de las muertes en pacientes con IC. En los pacientes con IC y arritmias ventriculares potencialmente mortales, la implantación de un desfibrilador o resincronizador ha demostrado disminuir la incidencia de la MSC por arritmias ventriculares y fibrilación ventricular. Sin embargo, son dispositivos muy costosos, que causan importantes efectos adversos (riesgo de infecciones, descargas inapropiadas, aumento de la mortalidad con el número de choques, etc.) que limitan la calidad de vida de los pacientes. En los pacientes con IC se produce una modificación de las propiedades eléctricas de los cardiomiocitos que consiste en la disminución de las corrientes tanto de Na como de K con rectificación interna (INa e Ik1) como consecuencia del descenso en el número de canales Navl.5 y Kir2.1, que son los que generan dichas corrientes, respectivamente. Estos cambios producidos por la IC se denominan "remodelado eléctrico" . El remodelado eléctrico favorece la aparición de arritmias ventriculares potencialmente mortales. Los fármacos antiarrítmicos (FFAA) actualmente aprobados y disponibles en la terapéutica producen efectos proarrítmicos y éstos son tanto más marcados cuanto mayor es el riesgo arrítmico del paciente. Así, en los pacientes con IC, el remodelado léctrico, anatómico e histológico promueve la aparición de arritmias, disminuye el efecto de los FFAA y aumenta la sensibilidad a sus acciones proarrítmicas. Los FFAA del grupo I (hidroxiquinidina, procainamida, disopiramida, lidocaína, propafenona, y flecainida) inhiben la INa bloqueando los canales Nav1.5 y, como consecuencia de ello, pueden dar lugar a efectos proarrítmicos peligrosos. De hecho, están contraindicados en los pacientes con IC porque disminuyen mucho la excitabilidad cardiaca en pacientes que ya la tienen comprometida como consecuencia del remodelado eléctrico. Por ello, aumentan la mortalidad en pacientes con IC y arritmias. Los FFAA del grupo II (antagonistas de los receptores p-adrenérgicos o betabloqueantes) antagonizan los efectos proarrítmicos de la activación del sistema nervioso simpático y, exceptuando en aquellos pacientes en los que están contraindicados (p. ej. asmáticos) , se utilizan para el tratamiento de la IC. A pesar de que se consideran parte del tratamiento óptimo de la IC según las guías terapéuticas, la mortalidad de los pacientes con IC (>50% en los 5 primeros años tras diagnóstico) por causa arrítmica (>50% de la mortalidad total) sigue siendo muy alta. Los FFAA del grupo III (amiodarona, dronedarona, sotalol) prolongan la repolarización ventricular. La dronedarona está contraindicada en pacientes con IC y el sotalol no se utiliza (a no ser que el paciente porte un desfibrilador) porque prolonga excesivamente la repolarización (el intervalo QT del electrocardiograma) induciendo la aparición de arritmias ventriculares en pacientes que, como consecuencia del remodelado eléctrico, ya tienen el QT muy prolongado. Sólo la amiodarona está indicada, pero produce numerosas y graves reacciones adversas que obligan a su retirada en el plazo máximo de 2 años y aumentan la mortalidad por causas no cardiacas. Los FFAA del grupo IV (verapamilo y diltiazem) bloquean los canales de calcio y están contraindicados en los pacientes con IC porque deprimen la contractilidad. Los FFAA de los grupos I, III y IV actúan inhibiendo las corrientes iónicas cardiacas por bloquear los canales que las generan. En diversas patologías cardíacas sería necesario poder aumentar la INa y/o la Ik1 de los cardiomiocitos humanos. Esta necesidad es especialmente perentoria en los pacientes con IC, pero no se limita a llos. La disminución de la iNa deprime la excitabilidad del miocardio haciendo que la conducción del impulso eléctrico cardiaco sea más lenta, lo que favorece la aparición de arritmias. La disminución de la Ik1 , además de disminuir la excitabilidad, prolonga la repolarización cardiaca, lo que prolonga el intervalo QT del electrocardiograma, siendo un factor adicional que promueve también la aparición de arritmias. Sin embargo, en el momento actual, no se dispone de herramientas farmacológicas específicas capaces de aumentar ni la Iki ni la W Desde el punto de vista del tratamiento farmacológico de las arritmias ventriculares potencialmente mortales, los pacientes con IC son huérfanos terapéuticos. Se ha descrito cómo dos compuestos utilizados en el tratamiento de la diabetes tipo 2 (dapagliflozina y empagliflozina) disminuyen la morbi- mortalidad de los pacientes con IC y se sospecha que, además, pueden tener efecto antiarrítmico (Braunwald E. Gliflozins in the Management of Cardiovascular Disease. N Engl J Med. 2022;386:2024-2034) . Por otra parte, se ha demostrado que la incubación de cardiomiocitos sanos humanos con esos compuestos, aumenta la corriente de Na+ y K+ (Dago, M. et al. Empagliflozin and Dapagliflozin Increase Na+ and Inward Rectifier K+ Current Densities in Human Cardiomyocytes Derived from Induced Pluripotent Stem Cells (hiPSC-CMs) Cells 2022;11:3707) . Los autores proponen, que el aumento de la INa y la I ki podría contribuir al efecto cardioprotector. EXPLICACIÓN DE LA INVENCIÓN Péptido para el tratamiento de enfermedades cardiacas. Dada la necesidad de buscar una nueva vía terapéutica para tratar enfermedades cardiacas como las arritmias ventriculares en pacientes con IC, entre otras, se decidió profundizar en el estudio del canal de sodio cardiaco Navl.5, codificado por el gen SCN5A. El análisis de la proteína nos ha permitido identificar una señal de localización nuclear (NLS) en el extremo N-terminal de Navl.5 (número de referencia de la secuencia de la proteína en NCBI: NP_000326.2) . Dicha señal está localizada entre los aminoácidos 13 y 37 de Navl.5 (SEQ ID NO: 1) y está incluida en un péptido de 132 aminoácidos, descrito por Matamoros, M. et al. (Nav1.5 N-terminal domain binding to a1-syntrophin increases membrane density of human Kir2.1, Kir2.2 and Nav1.5 channels. Cardiovasc Res. 2016;110:279-290) . Este péptido de 132 aminoácidos contiene además un sitio de unión a la a1-sintrofina y ejerce un efecto tipo chaperona aumentando la densidad de los canales Nav1.5, Kir2.1 y Kir2.2 en la membrana citoplasmática. Con el objetivo de modular la expresión de SCN5A y del gen que codifica Kir2.1 (KCNJ2) , se ha diseñado un péptido que mantiene la NLS pero que es de menor tamaño para facilitar su acceso al núcleo de la célula. En concreto, es un péptido de 11 aminoácidos localizado entre las posiciones 15 y 25 (SEQ ID NO: 2) , ambas incluidas, de Nav1.5. Esta secuencia aminoacídica es RX1X2RESLAX3X4X5 , siendo X 1= F, Y o W; X2= T, S, C o M; X3= A, G, V, L o I; X4= I, G, A, V o L y Xa= E o D y, preferentemente, es SEQ ID NO: 3 (denominado internamente, y también en esta memoria, DECA-11) . Al analizar el efecto de SEQ ID NO: 2, y más concretamente de SEQ ID NO: 3, sobre el promotor de SCN5A y la consecuente transcripción del gen, no se ha podido observar ningún efecto significativo. Sin embargo, el péptido de 11 aminoácidos es capaz de activar la transcripción de KCNJ2 ejerciendo un efecto protranscripcional sobre el promotor mínimo del gen KCNJ2 humano. Este resultado sorprendente nos animó a analizar los efectos del péptido SEQ ID NO: 2, y más concretamente de SEQ ID NO: 3, sobre la INa y la Ik1 en un modelo de IC en ratón obteniendo resultados positivos. Otro aspecto de la invención se refiere a SEQ ID NO: 2, preferentemente SEQ ID NO: 3, para su uso como medicamento, más concretamente para su uso como medicamento en enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. Un tercer aspecto de la invención se refiere a una molécula de ADN que codifica el péptido de 11 aminoácidos, es decir, a las moléculas de ADNc que codifican los péptidos de las variantes de la secuencia SEQ ID NO: 2 (SEQ ID NO: 5-19) , y referentemente a la molécula de ADNc que codifica DECA-11 (SEQ ID NO: 5) . Otro aspecto de la invención se refiere a SEQ ID NO: 5-19, preferentemente SEQ ID NO: 5, para su uso como medicamento, más concretamente para su uso como medicamento en enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. La invención también se refiere a vectores que incluyen cualquiera de estas moléculas de ADNc (SEQ ID NO: 5-19) y a células eucariotas o procariotas que los contienen esos vectores, o cualquiera de las secuencias de ADNc (SEQ ID NO: 5-19) , o cualquiera de las secuencias peptídicas de SEQ ID NO: 2, preferentemente SEQ ID NO: 3. Un aspecto más de la invención se refiere a una composición farmacéutica que comprende un péptido de secuencia SEQ ID NO: 2, preferentemente SEQ ID NO: 3, y un excipiente farmacéuticamente aceptable. Asimismo, la invención también se refiere a una composición farmacéutica que comprende cualquiera de las moléculas de ADNc definidas por SEQ ID NO: 5-19 y un excipiente farmacéuticamente aceptable. Otro aspecto de la invención hace referencia a composiciones farmacéuticas que incluyen vectores como los descritos más arriba, es decir, que comprenden cualquiera de estas moléculas de ADNc (SEQ ID NO: 5-19) y un excipiente farmacéuticamente aceptable. También hace referencia composiciones farmacéuticas que incluyen células eucariotas o procariotas que los contienen estos vectores, o cualquiera de las secuencias de ADNc (SEQ ID NO: 5-19) , o cualquiera de las secuencias peptídicas de SEQ ID NO: 2, preferentemente SEQ ID NO: 3, y un excipiente farmacéuticamente aceptable. Otro aspecto de la invención se refiere a cualquiera de las composiciones armacéuticas descritas en esta memoria descriptiva para su uso en la prevención y/o el tratamiento de enfermedades cardiacas, entre ellas: las arritmias ventriculares asociadas a la hipertrofia cardiaca, la insuficiencia cardiaca y a los síndromes hereditarios secundarios a mutaciones en los genes SCN5A o KCNJ2 que producen la pérdida de función de los canales Nav1.5 o Kir2.1, como por ejemplo, el Síndrome de Brugada, el Síndrome de disminución progresiva de la conducción (Progressive cardiac conduction defect) o el Síndrome de Andersen-Tawil, entre otras. Tabla de secuencias BREVE DESCRIPCIÓN DE LOS DIBUJOS Para complementar la descripción que se está realizando y con objeto de ayudar a una mejor comprensión de las características de la invención, se acompaña como parte integrante de dicha descripción un juego de figuras en donde, con carácter ilustrativo y no limitativo, se ha representado lo siguiente: Figura 1. Densidad de la corriente generada por los canales Nav1.5 humanos en función del potencial de membrana del pulso test en presencia o ausencia de dos péptidos de diferente tamaño que forman parte del extremo N-terminal del canal Nav1.5. En cada panel se nombra el péptido estudiado describiendo la posición del primer y último aminoácido de la secuencia del canal Nav1.5 humano. Figura 2. Densidad de la corriente generada por los canales Kir2.1 humanos en función del potencial de membrana del pulso test en presencia o ausencia del péptido 15-25 que es DECA-11 (SEQ ID NO: 3) . Figura 3. Relaciones densidad de la INa (Fig. 3A) e Ik1 (Fig. 3B) en función del potencial de membrana del pulso aplicado registradas en cardiomiocitos humanos derivados de células madre pluripotentes inducidas. Figura 4. Trazos de INa sostenida o "late" (iNaL) registrados en cardiomiocitos humanos derivados de células madre pluripotentes inducidas en presencia (Fig. 4B) o ausencia (control) de DECA-11 (Fig. 4A) . Se consideró INaL la corriente sostenida sensible a tetrodotoxina TTX (10 ^M) y se cuantificó como porcentaje del pico de corriente (Fig. 4C) . Figura 5. Ensayos de luciferasa para analizar el efecto de DECA-11 (SEQ ID NO: 3) sobre la transcripción de SCN5A (Fig. 5A) y KCNJ2 (Fig. 5B) . La luminiscencia relativa se expresa en unidades arbitrarias (AU) . Figura 6. Esquema del protocolo seguido para la generación del modelo murino con ICfeR. El tiempo se expresa en semanas (S) . Se indican las semanas en la cuales se realizaron los ecocardiogramas basales (ECO1) y finales (ECO2) antes del traslado a nuestro laboratorio. Los animales a los que se les practicó la cirugía sin la ligadura de la aorta se denominan Sham y a los que se les ligó la aorta, TAC. Figura 7. Capacitancia (pF) de los cardiomiocitos disociados de ratones Sham y TAC tratados con Aav-dt-T (control) o Aav-DECA-11 (Aav-SEQ ID NO: 5) . Figura 8. Relaciones densidad de la INa-voltaje obtenidas en cardiomiocitos disociados de ratones Sham tratados o no con DECA-11 (A) y ratones TAC tratados o no con DECA-11 (B) ; resumen de resultados (C) . En el panel C, C significa Control y D11, DECA-11. Figura 9. Relaciones densidad de la IK1-voltaje obtenidas en cardiomiocitos disociados de ratones Sham tratados o no con DECA-11 (A) y ratones TAC tratados o no con DECA-11 (B) ; resumen de resultados (C) . En el panel C, C significa Control y D11 DECA-11 REALIZACIÓN PREFERENTE DE LA INVENCIÓN La presente invención se ilustra mediante los siguientes ejemplos, que no pretenden ser limitativos de su alcance. Ejemplo 1. Diseño de péptidos Entre otras herramientas, en el análisis de Nav1.5 (NCBI: NP_000326.2) , se utilizó un algoritmo de predicción de sitios de localización nuclear (Nguyen Ba AN, et al. NLStradamus: a simple Hidden Markov Model for nuclear localization signal prediction. BMC Bioinformatics. 2009;10:202) con el que se identificó una NLS (SEQ ID NO: 1) entre los aminoácidos 13 y 37, ambos incluidos, de Nav1.5. Si bien el tamaño de la NLS no es excesivo, se diseñaron péptidos de menor tamaño buscando identificar un fragmento mínimo capaz de acceder al núcleo de las células y de aumentar la INa y la Ik1. Entre ellos se seleccionaron un péptido de 11 aminoácidos (SEQ ID NO: 3) y otro de 15 aminoácidos (SEQ ID NO: 4) , que se generaron en el laboratorio. El péptido de 11 aminoácidos se seleccionó con vistas a dejar en el extremo N terminal un residuo Arginina (R) para en caso necesario facilitar la ciclación el péptido para aumentar su estabilidad biológica. Ejemplo 2. Análisis de densidad de corriente generada Además de su capacidad para entrar en el núcleo de las células, buscábamos péptidos capaces de aumentar la densidad de corriente generada por los canales Nav1.5 y Kir2.1 humanos, por lo que analizamos ambos aspectos. Ejemplo 2.1. Densidad de corriente generada por los canales Nav1.5 humanos Para analizar el efecto de los péptidos diseñados en el ejemplo 1 sobre la INa y la Ik1 , el ADNc que codifica SEQ ID NO: 3 o bien SEQ ID NO: 4, descritos en SEQ ID NO: 5 y 20, respectivamente, se clonaron en un vector pcDNA3.1 (+) ® (Invitrogen) para la transfección de células de ovario de hámster chino (CHO) que eran a su vez transfectadas con el ADNc que codifica los canales Navl.5 humanos (SEQ ID NO: 21) . Las células CHO fueron además cotransfectadas con el vector EBO-pcD leu 2 (0.5 |jg) , que codifica la expresión del antígeno de superficie CD8. La posterior adición de anticuerpo anti-CD8, unido a microesferas Dynabeads M450®, permitió identificar las células que habían sido transfectadas. Transcurridas 48 h, una alícuota de la suspensión de células transfectadas se colocaba en la cámara montada sobre la platina de un microscopio invertido (TMS, Nikon) y se perfundía a la velocidad de 1 ml/min con solución externa (en mM) : NaCl 50, CsCl 80, CaCl2 1, M gCh 1.5, HEPES 5 y glucosa 5 (pH 7.35 con CsOH) . Las micropipetas se obtuvieron a partir de capilares de borosilicato (mod. GD-1, Narishige) utilizando un estirador horizontal programable (Sutter mod. P-2000) y puliéndose su boca mediante calor en una microforja (mod. MF-83, Narishige) . Las micropipetas (resistencia de punta de <1.5 M) se llenaron con una solución interna que contenía (mM) : NaF 10, CsF 110, CsCl 20, HEPES 10 y EGTA 10 (pH 7.35 con CsOH) . Las micropipetas se acercaron utilizando un micromanipulador Narishige MO-103 a la membrana de la célula y tras aplicar una pequeña succión, la porción de membrana incluida en la luz de la pipeta se invaginaba, formándose un sello de alta resistencia [del orden de GQ, configuración de "célula unida" (cell attached) ]. Tras la formación del sello, la membrana del parche se rompía mediante una pequeña succión adicional, lo que permitía el registro de la corriente mediante la configuración de "célula entera" de la técnica del "parche de membrana" (whole-cell patch-clamp) . Las corrientes se registraron a 20-22°C mediante un amplificador Axopatch 200B, se filtraban a la mitad de la frecuencia de muestreo y se almacenaban en un ordenador para su posterior análisis. La adquisición e los datos, el análisis de los mismos y los protocolos de pulsos fueron controlados mediante el programa pclamp. Los artefactos de corriente capacitiva generados tras la aplicación de pulsos desde 0 mV a +10 mV se registraron a 50 kHz (filtrados a 10 kHz) para calcular la capacitancia de la célula, la resistencia de acceso y la impedancia de entrada. La frecuencia de muestreo fue de 50 kHz y los datos, filtrados a una frecuencia de 25 kHz, se almacenaban en discos duros para su posterior análisis utilizando la aplicación Clampfit del programa pclamp. La ÍNa se registró aplicando pulsos de 50 ms desde un potencial de fijación de -120 mV a potenciales entre -80 y +50 mV en incrementos de 5 mV. La amplitud del pico de la ÍNa se normalizó a la capacitancia de cada célula calculando así la densidad de la ÍNa (pA/pF) . Las curvas densidad de la ÍNa -voltaje se obtuvieron al representar la densidad de la ÍNa en función del potencial de membrana del pulso aplicado. En la Figura 1, se representan las curvas densidad de la ÍNa -volta je en células que expresaban los canales Nav1.5 (símbolos negros) y en células que expresaban los canales Nav1.5 junto con el ADNc que codifica el fragmento que contiene los aminoácidos 15-25 descritos en SEQ ÍD NO: 3 (SEQ ÍD NO: 5) o el que codifica los aminoácidos 25-39, descritos en SEQ ÍD NO: 4, (SEQ ÍD NO: 20) (símbolos blancos) . Como se puede observar, el fragmento que contiene los aminoácidos 15-25 (SEQ ÍD NO: 3) era capaz de aumentar significativamente la densidad de la ÍNa a diversos potenciales de membrana. Por el contrario, el fragmento que contiene los aminoácidos 25-39 (SEQ ÍD NO: 4) no lo hacía. Cada punto representa la media±EEM de "n" experimentos obtenidos de al menos 3 placas de células CHO diferentes. ANOVA de una vía seguida de Tukey test. * P<0.05 vs. células transfectadas solo con canales Nav1.5. Ejemplo 2.2. Densidad de corriente generada por los canales Kir2.1 humanos. Vistos los resultados del ejemplo 2.1, en este ejemplo se analizó únicamente el péptido descrito en SEQ ÍD NO: 3 utilizando su ADNc (SEQ ÍD NO: 5) . Para ello, se transfectaron células CHO con el ADNc que codifica los canales cardiacos humanos (Kir2.1) que generan la ÍK1 (Origene, USA) (SEQ ÍD NO: 22) cotransfectando las células, o no, con el ADNc descrito en SEQ ÍD NO: 5. En estos experimentos la solución externa que bañaba a las células y la interna que rellenaba las micropipetas tenían la siguiente composición (mM) : NaCl 136, KCl 4, CaCL 1.8, MgCL 1, HEPES 10 y glucosa 10 (pH=7.4 con NaOH) y K-aspartato 80, KCl 50, KH2PO4 10, MgATP 3, HEPES 10, EGTA 5 (pH=7.25 con KOH) , respectivamente. La frecuencia de muestreo fue de 4 kHz y los datos, filtrados a una frecuencia de 2 kHz, se almacenaban en discos duros para su posterior análisis utilizando la aplicación Cl a m p f it del programa pc l a m p . La corriente ( ^ 2.1) se registró aplicando pulsos de 250 ms desde -120 hasta +20 mV partiendo de un potencial de fijación de -60 mV. La densidad de la misma se obtuvo al normalizar la amplitud de la Ik¡í2.1 al final del pulso por la capacitancia de cada célula (pA/pF) . En la Figura 2 se muestra la densidad de Ik¡í2.1 en función del potencial de membrana (mV) del pulso aplicado en células transfectadas con el ADNc que codifica los canales Kir2.1 y cotransfectadas o no con el ADNc que codifica el péptido SEQ ID NO: 3. Como en el ejemplo 2.1, cada punto representa la media±EEM de "n" experimentos obtenidos de al menos 3 placas de células CHO diferentes. ANOVA de una vía seguida de Tukey test. * P<0.05 vs. células transfectadas solo con canales Kir2.1. De nuevo SEQ ID NO: 3 fue capaz de aumentar significativamente la densidad de la I Kir2.1. Ejemplo 2.3. Densidad de corriente generada en cardiomiocitos humanos Infectamos cardiomiocitos humanos derivados de células madre pluripotentes inducidas (hiPSC-CM) con el virus adenoasociado serotipo 9 Ad-td-Tomato (control) o con un virus adenoasociado serotipo 9 que contenía el ADNc del péptido 15-25 (SEQ ID NO: 5) y el de td-Tomato (Aav-DECA-11; Aav-SEQ ID NO: 5) . Se utilizaron hiPSC-CM comerciales (iCell Cardiomyocytes®) que fueron descongeladas y mantenidas en cultivo durante 10 días siguiendo los protocolos descritos por el fabricante (Cellular Dynamics, EEUU) . La infección con el Ad-td-Tomato (proteína roja fluorescente) o Ad-DECA-11 se realizó 48 h antes de proceder con los registros de las corrientes mediante la técnica de patch-clamp en la configuración de célula entera (whole-cell) . La solución externa que bañaba a los cardiomiocitos y la interna que rellenaba las micropipetas tenían la siguiente composición cuando se registraba la iNa (mM) : NaCl 20, MgCh 1.5, CaCl2 1, CsCl 115, HEPES 5, glucosa 10 y nifedipino (1 ^M) (pH= 7.35 con CsOH) y NaF 10, CsF 110, EGTA 10, CsCl 20 y HEPES 10 (pH=7.35 con CsOH) , respectivamente. Para registrar la Ik1, la composición de la solución externa era (mM) : NaCl 148, MgCl2 1, CaCh 1.8, KCl 5.4, NaH2 PO4 0.4, HEPES 15, glucosa 11 y nifedipino (5 ^M) (pH= 7.35 con NaOH) y la de la interna (mM) : KCl 148, MgCh 1, EGTA 5, Creatina 2, Mg-ATP 5, fosfocreatina 5, HEPES 5 (pH=7.2 con KOH) . En la Figura 3, se comprueba que la infección con el virus que codifica DECA-11 es capaz e aumentar significativamente la densidad de la iNa y la Iki registradas en cardiomiocitos humanos derivados de iPSC. En esta figura, cada punto representa la media±EEM de "n" experimentos/ cardiomiocitos obtenidos de al menos 3 placas de cultivo diferentes. * P<0.05 frente a cardiomiocitos infectados con Ad-td-Tomato. ANOVA de una vía seguida de Tukey test. En pacientes con IC aumenta el componente sostenido de la INa denominado INaL. Este aumento produce un incremento de las concentraciones intracelulares de Na+ lo que, a su vez, altera el manejo del Ca2+ intracelular y prolonga la duración de los potenciales de acción provocando efectos proarrítmicos. Por ello, quisimos ver si DECA-11 modificaba la INaL. Para ello, en cardiomiocitos humanos derivados de iPSC se aplicaron pulsos de 500 ms de duración desde -120 hasta -45 mV y se registró la INa y la INaL utilizando las soluciones "externa" e "interna" que se acaban de describir. La INaL se describe como el componente de la corriente sostenida que es sensible a tetrodotoxina (TTX) (10 ^M) y para cuantificarla se midió como porcentaje del pico de corriente (%) . En la Figura 4 se muestra que DECA-11 no aumenta la INaL. Todos los datos presentados hasta el momento demuestran que SEQ ID NO: 3 es capaz de aumentar la densidad de la INa y la Iki en sistemas de expresión heterólogos y en cardiomiocitos humanos sin modificar la de la INaL. Ejemplo 3. Efecto protranscripcional de DECA-11 Para estudiar el efecto protranscripcional, se sembraron células HEK-293 en placas de 96 pocillos y se transfectaron con 300 ng de vectores LightSwitch-Prom luciferase que codificaban el promotor mínimo humano («1000 pares de bases) de los genes SCN5A o KCNJ2 (Active Motif) y se cotransfectaban o no con el vector que contenía el ADNc del péptido 15-25 (SEQ ID NO: 5) . 48 h tras la transfección, se realizaron los ensayos de luciferasa utilizando el reactivo LightSwitch Luciferase Assay, también de Active Motif, y un luminómetro Berthold. Todos los ensayos se realizaron por triplicado y cada punto representa la media de cada triplicado técnico. Se comprobó que el péptido descrito en SEQ ID NO: 3 no ejerce un efecto significativo sobre el promotor mínimo del gen SCN5A humano (Figura 5) , sin embargo, sí ejerce un efecto protranscripcional sobre el promotor mínimo del gen KCNJ2 humano, lo que implica que aumenta la expresión de los canales Kir2.1. Ejemplo 4. Ensayos en modelo murino de IC Se utilizó un modelo murino de IC con fracción de eyección reducida (ICfeR) para analizar el efecto de SEQ ID NO: 3 sobre la disminución de la iNa y la Iki producida por el remodelado eléctrico asociado a la IC. Se trata de ratones a los que se les provoca una coartación aórtica transversa mediante ligadura (Transverse aortic constriction, TAC) ; la sobrecarga de presión provoca la aparición de hipertrofia cardiaca e IC. Los ratones fueron generados en el Centro de Investigación Médica de la Universidad de Navarra (CIMA) , bajo la dirección de la Dra. Aránzazu González Miqueo. Se utilizaron ratones de 8 semanas de edad a los que se administraron 3.5*1010 partículas de virus adenoasociados tipo 9 que codificaban o bien el reportero fluorescente td-Tomato (Aav-dt-T) sólo, o bien, el reportero y el péptido DECA-11. A las 12 semanas de edad se realizó un control ecocardiográfico (basal) y en la semana 13 se les practicó una cirugía en la que se les ligaba la aorta (animales TAC) o no (animales Sham) . En la parte superior de la Figura 6 se muestra cada uno de los procedimientos a los que fueron sometidos los animales en función de su edad (en semanas) ; en la parte inferior se muestran los cuatro grupos de animales sometidos a cirugía con ligadura (TAC) o no (Sham) . En la semana 19 de vida se les practicó un nuevo control ecocardiográfico (ECO) que demostraba que los animales TAC presentaban ICfeR, tal y como se esperaba. Esa misma semana se enviaron al animalario de la UCM. A continuación, los ratones fueron heparinizados y anestesiados y luego sacrificados por dislocación cervical, a razón de uno por día, practicándose una toracotomía para extraer el corazón que fue montado a través de la aorta en una cánula conectada a un aparato de Langerdorff para la disociación enzimática de los miocitos cardíacos. Tras la extracción del corazón, éste se canulaba a través de la aorta y se colocaba en un aparato de Langerdorff. En primer lugar, se perfundían los corazones con una solución de Tyrode modificada (composición en mM: NaCl 136, KCl 4, MgCh 2, CaCl21.8, HEPES 10, glucosa 10, Ac. pirúvico 3 y tiamina 0.1, pH=7.4 con NaOH) burbujeada con oxígeno y a 37° C durante 3-5 minutos. Posteriormente, se perfundían otros 8 minutos con la misma solución que no contenía CaCE Transcurridos 1 o 2 minutos, el corazón deja de latir. A continuación, se perfundían con la solución de Tyrode sin CaCl2 suplementada con 120 u/mL de colagenasa tipo II de Worthington y 0.5 u/mL de proteasa XIV de Sigma. Por último, los corazones eran perfundidos con una solución denominada de la iguiente composición (mM) : KCl 25, KH2 PO410, MgCl2 2, EGTA-K 0.5, HEPES-K 5, ac. glutámico 100, ac. aspártico 10, taurina 20, creatina 5 y glucosa 10 (pH=7.2 con KOH) . Transcurrido todo este proceso, se descolgaba el corazón de la cánula y se agitaba en alíquotas de solución K donde se iban disgregando los miocitos que se almacenaban en la nevera durante al menos una hora antes de comenzar los registros electrofisiológicos. En la Figura 7 se muestra la capacitancia (pF) de los miocitos cardiacos disociados de los cuatro grupos de ratones (12 en total) . La capacitancia es una medida indirecta y fiable del tamaño de las células. Como se puede observar, no había diferencias significativas en la capacitancia de los miocitos de los animales Sham, hubieran sido éstos infectados con Ad-td-Tomato (control) o con Aav-DECA-11. Por el contrario, la capacitancia de los cardiomiocitos de los animales sometidos al procedimiento TAC resultó significativamente mayor (P<0.05) que la de los animales Sham control y DECA-11. Este resultado concuerda con lo esperado, puesto que los animales TAC presentan hipertrofia cardiaca y, por tanto, el tamaño de sus cardiomiocitos es mayor que el de los de corazones normales. La capacitancia de los miocitos de los animales TAC tratados con DECA-11 resultó ser significativamente menor que la de los animales TAC no tratados lo que indica que la administración de DECA-11 previene la aparición de hipertrofia de los cardiomiocitos asociada a la ICfeR. Para registrar la INa en cardiomiocitos de ratón, la composición de la solución externa fue (mM) : NaCl 4, MgCb 1, CaCh 1, CdCb 0.1, CsCl 133.5, HEPES 2 0 y glucosa 11 (pH=7.35 con CsOH) y la que rellenaba la micropipeta de registro (mM) : NaF 10, CsF 110, CsCl 20, HEPES 10 y EGTA 10 (pH 7.35 con CsOH) . El resto de protocolos y condiciones eran iguales a los utilizados para el registro de la INa en cardiomiocitos humanos derivados de iPSC (según el Ejemplo 2.3) . Como se muestra en la Figura 9, en animales con ICfeR, y como consecuencia del remodelado eléctrico, la densidad de la INa registrada en cardiomiocitos de ratones TAC control fue significativamente menor a la de los ratones Sham control. El pretratamiento con DECA-11 aumentó la densidad de la INa de los cardiomiocitos de los animales Sham y, más importante, aumentó de forma significativa y marcada la densidad de la INa de los cardiomiocitos TAC. Este resultado demuestra que la administración de DECA-11 previene la isminución de la densidad de la iNa producida por la ICfeR en un modelo murino. Como ya se ha indicado, en los cardiomiocitos de ratones de los cuatro grupos también se registró la Ik1. Para ello, la composición de la solución externa era (mM) : NaCl 140, MgCl21, CaCl21, KCl 4, HEPES 10, 4-aminopiridina 2, nifedipino (1 M) , atropina (0.1 M) , glibenclamida (10 M) y glucosa 10, (pH= 7.35 con NaOH) y la de la interna (mM) : K-aspartato 80, KCl 50, KH2PO4 10, MgATP 3, HEPES 10, EGTA 5 (pH=7.25 con KOH) . Como consecuencia del remodelado eléctrico asociado a la ICfeR producida por la constricción transversal de la aorta, la densidad de la Iki fue significativamente menor en los cardiomiocitos de los animales TAC control que en la de los Sham control (Figuras 9A y 9B) . Tanto en animales Sham como en animales TAC la administración de DECA-11 aumenta significativamente la Iki. De hecho, la densidad de la Iki en los animales TAC pretratados con DECA-11 no es diferente de la que se registra en animales Sham. Estos resultados demuestran que la administración de DECA-11 previene la disminución de la densidad de la Iki producida por la ICfeR en un modelo murino.
Publicaciones:
ES2953301 (10/11/2023) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 25/09/2023 se realizó Registro Instancia de Solicitud
En fecha 25/09/2023 se realizó Admisión a Trámite
En fecha 25/09/2023 se realizó Aceptación Tramitación CAP
En fecha 25/09/2023 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 06/10/2023 se realizó Superado examen de oficio
En fecha 27/10/2023 se realizó Realizado IET
En fecha 31/10/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 10/11/2023 se realizó Publicación Solicitud
En fecha 10/11/2023 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 23/11/2023 se realizó PETEX_Petición de examen sustantivo
En fecha 26/02/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
25/09/2023 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 08/05/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por Péptido para el tratamiento de enfermedades cardiacas con el número P202330798
El registro de patente nacional por Péptido para el tratamiento de enfermedades cardiacas con el número P202330798 fue solicitada el 25/09/2023. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro Péptido para el tratamiento de enfermedades cardiacas con el número P202330798 fue solicitada por UNIVERSIDAD COMPLUTENSE DE MADRID. El registro [modality] por Péptido para el tratamiento de enfermedades cardiacas con el número P202330798 está clasificado como C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por Péptido para el tratamiento de enfermedades cardiacas con el número P202330798 está clasificado con la clasificación C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09 por lo que si se desea conocer más registros con la clasificación C07K 7/06,C07K 14/47,A61K 38/08,A61P 9/06,C12N 15/09 clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por Péptido para el tratamiento de enfermedades cardiacas. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C07
Es posible conocer todas las patentes registradas en la clase C07 (QUIMICA ORGANICA) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C07K
Es posible conocer todas las patentes registradas en la clase C07K (PEPTIDOS) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A
Es posible conocer todas las patentes registradas en la clase A (NECESIDADES CORRIENTES DE LA VIDA) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61
Es posible conocer todas las patentes registradas en la clase A61 (CIENCIAS MEDICAS O VETERINARIAS; HIGIENE) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61K
Es posible conocer todas las patentes registradas en la clase A61K (PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO ) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase A61P
Es posible conocer todas las patentes registradas en la clase A61P (ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12
Es posible conocer todas las patentes registradas en la clase C12 (BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUT) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12N
Es posible conocer todas las patentes registradas en la clase C12N (MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN;CULTURE OU CONSERVATION DE MICRO-ORGANISM) entre las que se encuentra la patente Péptido para el tratamiento de enfermedades cardiacas con el número P202330798. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202330787
P202330787