- Home /
- Publicaciones de patentes /
- CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN
Patente nacional por "CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN"
Este registro ha sido solicitado por
Persona física
a través del representanteSÉNIDA REMEDIOS CUETO PRIEDE
Contacto
- Estado: A punto de caducar
- País:
- España
- Fecha solicitud:
- 27/05/2022
- Número solicitud:
-
P202230456
- Número publicación:
-
ES2957008
- Fecha de concesión:
-
- Inventores:
-
Persona física
- Datos del titular:
-
Persona física
- Datos del representante:
-
Sénida Remedios Cueto Priede
- Clasificación Internacional de Patentes:
- C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865
- Clasificación Internacional de Patentes de la publicación:
- C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865
- Fecha de vencimiento:
Quiero registrar una patente
Reivindicaciones:
+ ES-2957008_A11. Un método de obtención de una cepa mejorada de Saccharomyces cerevisiae con propiedades vinícolas optimizadas que comprende las siguientes etapas: a) crecer una cepa inicial de S. cerevisiae en un medio de cultivo con una concentración de 2-aminoetil-L-cisteína de 10 mg/l a 90 mg/l de medio de cultivo durante al menos 5 semanas y b) aislar mutantes individuales de la cepa de S. cerevisiae con propiedades vinícolas optimizadas el tiempo de la etapa a) . 2. El método según la reivindicación anterior, donde el periodo de tiempo necesario es 6 semanas, más preferentemente al menos 7 semanas, aún más preferentemente al menos 8 semanas, aún más preferentemente al menos 9 semanas, aún más preferentemente al menos 10 semanas. 3. El método según una de las reivindicaciones 1 o 2, donde la cantidad de 2-aminoetil-L-cisteína es de entre 13 mg/l y 85 mg/l, más preferentemente entre 15 mg/l y 80 mg/l, aún más preferentemente entre 20 mg/l y 65 mg/l, aún más preferentemente entre 30 mg/l y 40 mg/l. 4. El método según una cualquiera de las reivindicaciones anteriores, donde el periodo de tiempo necesario está comprendido entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l. 5. El método según una cualquiera de las reivindicaciones anteriores, donde el cultivo es continuo o discontinuo. 6. El método según la reivindicación anterior, en el que cuando el cultivo es discontinuo se inocula una fracción de dicho cultivo en un cultivo nuevo con medio y 2-aminoetil-L-cisteína nuevos cuando la DO (600nm) del cultivo anterior ha alcanzado una densidad óptica DO (600nm) superior a 4. 7. El método según una cualquiera de las reivindicaciones anteriores, donde la temperatura de crecimiento del cultivo es de entre 10°C y 60°C, preferentemente entre 15°C y 50°C, más preferentemente entre 20°C y 40°C y aún más preferentemente entre 25°C y 35°C 8. El método según una cualquiera de las reivindicaciones anteriores, donde el cultivo está a una agitación entre 10 y 400 rpm, preferentemente entre 50 y 300 rpm, más preferentemente entre 100 y 250 rpm, más preferentemente entre 150 y 220 rpm, y aún más preferentemente entre 160 y 200 rpm. 9. El método según una cualquiera de las reivindicaciones anteriores, donde el medio de cultivo se selecciona entre, SD, SC sin lisina, mosto sintético sin lisina, o medio mínimo sin aminoácidos. 10. El método según una cualquiera de las reivindicaciones anteriores, donde la etapa b) se realiza mediante goteo de diluciones seriadas en placas de medio selectivo con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. 11. El método según una cualquiera de las reivindicaciones anteriores, donde propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 12. El método según la reivindicación anterior, donde propiedades vinícolas optimizadas se refiere a mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 13. El método según la reivindicación 11, donde propiedades vinícolas optimizadas se refiere a mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 14. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de glicerol de la cepa con propiedades vinícolas optimizadas en comparación con la epa inicial de la cual proviene es de al menos un 10% (p/v) más, preferentemente al menos un 20% (p/v) más cuando se realiza un proceso de vinificación de mosto de uva. 15. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de etanol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos 0, 5% (v/v) menos, preferentemente un 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. 16. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de ácido acético de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos 0, 5% (p/v) menos, preferentemente un 2% (p/v) menos, más preferentemente al menos un 5% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. 17. El método según una cualquiera de las reivindicaciones anteriores, donde la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. 18. El método según la reivindicación anterior, donde la (s) mutación (es) en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. 19. El método según una cualquiera de las reivindicaciones anteriores, donde la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21. 20. El método según la reivindicación anterior, donde la (s) mutación (es) en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. 21. El método según una cualquiera de las reivindicaciones anteriores 17 a 20, donde la mutación es heterocigota u homocigota. 22. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas obtenida según el método definido en una de las reivindicaciones 1 a 21. 23. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior que presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. 24. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior donde la (s) mutación (es) en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. 25. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con cualquiera de las reivindicaciones 21 a 23, que presenta una o más mutaciones en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21. 26. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior donde la (s) mutación (es) en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. 27. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con cualquiera de las reivindicaciones 21 a 26, donde la mutación es heterocigota u homocigota. 28. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. 29. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. 30. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. 31. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. 32. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. 33. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. 34. Uso de la cepa definida en una de las reivindicaciones 22 a 33 y/o obtenida según el método definido en una de las reivindicaciones 1 a 21 para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. 35. Uso según la reivindicación anterior donde la fermentación alcohólica se selecciona entre: - vinificación del mosto de uva para obtener vino, champagne, cava, y/o vermut, - fermentación de malta para la obtención de cerveza, - fermentación de manzana para la obtención de sidra y/o -fermentación de uno o varios sustratos vegetales para dar lugar a aguardientes, preferentemente para la vinificación del mosto de uva. 36. Uso según la realización anterior, donde la uva se selecciona entre uvas tintas y/o uvas blancas.
Los productos y servicios protegidos por este registro son:
C12N 1/18 - C12N 1/38 - C12N 15/01 - C12G 1/02 - C12G 3/02 - C12R 1/865
Descripciones:
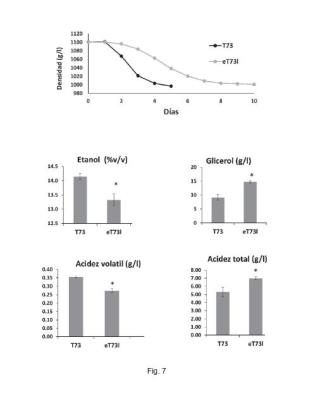
+ ES-2957008_A1 En la presente memoria "cepas mutantes" y "cepas mejoradas" son sinónimos y se emplean de forma intercambiable. En la presente memoria "AEC", "2AEC", "2-AEC", "2-aminoetil-L-cisteína" y "clorhidrato de S- (2-Aminoetil) -L-cisteína" son sinónimos y se emplean de forma intercambiable y se refieren a un análogo tóxico del aminoácido lisina En la presente memoria "vinificación" y "fermentación alcohólica del mosto de uva" son sinónimos y se usan de forma intercambiable. En la presente memoria "evolución dirigida" y "evolución adaptativa" son sinónimos y se usan de forma intercambiable. El objeto de la presente invención se refiere a un método de obtención de una cepa mejorada de Saccharomyces cerevisiae con propiedades vinícolas optimizadas que comprende las siguientes etapas: a) Crecer una cepa inicial de S. cerevisiae en un medio de cultivo con una concentración de 2-aminoetil-L-cisteína de 10 mg/l a 90 mg/l de medio de cultivo durante al menos 5 semanas. b) aislar mutantes individuales de la cepa mejorada de S. cerevisiae con propiedades vinícolas optimizadas transcurrido el tiempo de la etapa a) . En una realización particular preferida el periodo de tiempo necesario es de al menos 6 semanas, más preferentemente al menos 7 semanas, aún más preferentemente al menos 8 semanas, aún más preferentemente al menos 9 semanas, aún más preferentemente al menos 10 semanas. En una realización particular el periodo de tiempo necesario está comprendido entre 6 y 40 semanas, preferentemente, entre 7 y 35 semanas, más preferentemente entre 8 y 30 semanas, aún más preferentemente entre 9 y 25 semanas y aún más preferentemente entre 10 y 20 semanas. En otra realización particular, la cantidad de 2-aminoetil-L-cisteína es de entre 10 mg/l y 90 mg/l de medio de cultivo, preferentemente entre 13 mg/l y 85 mg/l, más preferentemente entre 15 mg/l y 80 mg/l, aún más preferentemente entre 20 mg/l y 65 mg/l, aún más preferentemente entre 30 mg/l y 40 mg/l. Las concentraciones de 2-aminoetil-L-cisteína indicadas en el párrafo anterior son equivalentes a entre 50 M y 449 M, preferentemente entre 65 M y 424 M, más preferentemente entre 75 M y 399 M, aún más preferentemente entre 100 M y 324 M, aún más preferentemente entre 150 M y 200 M. En otra realización particular el periodo de tiempo necesario está comprendido entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l de medio de cultivo. Previamente a la etapa a) se puede crecer una colonia de la cepa inicial en un precultivo sin 2-AEC El método de la invención puede realizarse tanto en un cultivo continuo como discontinuo (en batch) La ventaja de un cultivo discontinuo o (en batch) es que se crean cuellos de botella poblacionales que pueden favorecer ciertas mutaciones específicas. En una realización particular, cuando el cultivo es discontinuo y cuando la DO (600nm) del cultivo anterior ha alcanzado la fase estacionaria, esto es una densidad óptica DO (600nm) superior a 4 se inocula una fracción de dicho cultivo en un cultivo nuevo con medio de cultivo y 2-aminoetil-L-cisteína nuevos. Cuando el método de la invención se realiza en un cultivo discontinuo, es necesario medir la densidad óptica (DO (600nm) ) . Cuando la misma exceda el valor de 4, preferentemente 4, 5, más preferentemente 5, lo que implica que el cultivo está en fase estacionaria, se (re) inocula una fracción de dicho cultivo un nuevo cultivo de forma que a densidad DO (600nm) inicial del nuevo cultivo sea entre 0.05 y 0.2, preferentemente, 0.08 y 0.15, para iniciar un nuevo ciclo. Esto ocurre cada 2 o 3 días aproximadamente. En un periodo de 5 semanas habrá que realizar entre 14 y 15 reinoculaciones o pases. Al nuevo cultivo habrá que añadir también la misma o diferente concentración de 2AEC que se estaba empleando, por ejemplo, entre de entre 10 mg/l y 90 mg/l. La determinación del número de generaciones se realizó a partir de los datos obtenidos de la densidad óptica (600nm) de cada uno de los pases realizados, cuando el método de la invención se realiza en un cultivo discontinuo. - RATIO = (DO600 final) / (DO600 inicial) - Generaciones = log2 (RATIO) - Generaciones acumuladas = sumatorio generaciones en cada pase EL método de cálculo de las generaciones se ha obtenido a partir del siguiente documento: Xu, X., Williams, T. C., Divne, C., Pretorius, I. S., Paulsen, I. T. (2019) . Evolutionar y engineering in Saccharomyces cerevisiae reveals a TRK1-dependent potassium influx mechanism for propionic acid tolerance. Biotechnol Biofuels 12, 97 (2019) . https://doi. org/10.1186/s13068-019-1427-6 Un periodo de 5 semanas es el periodo de tiempo necesario para completar aproximadamente al menos 75 generaciones de dicha cepa inicial. En una realización particular el periodo de tiempo necesario es de al menos 80 generaciones, más preferentemente al menos 90 generaciones, aún más preferentemente al menos 100 generaciones, aún más preferentemente al menos 120 generaciones, aún más preferentemente al menos 130 generaciones, aún más preferentemente al menos 140 generaciones, aún más preferentemente al menos 150 generaciones. En una realización particular el periodo de tiempo máximo necesario es de al menos 300 generaciones, más preferentemente al menos 250 generaciones, aún más preferentemente al menos 220 generaciones, aún más preferentemente al menos 200 generaciones, aún más preferentemente al menos 180 generaciones, aún más preferentemente al menos 170 generaciones, aún más preferentemente al menos 160 generaciones. En otra realización particular el periodo de tiempo necesario está comprendido entre al menos 120 generaciones y 180 generaciones, esto es entre 8 semanas y 12 semanas. Las condiciones ambientales del método de la invención son las mismas que las empleadas en cultivos de crecimiento de cepas de S. cerevisiae que son las habituales en el estado de la técnica y un experto en la materia sabría encontrar las condiciones idóneas. La temperatura de crecimiento puede ser entre 10°C y 60°C, preferentemente entre 15°C y 50°C, más preferentemente entre 20°C y 40°C y aún más preferentemente entre 25°C y 35°C. La agitación del cultivo discontinuo, puede ser entre 10 y 400 revoluciones por minuto (rpm) , preferentemente entre 50 y 300 rpm, más preferentemente entre 100 y 250 rpm, más preferentemente entre 150 y 220 rpm, y aún más preferentemente entre 160 y 200 rpm. En un cultivo continuo la agitación es diferente ya que ocurre mediante unas hélices localizadas en el interior del biorreactor, esta agitación puede ser entre 100 y 700 rpm, preferentemente entre 200 y 600 rpm, más preferentemente entre 300 y 500 rpm. A modo de ejemplo, el cultivo de la cepa de S. cerevisiae en contacto con 2-AEC se puede crecer en batch, a una temperatura entre 15°C y 45°C, preferentemente 20°C y 40°C, más preferentemente entre 25°C y 35°C En otra realización particular, donde el medio de cultivo se selecciona entre medio mínimo SD (Synthetic defined) , SC (Synthetic Complete) sin lisina y mosto sintético MS300 sin lisina, o cualquier medio mínimo sin aminoácidos. Un experto en la materia sabría cómo preparar cualquiera de estos medios ya que es una tarea rutinaria en el área. A modo de ejemplo se pueden emplear los medios de cultivo de: Dymond JS. Saccharomyces cerevisiae growth media. Methods Enzymol. 2013;533:191-204. doi:10.1016/B978-0-12-420067-8.00012-X En una realización preferente del método de la invención la cepa de S. cerevisiae se pone en contacto con 2-AEC en un cultivo discontinuo con medio SD a una temperatura entre 25°C y 35°C con una agitación comprendida entre 160 rpm y 200 rpm. Cuando la DO (600nm) exceda el valor de 5 se (re) inocula una fracción de dicho cultivo un nuevo ultivo de forma que la densidad en medio fresco SD a una DO (600nm) inicial sea de 0.1, continuando así durante al menos entre 150 generaciones y 180 generaciones, esto es entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l. Respecto a la etapa b) del método de la invención, al final del proceso de selección se pueden aislar colonias individuales en medio rico no selectivo, por ejemplo, YPD/YEPD (Yeast Extract, Peptone, Dextrose) y se comprobó su tolerancia a 2-AEC mediante goteos de diluciones seriadas en placas de medio selectivo SD con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. En una realización particular de la etapa b) del método de la invención, el aislamiento de mutantes de la cepa mejorada de S. cerevisiae se puede realizar mediante diluciones seriadas y su siembra directamente en placas de medio selectivos SD con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. Las diluciones seriadas se pueden realizar en agua, solución salina o medio SD. Una de las ventajas del método de la invención es la reproducibilidad ya que se han obtenido cepas mejoradas de S. cerevisiae con propiedades vinícolas optimizadas a partir de 3 cepas de levaduras comerciales con un fondo genético diferente. Los mutantes con mayor tolerancia a 2-AEC se utilizaron para realizar fermentaciones a pequeña escala en mosto de uva con el fin de determinar la mejora de la producción de compuestos químicos de interés enológico, esto es, que presenten propiedades vinícolas optimizadas. Propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso de vinificación de mosto de uva. En una realización particular el mosto de uva puede ser natural, sintético y combinaciones de ambos. Las diferencias con respecto al documento de Gasent-Ramírez JM, es que permite generar cepas con propiedades vinícolas mejoradas que no serían óptimas para repostería, ya que las características mencionadas en el párrafo anterior dan lugar a una menor producción de CO2 por desviar el flujo glicolítico a la producción de glicerol. El CO2 gaseoso es esencial en panadería y repostería para que los productos adquieran su textura esponjosa, por lo que las cepas de la presente invención no serían adecuadas en repostería ya que requerirían más tiempo para dar lugar a los productos de repostería que las cepas parentales. El control de la cantidad de ácido acético es importante para las características organolépticas del vino, ya que unos niveles muy elevados de este compuesto lo avinagran, reduciendo así su calidad. El glicerol por el contrario tiene un efecto positivo en la calidad del vino. No es aromático, debido a su naturaleza no volátil, pero contribuye a la densidad, cuerpo, suavidad, y textura de los vinos. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. En una realización particular, la producción de glicerol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 10% (p/v) más, preferentemente al menos un 20% (p/v) más, más preferentemente al menos un 30% (p/v) más, aún más preferentemente al menos un 40% más, aún más preferentemente al menos un 50% (p/v) más, aún más preferentemente al menos un 60% (p/v) más, aún más preferentemente al menos un 70% (p/v) más, aún más preferentemente al menos un 80% (p/v) más, aún más preferentemente al menos un 90% (p/v) más y aún más preferentemente al menos un 100 (p/v) más cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 10% (p/v) más de glicerol que el producto obtenido a partir de un proceso de vinificación del mosto de va con la cepa inicial de la cual proviene, preferentemente al menos un 20% (p/v) más, más preferentemente al menos un 30% (p/v) más, aún más preferentemente al menos un 40% (p/v) más, aún más preferentemente al menos un 50% (p/v) más, aún más preferentemente al menos un 60% (p/v) más, aún más preferentemente al menos un 70% (p/v) más, aún más preferentemente al menos un 80% (p/v) más, aún más preferentemente al menos un 90% (p/v) más y aún más preferentemente al menos un 100% (p/v) más de glicerol. En otra realización particular, la producción de etanol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 0, 5% (v/v) menos, preferentemente al menos 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos, aún más preferentemente al menos un 8% (v/v) menos, aún más preferentemente al menos un 10% (v/v) menos, aún más preferentemente al menos un 15% (v/v) menos, aún más preferentemente al menos un 20% (v/v) menos, aún más preferentemente al menos un 30% (v/v) menos, y aún más preferentemente al menos un 50% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 0, 5% (v/v) menos de etanol que el producto obtenido a partir de un proceso de vinificación del mosto de uva con la cepa inicial de la cual proviene, preferentemente al menos un 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos, aún más preferentemente al menos un 8% (v/v) menos, aún más preferentemente al menos un 10% (v/v) menos, aún más preferentemente al menos un 15% (v/v) menos, aún más preferentemente al menos un 20% (v/v) menos, aún más preferentemente al menos un 30% (v/v) menos, y aún más preferentemente al menos un 50% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. La reducción en la producción de etanol se ha observado en las cepas evolucionadas eM2c y eT73l, que presentan mutaciones homocigotas en RTG2, aunque es de esperar que la mutación en LYS21 en la cepa eT73l también participe, ya que comparten ruta metabólica En otra realización particular, la producción de ácido acético de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 0, 5% (p/v) menos, preferentemente al menos un 2% (p/v) menos, más referentemente al menos un 5% (p/v) menos, aún más preferentemente al menos un 10% (p/v) menos aún más preferentemente al menos un 20% (p/v) menos, aún más preferentemente al menos un 40% (p/v) menos, aún más preferentemente al menos un 50% (p/v) menos, aún más preferentemente al menos un 60% (p/v) menos, aún más preferentemente al menos un 70% (p/v) menos, y aún más preferentemente al menos un 80% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 0, 5% (p/v) menos de ácido acético que el producto obtenido a partir de un proceso de vinificación del mosto de uva con la cepa inicial de la cual proviene, preferentemente al menos un 2% (p/v) menos, más preferentemente al menos un 5% (p/v) menos, aún más preferentemente al menos un 10% (p/v) menos aún más preferentemente al menos un 20% (p/v) menos, aún más preferentemente al menos un 40% (p/v) menos, aún más preferentemente al menos un 50% (p/v) menos, aún más preferentemente al menos un 60% (p/v) menos, aún más preferentemente al menos un 70% (p/v) menos, y aún más preferentemente al menos un 80% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. En otra realización particular la cepa con propiedades vinícolas optimizadas presenta una reducción de al menos un 5% (v/v) en la producción de etanol, una reducción de al menos un 20% (p/v) en la producción de ácido acético y un incremento de al menos un 60% (p/v) en la producción de glicerol en un proceso de vinificación en comparación con la misma cepa sin realizar el método de la invención. En una realización particular del método de la invención la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones no sinónimas en la secuencia de nucleótidos del gen RTG2. Mutaciones no sinónimas son aquellas que modulan la actividad de la proteína codificada por el gen RTG2. En otra realización de la invención la mutación es homocigota o heterocigota En la presente memoria, el gen de RTG2 presenta el código 852640 en GenBank y el código de UniProt de la proteína es P32608. RTG2 es un regulador transcripcional de la ruta de señalización de nutrientes conocida como Respuesta Retrógrada. Dicha ruta favorece la síntesis de aminoácidos como la lisina y glutamina a partir de esqueletos carbonados procedentes del piruvato producido durante la glucólisis. El efecto técnico de las mutaciones en la secuencia de nucleótidos del gen RTG2 es que reducen etanol y ácido acético y aumentan glicerol cuando las cepas de Saccharomyces cerevisiae realizan la fermentación del vino, esto es, presentan propiedades vinícolas optimizadas. En otra realización particular las mutaciones en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. En otra realización del método de la invención la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones no sinónimas en la secuencia de nucleótidos de los genes de la homocitrato sintasa LYS20 y LYS21. En la presente memoria, el gen de LYS20 presenta el código 851346 en GenBank y el código de UniProt de la proteína es P48570. En la presente memoria, el gen de LYS21 presenta el código 851425 en GenBank y el código de UniProt de la proteína es Q12122. Lys20 y su parálogo Lys21 forman la homocitrato sintasa, que cataliza la condensación de a-cetoglutarato y acetil-CoA para dar homocitrato, el primer paso de la síntesis de lisina. Esta mutación podría conllevar una enzima hiperactivada o insensible a retroinhibición que desviase el flujo metabólico desde el piruvato hacia la producción del aminoácido lisina reduciendo el piruvato y por tanto el flujo glicolítico, favoreciendo la producción de glicerol y también consumiendo acetil-CoA y por tanto disminuyendo el ácido acético. RTG2 controla a LYS20 y LYS21 y más genes LYS, de manera que cuantas más mutaciones activadoras haya, la ruta estará más activa favoreciendo la producción de glicerol y disminuyendo el ácido acético. Mutaciones no sinónimas son aquellas que modulan la actividad de las proteínas codificadas por los genes LYS20 y LYS21. En otra realización de la invención la mutación es homocigota o heterocigota. En otra realización particular las mutaciones en la secuencia de nucleótidos de los genes LYS20 y LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. El efecto técnico de las mutaciones en LYS21, RTG2 y LYS20, además de la obtención de propiedades vinícolas optimizadas es la activación del metabolismo de lisina y aumentar la tolerancia a AEC. En otra realización particular las cepas obtenidas por el método de la invención presentan un incremento en el nivel de expresión de los genes CIT2 y DLD3 con respecto a la cepa inicial en condiciones de crecimiento exponencial en medio completo y rico en nutrientes, lo que indica que la respuesta retrógrada está activada En la presente memoria, el gen de CIT2 presenta el código 850361 en GenBank y el código de UniProt de la proteína es P08679. En la presente memoria, el gen de DLD3 presenta el código 856638 en GenBank y el código de UniProt de la proteína es P39976. Otro objeto adicional de la invención se refiere al uso de uno o más de los alelos mutantes en RTG2, LYS20 y LYS21 como marcadores para detectar una cepa con propiedades vinícolas optimizadas por el método de la invención anteriormente descrito. Otro objeto adicional de la invención se refiere al uso de uno o más de los alelos mutantes en RTG2, LYS20 y LYS21 como herramientas para la mejora de las propiedades vinícolas de cualquier levadura de la especie S. cerevisae en la que se introduzcan. En una realización particular los alelos mutantes de RTG2 seleccionados entre uno o más de R30C; G248E y R560I En otra realización particular el alelo mutante de LYS20 es N379D. En otra realización particular el alelo mutante de LYS21 es R390G. Un objeto adicional de la presente invención se refiere a una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas obtenida por el método descrito anteriormente. Propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: mayor producción de glicerol, menor producción de ácido acético, y menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso posterior de vinificación de mosto de uva. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. En otra realización particular, la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. En otra realización particular, las mutaciones en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. En otra realización particular, la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen los genes de la homocitrato sintasa LYS20 y LYS21. En otra realización particular, la mutación es homocigota o heterocigota. En otra realización particular las mutaciones en la secuencia de nucleótidos de los genes LYS20 y LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes erivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13204. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13204" y "eM2c" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13204, u obtenidas de CECT13204, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13204. Preferiblemente, el mutante derivado de CECT13204 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13204 en condiciones iguales. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13205. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13205" y "eT73l" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13205, u obtenidas de CECT13205, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13205. Preferiblemente, el mutante derivado de CECT13205 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13205 en condiciones iguales. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13206. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13206" y "eEC1118º" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13206, u obtenidas de CECT13206, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13206. Preferiblemente, el mutante derivado de CECT13206 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13206 en condiciones iguales. Las propiedades vinícolas optimizadas de las cepas CECT13204, CECT13205 y CECT13206 se refieren a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso de vinificación de mosto de uva. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. Un objeto adicional de la invención se refiere al uso de una o varias cepas definidas anteriormente y/o obtenidas según el método definido anteriormente para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. En una realización particular, es el uso de una o más de las cepas CECT13204, CECT13205 y CECT13206 para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. En una realización particular se puede usar para la vinificación del mosto de uva para obtener vino, champagne, cava, vermut, fermentación de malta para la obtención de cerveza, fermentación de manzana para obtener sidra, hidromiel, fermentación de uno o varios sustratos vegetales para dar lugar a aguardientes, a modo de ejemplo: whisky, ron, pacharán, brandy (coñac, armañac, brandy de jerez, pisco) , tequila, vodka, orujo o sake. Preferentemente para la vinificación del mosto de uva. En otra realización particular la variedad de uva se selecciona entre uvas tintas y/o uvas blancas. En otra realización particular la variedad de uva se selecciona de una o más del grupo de uvas tintas consistente en: Abouriou, Acolon, Agiorgitiko, Aglianico, Alexandrouli, Alfrocheiro preto, Alicante bouschet, Alicante bouschet, Alvarelháo, Ancellotta, Bábeascá neagrá, Barbera, Bastardo, Blauer portugieser, Blaufránkisch, Bobal, Bonarda, Bondola, Bovale, Brachetto, Bual, Cabernet franc, Cabernet sauvignon, Caíño tinto, Canaiolo, Cariñena, Carménére, Carnelian, Charbono, Cinsaut, Corvina, Croatina, Darkenusa, Dobricic, Dolcetto, Dornfelder, Durif, Feteascá neagrá, Freisa, Gamay, Garnacha, Graciano, Gropello, Grignolino, Hondarrabi beltza, Kadarka, Kratosija, Lagrein, Lambrusco, Listán negro, Malbec, Malvasía di Schierano, Malvasía negra, Mammolino, Mandilaria, Marattiko, Marzemino, Mavro, Mavrodafni, Mavrud, Mencía, Merlot, Millot, Misión, Molinara, Mónica, Montepulciano, Moscatel de Hamburgo, Monastrell, Mujuretuli, Nebbiolo, Négrette, Negroamaro, Nero d'Avola, Okuzgozu, Ojaleshi, Oseleta, Petit verdot, Picapoll negro, Prieto picudo, Pinot meunier, Pinot noir, Piruleta, Pinotage, Plavac mali, Poulsard, Quebranta, Refosco, Rondinella, Rotberger, Ruby cabernet, Rubired, Ruché, Rufete, Sagrantino, Sangiovese, Saperavi, Schiava, Syrah, Sousón, St. Laurent, Tannat, Tarrango, Tempranillo, Teroldego, Terret noir, Tinta barroca, Tinta cáo, Touriga franca, Touriga nacional, Valdiguié, Vranac, Xinómavro, Zinfandel, Zweigelt, Valdepeñas, En otra realización particular la variedad de uva se selecciona de una o más del grupo de uvas blancas consistente en: Alarije, Albalonga, Albana, Albariño, Albillo, Aledo, Aligoté, Altesse, Arinto, Arneis, Assyrtiko, Auxerrois blanc, Bogdanusa, Bacchus, Bical, Bouvier, Boal, Catarratto, Chardonnay, Centennia, Chasselas, Chenin blanc, Clairette, Colombard, Córtese, Courbu, Crouchen, Cserszegi füszeres, Doradillo, Erbaluce, Ehrenfelser, Ezerjó, Faber, Falanghina, Feteascá alba, Feteascá regalá, Fiano, Flora, Folle blanche, Freisamer, Fromenteau, Furmint, Garganega, Garnacha blanca, Garnacha gris, Gewürztraminer, Glera, Gloria, Godello, Goldriesling, Grollam noir, Grüner veltliner, Hárslevelü, Hondarrabi zuri, Humagne blanche, Huxelrebe, Irsai olivér, Izsáki sarfehér, Jacquére, Pardina, Juhfark, Kerner, Krstac, Len de l'el, Loureira, Macabeo, Madeleine angevine, Malvar, Malvasía, Petit manseng, Gros manseng, Maria gomes, Marsanne, Mauzac, Melón de Borgoña, Merseguera, Moscatel de Alejandría, Moscatel de grano menudo, Muscat ottonel, Moscato giallo, Moschofilero, Mtsvane, Sauvignon vert, Müller-thurgau, Neuburger, Ondenc, Ortega, Pare, Palomino, Parellada, Pecorino, Petite arvine, Pedro Giménez, Pedro ximénez, Pinot blanc, Pinot grigio, Piquepoul blanc, Rabigato, Reichensteiner, Rhoditis, Riesling, Rieslaner, Rkatsiteli, Rotgipfler, Roussanne, Sauvignon blanc, Sauvignon gris, Savagnin blanc, Savagnin rosé, Savatiano, Scheurebe, Schonburger, Sémillon, Septiner, Cerceal, Siegerrebe, Sylvaner, Smederevka, Zierfandler, Sultanina, Symphony, Taminga, Tempranillo blanco, Torrontés, Trebbiano, Treixadura, Gray riesling, Verdejo, Verdia, Verdicchio, Verduzzo friulano, Verduzzo trevigiano, Vermentino, Vernaccia, Viognier, Macabeo, Welschriesling, Würzer, Xarello, Xynisteri, Zéta, Zeusz, Moscatel, Cardinal, Napoleón, Corinto, Noah, Isabella, Ivy, Concord, Niagara, Gewurstraminer, Zalema, Albarín y Viura En una realización preferente la uva es de la variedad bobal, Breve descripción de las figuras Fig. 1. Tolerancia de las cepas evolucionadas a AEC. Goteos de diluciones seriadas de un factor de magnitud en cada paso realizadas en SD de las cepas parentales M2, T73 y EC1118 junto con mutantes seleccionados obtenidos a partir de evolución adaptativa eM2c. eT73l y eEC1118º. Gotas de 5 microlitros de cada dilución se depositan ordenadamente en una placa de medio mínimo (SD, izquierda) y SD con 35 mg/l 2-aminoetil-L-cisteina (2-AEC) , derecha. Fig. 2. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa M2 A) Curva de consumo de azúcares reductores de las cepas evolucionadas más de 150 generaciones a partir de M2, durante el proceso de fermentación en condiciones de vinificación en mosto de la variedad bobal. Cambios en la producción de etanol, glicerol y ácido acético en el mosto una vez fermentado respecto al mosto fermentado por la cepa sin evolucionar B) -D) respectivamente. Se muestran los valores promedios y las desviaciones típicas. Los experimentos se realizaron por triplicado. * p<0.05, test t-student, 2 colas. Fig. 3. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa T73. Condiciones como en la Figura 2. Fig. 4. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa EC1118. Condiciones como en la Figura 2. Fig. 5. Análisis de la respuesta retrógrada. Análisis de la expresión de los genes marcadores CIT2 y DLD3 de respuesta retrógrada en mutantes seleccionados y las epas iniciales. M2 izquierda (cepa inicial, izda vs cepa mejorada, dcha) , EC1118, centro (cepa inicial, izda vs cepa mejorada, dcha) y T73 derecha (cepa inicial, izda vs cepa mejorada, dcha) . Las células se crecieron en fase exponencial en medio rico YPD. Normalización respecto del gen de la actina ACT1. Fig. 6. Subclonación de alelos mutantes A) Tolerancia a 2-AEC de la cepa vínica haploide C9 rtg2A transformada con los plásmidos centroméricos conteniendo los alelos wt y mutantes de RTG2 indicados. B) Tolerancia a 2-AEC de la cepa vínica haploide C9 lys20A lys21A transformada con los plásmidos centroméricos conteniendo los alelos wt y mutantes de LYS20 y LYS21 indicados. Se realizaron diluciones seriadas de un cultivo estacionario en medio SD y se depositaron gotas de 5 l en placas de SD y SD+AEC conteniendo geneticina para seleccionar las cepas transformadas. Fig. 7. Vinificaciones en bodega experimental Se muestra la evolución de la fermentación de la cepa mejorada eT73l en comparación de su cepa parental T73 siguiendo la evolución densitométrica de la vinificación en 50 litros de mosto tempranillo, así como la producción final de etanol, glicerol, ácido acético (acidez volátil) y la acidez total expresada como ácido tartárico. Se muestran los valores promedios y las desviaciones típicas. Los experimentos se realizaron por triplicado. * p<0.05, test tstudent, 2 colas. Ejemplos Materiales y métodos Evolución adaptativa en presencia del análogo tóxico de la lisina 2-AEC Las distintas cepas industriales de S. cerevisiae M2, T73 y EC1118 se usaron como parentales para tres experimentos de evolución dirigida independientes. A partir de una colonia individual de cada cepa se inoculó un precultivo de 5 mL de medio mínimo SD (Yeast Nitrogen Base 0.17%, 0.5% sulfato amónico, 2% glucosa) y se creció 24h a 30°C. A partir de estos precultivos se inocularon, a una DO (600nm) inicial de 0.1, matraces con 25 mL de SD suplementados con 35 mg/L o 174 M de 2-aminoetil-L-cisteína (AEC) obtenido en Sigma Aldrich (https://www.sigmaaldrich.com/ES/es/product/sigma/a2636) . Estos cultivos se crecieron en batch a 30°C en agitación (180 rpm) , se determinó la DO (600nm) final del cultivo cada 2-3 días y se reinocularon en medio fresco a una DO (600nm) inicial de 0.1. El experimento de evolución adaptativa se continuó hasta completar 29 pases (durante un periodo de unas 10 semanas) , con más de 150 generaciones. Se aislaron mutantes individuales se analizaron respecto a su tolerancia a AEC mediante goteos de diluciones seriadas en placas de medio selectivos. Determinación de las generaciones en el método de evolución dirigida La determinación del número de generaciones se realizó a partir de los datos obtenidos de la densidad óptica (600nm) de cada uno de los pases realizados. - RATIO = (DO600 final) / (DO600 inicial) - Generaciones = log2 (RATIO) - Generaciones acumuladas = sumatorio generaciones Ensayos de tolerancia a AEC Colonias individuales se crecieron a saturación en medio SD durante la noche. Se determinó la densidad óptica del cultivo a 600 nm para igualar los cultivos y se realizaron diluciones seriadas de un orden de magnitud (100 l de cultivo en 900 l de agua estéril) y se depositaron gotas de 5 l en placas de SD y SD+ AEC 35 mg/l. Las placas se incubaron durante dos días a 30° C. Microvinificaciones en mosto natural Para comprobar las mejoras en las propiedades vinícolas de las cepas se realizaron microvinificaciones en mosto. El mosto usado fue tinto de la variedad bobal de la cosecha del 2015. Con el objetivo de evitar la contaminación el mosto una vez descongelado, se añadió dimetil dicarbonato (DMDC) 500 g/L y se dejó actuar durante 24 h en frío. Los experimentos se realizaron a partir de precultivos en YPD líquido procedentes de colonias aisladas de los mutantes y cultivados durante 48 h en un agitador rotativo a 200 rpm. Los mostos se inocularon a una D.O.600 de 0.1. Las vinificaciones se llevaron a cabo en un volumen de 30 ml a 24 °C en agitación suave (50 rpm) en tubos cónicos de centrífuga desechables de 30 ml. Cada 2-3 días se tomaron alícuotas del sobrenadante y se siguió la fermentación siguiendo el consumo de azucares reductores, siguiendo el protocolo de Robyt y Whelan, (1972) con ciertas modificaciones. 100 l de una dilución 1:100 del sobrenadante procedente de la vinificación se mezcló con un volumen del reactivo DNS (ácido dinitro-3, 5-salicílico 0.01 g/ml, NaOH 16 mg/l, tartrato doble Na-K 0.3 g/ml) y se hirvió 5 min a 100 °C. Posteriormente se añadió a cada reacción 1 mL de H2O destilada y se procedió a medir la absorbancia a 540 nm. La concentración de azúcares se determinó mediante interpolación con una recta patrón preparada a partir de una disolución stock de glucosa de 2 g/L. Al final de la vinificación se midieron el resto de metabolitos. La determinación de etanol se realiza mediante cuantificación enzimática utilizando alcohol deshidrogenasa. Para ello, se añade 1 mL de tampón Gly/Tris conteniendo el coenzima oxidado de la reacción (Glicina 0.2 M, Tris-HCl pH 9.7, NAD+ 50 mM) a 200 L de una dilución 1:5000 del sobrenadante procedente del final de la vinificación. Se procede a medir la absorbancia inicial a 340 nm. A continuación, se añaden 20 L de alcohol deshidrogenasa (20 U/mL, aprox.4 mg/l) y se mide la absorbancia de nuevo después de 15 min de incubación. La concentración de etanol se determina por interpolación de la recta patrón preparada a partir de etanol 1.2 mM. El ácido acético y glicerol se determinaron utilizando kits de Megazyme según las instrucciones del fabricante midiéndose en un lector de placas multipocillo Varioskan. qPCR La cantidad de ARN total de levadura se obtuvo mediante rotura mecánica con perlas de vidrio y precipitación selectiva con LiCl, utilizando protocolos habituales en el área. El ARN fue retrotranscrito según las instrucciones del kit NZY First-Strand cDNA Synthesis Kit y se realizó la PCR con oligos de DLD3 y CIT2, usando el gen ACT1 como control en un Quantstudio 3 con el kit NZYSpeedy qPCR Green Master Mix. Los oligonucleótidos utilizados en la PCR para los genes ACT1, CIT2y DLD3 están descritos en el documento Anna N. Starovoytova, Maxim I. Sorokin, Svyatoslav S. Sokolov, Fedor F. Severin, Dmitr y A. Knorre. (2013) Mitochondrial signaling in Saccharomyces cerevisiae pseudohyphae formation induced by butanol, FEMS Yeast Research, 13, 367-374, https://doi.org/10.1111/1567-1364.12039, sección Real-Time PCR Secuenciación de genomas La secuenciación del genoma de los mutantes seleccionados fue llevada a cabo por la empresa Novogene empleando métodos habituales en el área. Resultados Obtención por evolución adaptativa en presencia de AEC de mutantes con un fenotipo compatible con la activación de la Respuesta Retrógrada Se crecieron las cepas M2, EC1118 y T73 en una serie continuada de cultivos en batch en 25 ml de medio de cultivo SD con 35 mg/l de AEC. Se realizaron reinoculaciones cada 2/3 días a partir del cultivo anterior en fase estacionaria para obtener un número elevado de generaciones, aislando colonias individuales a las 150 generaciones. Las colonias individuales se seleccionaron y se analizó su tolerancia a AEC mediante goteo en placa (Figura 1, donde se muestran un mutante representativo de cada fondo genético) . Se seleccionaron los mutantes más prometedores conforme a su tolerancia a 2AEC para analizar su comportamiento en vinificación en mosto natural. La Figura 2 muestra los mutantes procedentes de la cepa M2. Todos los mutantes presentaban una velocidad reducida en el consumo de azúcares (glucosa + fructosa en el caso del mosto de uva) (Fig. 2A) , pero todos completaban la vinificación. Esta velocidad reducida puede asociarse con la mejora del resto de cualidades del producto final, incremento de la cantidad de glicerol y disminución del etanol y del ácido acético entre otras. En cuanto a la producción de metabolitos (Figura 2B-D) , hay una tendencia a una menor producción de etanol por parte de las cepas mejoradas, aunque sólo es significativo en el caso del mutante eM2c donde se observa una reducción de hasta el 20% en la producción de etanol. En cuanto al glicerol (Figura 2C) , los mutantes producen más glicerol durante el proceso de vinificación del mosto de uva, particularmente la cepa eM2c. El efecto sobre el ácido acético es más acusado (Figura 2D) , y aproximadamente la mitad de los mutantes presentan una reducción acusada del ácido acético a menos de un cuarto del que produce la cepa parental. El genotipo de la cepa eM2c es RTG2 R30C/ RTG2 R30C. Realización del método de la invención en la cepa comercial de S. cerevisiae T73 El método de la invención se realizó con la cepa T73 de forma idéntica a como se realizó con la cepa M2, (Figura 3) . Se obtuvieron resultados muy similares: mutantes que completan la fermentación o vinificación de mosto de uva con un ligero retraso respecto a la cepa inicial (Figura 3A) . Todos los mutantes obtenidos de T73 producen más glicerol y menos acético y reducen el etanol al final de la fermentación. Por ejemplo, el mutante eT73l lo reduce en un 16%. El genotipo de la cepa mejorada eT73I es RTG2 G248E/RTG2 G248E, LYS21 R390G/LYS21 R390G. Estos resultados demuestran que el método de la invención es reproducible Realización del método de la invención en la cepa comercial de S. cerevisiae EC1118 El método de la invención se realizó con la cepa EC1118 de forma idéntica a como se realizó con las cepas M2 y T73, (Figura 4) . En EC1118 se aisló el mutante eEC1118º con una elevada producción de glicerol, menor producción de ácido acético eEC1118j tiene un comportamiento similar, pero en menor grado. Ambos mutantes muestran una tendencia en la disminución en la producción de etanol. Los dos mutantes presentan una ralentización del ritmo de fermentación, pero la completan. El genotipo de la cepa eEC1118º es RTG2/RTG2 R560I, LYS20/ LYS20 N379D, es decir, heterozigótico para ambos genes. Estos resultados confirman que el método de la invención es reproducible. Expresión génica Se analizó la expresión por qPCR de los dos genes típicos marcadores de la respuesta retrógrada, CIT2 y DLD3 de los mutantes eM2c, eT73l y eEC1118º junto a sus cepas parentales (Figura 5) . Todos presentaron una inducción de ambos genes respecto a la cepa parental en condiciones de crecimiento exponencial en medio rico, donde la expresión de ambos genes está reprimida, lo que indica una activación de la Respuesta Retrógrada atribuible a su genotipo. En conclusión, el método de la invención proporciona un proceso reproducible de obtención de mutantes tolerantes a AEC con propiedades vinícolas mejoradas que se comportan con un fenotipo compatible con la activación de la respuesta retrógrada y mejoran las características organolépticas del vino. Subclonación de genes de interés Se procedió a determinar si las mutaciones encontradas en las cepas mejoradas son las que causan el fenotipo de resistencia a AEC, mediante subclonación de los alelos mutantes y su análisis fenotípico. Respecto a RTG2, se clonó el alelo de eM2c, RTG2 R30C, y el de eT73l, RTG2 G248E en un plásmido centromérico de copia única pCUP1pNuiHA kanMX CEN. Dichos plásmidos otorgan tolerancia a AEC respecto al plásmido conteniendo la copia silvestre el gen RTG2, al transformar la cepa haploide vínica sin ninguna copia del gen C9 rtg2A (Figura 6A) . Los genes LYS21 y LYS20 son genes parálogos que codifican para la homocitrato sintasa, el primer paso de la biosíntesis de lisina. Fueron amplificados de los mutantes de interés y de sus cepas de origen e introducidos en el plásmido centromérico de copia única pCUP1pNuiHA kanMX CEN y transformado en una cepa vínica haploide C9 lys20A lys21A. Ensayos por goteo en placas con AEC demuestran que los alelos mutantes incrementan la tolerancia a dicho compuesto, demostrando por tanto que dicha mutación es la causante del fenotipo (Figura 6B) . Este hecho es muy claro para el alelo de LYS21 de eT73l, LYS21 R390G, y menos intenso, pero igualmente positivo para el alelo de LYS20 de eEC1118º LYS20 N379D. Experimentos en bodega Se realizaron fermentaciones experimentales con el mutante eT73l y su parental T73 en la bodega experimental del Vitec, Centro Tecnológico del Vino, Falset. El procedimiento es similar a las microvinificaciones, pero adaptado a un volumen mayor. Se utilizaron vinificaciones por triplicado en 50 kg de uva tempranillo. La cepa mutante posee una cinética de vinificación más lenta, medida como evolución de la densidad (Figura 7) , pero completa la fermentación. Al final de la vinificación ha visto reducido el grado alcohólico en 0.8% (v/v) (Esto es una disminución del 6% comparado con la cantidad de etanol de la cepa parental 14, 1%v/v vs 13.3%v/v) , además de reducir la acidez volátil (la medida del ácido acético) . El glicerol ha aumentado un 62% y también ha aumentado la acidez total medida como tartárico. De esta manera se confirma a gran escala los resultados observados en microvinificaciones. La cata de los vinos por parte de un panel experto indicó una ligera mejora en la valoración global del vino producido por la cepa eT73l respecto a T73, de manera que no supone una bajada en la calidad global del producto.
Publicaciones:
ES2957008 (08/01/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 27/05/2022 se realizó Registro Instancia de Solicitud
En fecha 27/05/2022 se realizó Admisión a Trámite
En fecha 27/05/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 21/06/2022 se realizó Superado examen de oficio
En fecha 26/01/2023 se realizó Realizado IET
En fecha 02/02/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 08/01/2024 se realizó Publicación Solicitud
En fecha 08/01/2024 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 05/04/2024 se realizó PETEX_Petición de examen sustantivo
En fecha 05/04/2024 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
En fecha 23/04/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
27/05/2022 - Pago Tasas IET
+ ES-2957008_A11. Un método de obtención de una cepa mejorada de Saccharomyces cerevisiae con propiedades vinícolas optimizadas que comprende las siguientes etapas: a) crecer una cepa inicial de S. cerevisiae en un medio de cultivo con una concentración de 2-aminoetil-L-cisteína de 10 mg/l a 90 mg/l de medio de cultivo durante al menos 5 semanas y b) aislar mutantes individuales de la cepa de S. cerevisiae con propiedades vinícolas optimizadas el tiempo de la etapa a) . 2. El método según la reivindicación anterior, donde el periodo de tiempo necesario es 6 semanas, más preferentemente al menos 7 semanas, aún más preferentemente al menos 8 semanas, aún más preferentemente al menos 9 semanas, aún más preferentemente al menos 10 semanas. 3. El método según una de las reivindicaciones 1 o 2, donde la cantidad de 2-aminoetil-L-cisteína es de entre 13 mg/l y 85 mg/l, más preferentemente entre 15 mg/l y 80 mg/l, aún más preferentemente entre 20 mg/l y 65 mg/l, aún más preferentemente entre 30 mg/l y 40 mg/l. 4. El método según una cualquiera de las reivindicaciones anteriores, donde el periodo de tiempo necesario está comprendido entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l. 5. El método según una cualquiera de las reivindicaciones anteriores, donde el cultivo es continuo o discontinuo. 6. El método según la reivindicación anterior, en el que cuando el cultivo es discontinuo se inocula una fracción de dicho cultivo en un cultivo nuevo con medio y 2-aminoetil-L-cisteína nuevos cuando la DO (600nm) del cultivo anterior ha alcanzado una densidad óptica DO (600nm) superior a 4. 7. El método según una cualquiera de las reivindicaciones anteriores, donde la temperatura de crecimiento del cultivo es de entre 10°C y 60°C, preferentemente entre 15°C y 50°C, más preferentemente entre 20°C y 40°C y aún más preferentemente entre 25°C y 35°C 8. El método según una cualquiera de las reivindicaciones anteriores, donde el cultivo está a una agitación entre 10 y 400 rpm, preferentemente entre 50 y 300 rpm, más preferentemente entre 100 y 250 rpm, más preferentemente entre 150 y 220 rpm, y aún más preferentemente entre 160 y 200 rpm. 9. El método según una cualquiera de las reivindicaciones anteriores, donde el medio de cultivo se selecciona entre, SD, SC sin lisina, mosto sintético sin lisina, o medio mínimo sin aminoácidos. 10. El método según una cualquiera de las reivindicaciones anteriores, donde la etapa b) se realiza mediante goteo de diluciones seriadas en placas de medio selectivo con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. 11. El método según una cualquiera de las reivindicaciones anteriores, donde propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 12. El método según la reivindicación anterior, donde propiedades vinícolas optimizadas se refiere a mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 13. El método según la reivindicación 11, donde propiedades vinícolas optimizadas se refiere a mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial de la cual proviene cuando se realiza un proceso de vinificación de mosto de uva. 14. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de glicerol de la cepa con propiedades vinícolas optimizadas en comparación con la epa inicial de la cual proviene es de al menos un 10% (p/v) más, preferentemente al menos un 20% (p/v) más cuando se realiza un proceso de vinificación de mosto de uva. 15. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de etanol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos 0, 5% (v/v) menos, preferentemente un 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. 16. El método según una cualquiera de las reivindicaciones 11 a 13, donde la producción de ácido acético de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos 0, 5% (p/v) menos, preferentemente un 2% (p/v) menos, más preferentemente al menos un 5% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. 17. El método según una cualquiera de las reivindicaciones anteriores, donde la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. 18. El método según la reivindicación anterior, donde la (s) mutación (es) en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. 19. El método según una cualquiera de las reivindicaciones anteriores, donde la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21. 20. El método según la reivindicación anterior, donde la (s) mutación (es) en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. 21. El método según una cualquiera de las reivindicaciones anteriores 17 a 20, donde la mutación es heterocigota u homocigota. 22. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas obtenida según el método definido en una de las reivindicaciones 1 a 21. 23. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior que presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. 24. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior donde la (s) mutación (es) en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. 25. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con cualquiera de las reivindicaciones 21 a 23, que presenta una o más mutaciones en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21. 26. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con la reivindicación anterior donde la (s) mutación (es) en la secuencia de nucleótidos del gen LYS20 y/o el gen LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. 27. Una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas, de acuerdo con cualquiera de las reivindicaciones 21 a 26, donde la mutación es heterocigota u homocigota. 28. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. 29. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. 30. Una cepa de Saccharomyces cerevisiae obtenida según el método definido en una de las reivindicaciones 1 a 21, depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. 31. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. 32. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. 33. Una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. 34. Uso de la cepa definida en una de las reivindicaciones 22 a 33 y/o obtenida según el método definido en una de las reivindicaciones 1 a 21 para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. 35. Uso según la reivindicación anterior donde la fermentación alcohólica se selecciona entre: - vinificación del mosto de uva para obtener vino, champagne, cava, y/o vermut, - fermentación de malta para la obtención de cerveza, - fermentación de manzana para la obtención de sidra y/o -fermentación de uno o varios sustratos vegetales para dar lugar a aguardientes, preferentemente para la vinificación del mosto de uva. 36. Uso según la realización anterior, donde la uva se selecciona entre uvas tintas y/o uvas blancas.
Los productos y servicios protegidos por este registro son:
C12N 1/18 - C12N 1/38 - C12N 15/01 - C12G 1/02 - C12G 3/02 - C12R 1/865
Descripciones:
+ ES-2957008_A1 En la presente memoria "cepas mutantes" y "cepas mejoradas" son sinónimos y se emplean de forma intercambiable. En la presente memoria "AEC", "2AEC", "2-AEC", "2-aminoetil-L-cisteína" y "clorhidrato de S- (2-Aminoetil) -L-cisteína" son sinónimos y se emplean de forma intercambiable y se refieren a un análogo tóxico del aminoácido lisina En la presente memoria "vinificación" y "fermentación alcohólica del mosto de uva" son sinónimos y se usan de forma intercambiable. En la presente memoria "evolución dirigida" y "evolución adaptativa" son sinónimos y se usan de forma intercambiable. El objeto de la presente invención se refiere a un método de obtención de una cepa mejorada de Saccharomyces cerevisiae con propiedades vinícolas optimizadas que comprende las siguientes etapas: a) Crecer una cepa inicial de S. cerevisiae en un medio de cultivo con una concentración de 2-aminoetil-L-cisteína de 10 mg/l a 90 mg/l de medio de cultivo durante al menos 5 semanas. b) aislar mutantes individuales de la cepa mejorada de S. cerevisiae con propiedades vinícolas optimizadas transcurrido el tiempo de la etapa a) . En una realización particular preferida el periodo de tiempo necesario es de al menos 6 semanas, más preferentemente al menos 7 semanas, aún más preferentemente al menos 8 semanas, aún más preferentemente al menos 9 semanas, aún más preferentemente al menos 10 semanas. En una realización particular el periodo de tiempo necesario está comprendido entre 6 y 40 semanas, preferentemente, entre 7 y 35 semanas, más preferentemente entre 8 y 30 semanas, aún más preferentemente entre 9 y 25 semanas y aún más preferentemente entre 10 y 20 semanas. En otra realización particular, la cantidad de 2-aminoetil-L-cisteína es de entre 10 mg/l y 90 mg/l de medio de cultivo, preferentemente entre 13 mg/l y 85 mg/l, más preferentemente entre 15 mg/l y 80 mg/l, aún más preferentemente entre 20 mg/l y 65 mg/l, aún más preferentemente entre 30 mg/l y 40 mg/l. Las concentraciones de 2-aminoetil-L-cisteína indicadas en el párrafo anterior son equivalentes a entre 50 M y 449 M, preferentemente entre 65 M y 424 M, más preferentemente entre 75 M y 399 M, aún más preferentemente entre 100 M y 324 M, aún más preferentemente entre 150 M y 200 M. En otra realización particular el periodo de tiempo necesario está comprendido entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l de medio de cultivo. Previamente a la etapa a) se puede crecer una colonia de la cepa inicial en un precultivo sin 2-AEC El método de la invención puede realizarse tanto en un cultivo continuo como discontinuo (en batch) La ventaja de un cultivo discontinuo o (en batch) es que se crean cuellos de botella poblacionales que pueden favorecer ciertas mutaciones específicas. En una realización particular, cuando el cultivo es discontinuo y cuando la DO (600nm) del cultivo anterior ha alcanzado la fase estacionaria, esto es una densidad óptica DO (600nm) superior a 4 se inocula una fracción de dicho cultivo en un cultivo nuevo con medio de cultivo y 2-aminoetil-L-cisteína nuevos. Cuando el método de la invención se realiza en un cultivo discontinuo, es necesario medir la densidad óptica (DO (600nm) ) . Cuando la misma exceda el valor de 4, preferentemente 4, 5, más preferentemente 5, lo que implica que el cultivo está en fase estacionaria, se (re) inocula una fracción de dicho cultivo un nuevo cultivo de forma que a densidad DO (600nm) inicial del nuevo cultivo sea entre 0.05 y 0.2, preferentemente, 0.08 y 0.15, para iniciar un nuevo ciclo. Esto ocurre cada 2 o 3 días aproximadamente. En un periodo de 5 semanas habrá que realizar entre 14 y 15 reinoculaciones o pases. Al nuevo cultivo habrá que añadir también la misma o diferente concentración de 2AEC que se estaba empleando, por ejemplo, entre de entre 10 mg/l y 90 mg/l. La determinación del número de generaciones se realizó a partir de los datos obtenidos de la densidad óptica (600nm) de cada uno de los pases realizados, cuando el método de la invención se realiza en un cultivo discontinuo. - RATIO = (DO600 final) / (DO600 inicial) - Generaciones = log2 (RATIO) - Generaciones acumuladas = sumatorio generaciones en cada pase EL método de cálculo de las generaciones se ha obtenido a partir del siguiente documento: Xu, X., Williams, T. C., Divne, C., Pretorius, I. S., Paulsen, I. T. (2019) . Evolutionar y engineering in Saccharomyces cerevisiae reveals a TRK1-dependent potassium influx mechanism for propionic acid tolerance. Biotechnol Biofuels 12, 97 (2019) . https://doi. org/10.1186/s13068-019-1427-6 Un periodo de 5 semanas es el periodo de tiempo necesario para completar aproximadamente al menos 75 generaciones de dicha cepa inicial. En una realización particular el periodo de tiempo necesario es de al menos 80 generaciones, más preferentemente al menos 90 generaciones, aún más preferentemente al menos 100 generaciones, aún más preferentemente al menos 120 generaciones, aún más preferentemente al menos 130 generaciones, aún más preferentemente al menos 140 generaciones, aún más preferentemente al menos 150 generaciones. En una realización particular el periodo de tiempo máximo necesario es de al menos 300 generaciones, más preferentemente al menos 250 generaciones, aún más preferentemente al menos 220 generaciones, aún más preferentemente al menos 200 generaciones, aún más preferentemente al menos 180 generaciones, aún más preferentemente al menos 170 generaciones, aún más preferentemente al menos 160 generaciones. En otra realización particular el periodo de tiempo necesario está comprendido entre al menos 120 generaciones y 180 generaciones, esto es entre 8 semanas y 12 semanas. Las condiciones ambientales del método de la invención son las mismas que las empleadas en cultivos de crecimiento de cepas de S. cerevisiae que son las habituales en el estado de la técnica y un experto en la materia sabría encontrar las condiciones idóneas. La temperatura de crecimiento puede ser entre 10°C y 60°C, preferentemente entre 15°C y 50°C, más preferentemente entre 20°C y 40°C y aún más preferentemente entre 25°C y 35°C. La agitación del cultivo discontinuo, puede ser entre 10 y 400 revoluciones por minuto (rpm) , preferentemente entre 50 y 300 rpm, más preferentemente entre 100 y 250 rpm, más preferentemente entre 150 y 220 rpm, y aún más preferentemente entre 160 y 200 rpm. En un cultivo continuo la agitación es diferente ya que ocurre mediante unas hélices localizadas en el interior del biorreactor, esta agitación puede ser entre 100 y 700 rpm, preferentemente entre 200 y 600 rpm, más preferentemente entre 300 y 500 rpm. A modo de ejemplo, el cultivo de la cepa de S. cerevisiae en contacto con 2-AEC se puede crecer en batch, a una temperatura entre 15°C y 45°C, preferentemente 20°C y 40°C, más preferentemente entre 25°C y 35°C En otra realización particular, donde el medio de cultivo se selecciona entre medio mínimo SD (Synthetic defined) , SC (Synthetic Complete) sin lisina y mosto sintético MS300 sin lisina, o cualquier medio mínimo sin aminoácidos. Un experto en la materia sabría cómo preparar cualquiera de estos medios ya que es una tarea rutinaria en el área. A modo de ejemplo se pueden emplear los medios de cultivo de: Dymond JS. Saccharomyces cerevisiae growth media. Methods Enzymol. 2013;533:191-204. doi:10.1016/B978-0-12-420067-8.00012-X En una realización preferente del método de la invención la cepa de S. cerevisiae se pone en contacto con 2-AEC en un cultivo discontinuo con medio SD a una temperatura entre 25°C y 35°C con una agitación comprendida entre 160 rpm y 200 rpm. Cuando la DO (600nm) exceda el valor de 5 se (re) inocula una fracción de dicho cultivo un nuevo ultivo de forma que la densidad en medio fresco SD a una DO (600nm) inicial sea de 0.1, continuando así durante al menos entre 150 generaciones y 180 generaciones, esto es entre 8 y 12 semanas y la cantidad de 2-aminoetil-L-cisteína es de entre 30 mg/l y 40 mg/l. Respecto a la etapa b) del método de la invención, al final del proceso de selección se pueden aislar colonias individuales en medio rico no selectivo, por ejemplo, YPD/YEPD (Yeast Extract, Peptone, Dextrose) y se comprobó su tolerancia a 2-AEC mediante goteos de diluciones seriadas en placas de medio selectivo SD con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. En una realización particular de la etapa b) del método de la invención, el aislamiento de mutantes de la cepa mejorada de S. cerevisiae se puede realizar mediante diluciones seriadas y su siembra directamente en placas de medio selectivos SD con 2-AEC a una concentración de entre 30 mg/l y 40 mg/l. Las diluciones seriadas se pueden realizar en agua, solución salina o medio SD. Una de las ventajas del método de la invención es la reproducibilidad ya que se han obtenido cepas mejoradas de S. cerevisiae con propiedades vinícolas optimizadas a partir de 3 cepas de levaduras comerciales con un fondo genético diferente. Los mutantes con mayor tolerancia a 2-AEC se utilizaron para realizar fermentaciones a pequeña escala en mosto de uva con el fin de determinar la mejora de la producción de compuestos químicos de interés enológico, esto es, que presenten propiedades vinícolas optimizadas. Propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso de vinificación de mosto de uva. En una realización particular el mosto de uva puede ser natural, sintético y combinaciones de ambos. Las diferencias con respecto al documento de Gasent-Ramírez JM, es que permite generar cepas con propiedades vinícolas mejoradas que no serían óptimas para repostería, ya que las características mencionadas en el párrafo anterior dan lugar a una menor producción de CO2 por desviar el flujo glicolítico a la producción de glicerol. El CO2 gaseoso es esencial en panadería y repostería para que los productos adquieran su textura esponjosa, por lo que las cepas de la presente invención no serían adecuadas en repostería ya que requerirían más tiempo para dar lugar a los productos de repostería que las cepas parentales. El control de la cantidad de ácido acético es importante para las características organolépticas del vino, ya que unos niveles muy elevados de este compuesto lo avinagran, reduciendo así su calidad. El glicerol por el contrario tiene un efecto positivo en la calidad del vino. No es aromático, debido a su naturaleza no volátil, pero contribuye a la densidad, cuerpo, suavidad, y textura de los vinos. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. En una realización particular, la producción de glicerol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 10% (p/v) más, preferentemente al menos un 20% (p/v) más, más preferentemente al menos un 30% (p/v) más, aún más preferentemente al menos un 40% más, aún más preferentemente al menos un 50% (p/v) más, aún más preferentemente al menos un 60% (p/v) más, aún más preferentemente al menos un 70% (p/v) más, aún más preferentemente al menos un 80% (p/v) más, aún más preferentemente al menos un 90% (p/v) más y aún más preferentemente al menos un 100 (p/v) más cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 10% (p/v) más de glicerol que el producto obtenido a partir de un proceso de vinificación del mosto de va con la cepa inicial de la cual proviene, preferentemente al menos un 20% (p/v) más, más preferentemente al menos un 30% (p/v) más, aún más preferentemente al menos un 40% (p/v) más, aún más preferentemente al menos un 50% (p/v) más, aún más preferentemente al menos un 60% (p/v) más, aún más preferentemente al menos un 70% (p/v) más, aún más preferentemente al menos un 80% (p/v) más, aún más preferentemente al menos un 90% (p/v) más y aún más preferentemente al menos un 100% (p/v) más de glicerol. En otra realización particular, la producción de etanol de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 0, 5% (v/v) menos, preferentemente al menos 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos, aún más preferentemente al menos un 8% (v/v) menos, aún más preferentemente al menos un 10% (v/v) menos, aún más preferentemente al menos un 15% (v/v) menos, aún más preferentemente al menos un 20% (v/v) menos, aún más preferentemente al menos un 30% (v/v) menos, y aún más preferentemente al menos un 50% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 0, 5% (v/v) menos de etanol que el producto obtenido a partir de un proceso de vinificación del mosto de uva con la cepa inicial de la cual proviene, preferentemente al menos un 2% (v/v) menos, más preferentemente al menos un 5% (v/v) menos, aún más preferentemente al menos un 8% (v/v) menos, aún más preferentemente al menos un 10% (v/v) menos, aún más preferentemente al menos un 15% (v/v) menos, aún más preferentemente al menos un 20% (v/v) menos, aún más preferentemente al menos un 30% (v/v) menos, y aún más preferentemente al menos un 50% (v/v) menos cuando se realiza un proceso de vinificación de mosto de uva. La reducción en la producción de etanol se ha observado en las cepas evolucionadas eM2c y eT73l, que presentan mutaciones homocigotas en RTG2, aunque es de esperar que la mutación en LYS21 en la cepa eT73l también participe, ya que comparten ruta metabólica En otra realización particular, la producción de ácido acético de la cepa con propiedades vinícolas optimizadas en comparación con la cepa inicial de la cual proviene es de al menos un 0, 5% (p/v) menos, preferentemente al menos un 2% (p/v) menos, más referentemente al menos un 5% (p/v) menos, aún más preferentemente al menos un 10% (p/v) menos aún más preferentemente al menos un 20% (p/v) menos, aún más preferentemente al menos un 40% (p/v) menos, aún más preferentemente al menos un 50% (p/v) menos, aún más preferentemente al menos un 60% (p/v) menos, aún más preferentemente al menos un 70% (p/v) menos, y aún más preferentemente al menos un 80% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. Esto es, el producto obtenido a partir de un proceso de vinificación del mosto de uva con una cepa con propiedades vinícolas optimizadas presenta al menos un 0, 5% (p/v) menos de ácido acético que el producto obtenido a partir de un proceso de vinificación del mosto de uva con la cepa inicial de la cual proviene, preferentemente al menos un 2% (p/v) menos, más preferentemente al menos un 5% (p/v) menos, aún más preferentemente al menos un 10% (p/v) menos aún más preferentemente al menos un 20% (p/v) menos, aún más preferentemente al menos un 40% (p/v) menos, aún más preferentemente al menos un 50% (p/v) menos, aún más preferentemente al menos un 60% (p/v) menos, aún más preferentemente al menos un 70% (p/v) menos, y aún más preferentemente al menos un 80% (p/v) menos cuando se realiza un proceso de vinificación de mosto de uva. En otra realización particular la cepa con propiedades vinícolas optimizadas presenta una reducción de al menos un 5% (v/v) en la producción de etanol, una reducción de al menos un 20% (p/v) en la producción de ácido acético y un incremento de al menos un 60% (p/v) en la producción de glicerol en un proceso de vinificación en comparación con la misma cepa sin realizar el método de la invención. En una realización particular del método de la invención la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones no sinónimas en la secuencia de nucleótidos del gen RTG2. Mutaciones no sinónimas son aquellas que modulan la actividad de la proteína codificada por el gen RTG2. En otra realización de la invención la mutación es homocigota o heterocigota En la presente memoria, el gen de RTG2 presenta el código 852640 en GenBank y el código de UniProt de la proteína es P32608. RTG2 es un regulador transcripcional de la ruta de señalización de nutrientes conocida como Respuesta Retrógrada. Dicha ruta favorece la síntesis de aminoácidos como la lisina y glutamina a partir de esqueletos carbonados procedentes del piruvato producido durante la glucólisis. El efecto técnico de las mutaciones en la secuencia de nucleótidos del gen RTG2 es que reducen etanol y ácido acético y aumentan glicerol cuando las cepas de Saccharomyces cerevisiae realizan la fermentación del vino, esto es, presentan propiedades vinícolas optimizadas. En otra realización particular las mutaciones en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. En otra realización del método de la invención la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones no sinónimas en la secuencia de nucleótidos de los genes de la homocitrato sintasa LYS20 y LYS21. En la presente memoria, el gen de LYS20 presenta el código 851346 en GenBank y el código de UniProt de la proteína es P48570. En la presente memoria, el gen de LYS21 presenta el código 851425 en GenBank y el código de UniProt de la proteína es Q12122. Lys20 y su parálogo Lys21 forman la homocitrato sintasa, que cataliza la condensación de a-cetoglutarato y acetil-CoA para dar homocitrato, el primer paso de la síntesis de lisina. Esta mutación podría conllevar una enzima hiperactivada o insensible a retroinhibición que desviase el flujo metabólico desde el piruvato hacia la producción del aminoácido lisina reduciendo el piruvato y por tanto el flujo glicolítico, favoreciendo la producción de glicerol y también consumiendo acetil-CoA y por tanto disminuyendo el ácido acético. RTG2 controla a LYS20 y LYS21 y más genes LYS, de manera que cuantas más mutaciones activadoras haya, la ruta estará más activa favoreciendo la producción de glicerol y disminuyendo el ácido acético. Mutaciones no sinónimas son aquellas que modulan la actividad de las proteínas codificadas por los genes LYS20 y LYS21. En otra realización de la invención la mutación es homocigota o heterocigota. En otra realización particular las mutaciones en la secuencia de nucleótidos de los genes LYS20 y LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. El efecto técnico de las mutaciones en LYS21, RTG2 y LYS20, además de la obtención de propiedades vinícolas optimizadas es la activación del metabolismo de lisina y aumentar la tolerancia a AEC. En otra realización particular las cepas obtenidas por el método de la invención presentan un incremento en el nivel de expresión de los genes CIT2 y DLD3 con respecto a la cepa inicial en condiciones de crecimiento exponencial en medio completo y rico en nutrientes, lo que indica que la respuesta retrógrada está activada En la presente memoria, el gen de CIT2 presenta el código 850361 en GenBank y el código de UniProt de la proteína es P08679. En la presente memoria, el gen de DLD3 presenta el código 856638 en GenBank y el código de UniProt de la proteína es P39976. Otro objeto adicional de la invención se refiere al uso de uno o más de los alelos mutantes en RTG2, LYS20 y LYS21 como marcadores para detectar una cepa con propiedades vinícolas optimizadas por el método de la invención anteriormente descrito. Otro objeto adicional de la invención se refiere al uso de uno o más de los alelos mutantes en RTG2, LYS20 y LYS21 como herramientas para la mejora de las propiedades vinícolas de cualquier levadura de la especie S. cerevisae en la que se introduzcan. En una realización particular los alelos mutantes de RTG2 seleccionados entre uno o más de R30C; G248E y R560I En otra realización particular el alelo mutante de LYS20 es N379D. En otra realización particular el alelo mutante de LYS21 es R390G. Un objeto adicional de la presente invención se refiere a una cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas obtenida por el método descrito anteriormente. Propiedades vinícolas optimizadas se refiere a 2 o más de las siguientes: mayor producción de glicerol, menor producción de ácido acético, y menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso posterior de vinificación de mosto de uva. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. En otra realización particular, la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen RTG2. En otra realización particular, las mutaciones en la secuencia de nucleótidos del gen RTG2 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante R30C; G248E y R560I. En otra realización particular, la cepa de Saccharomyces cerevisiae con propiedades vinícolas optimizadas presenta una o más mutaciones en la secuencia de nucleótidos del gen los genes de la homocitrato sintasa LYS20 y LYS21. En otra realización particular, la mutación es homocigota o heterocigota. En otra realización particular las mutaciones en la secuencia de nucleótidos de los genes LYS20 y LYS21 dan lugar a una o más de las siguientes mutaciones de aminoácidos de la proteína resultante N379D y R390G respectivamente. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes erivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13204. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13204" y "eM2c" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13204, u obtenidas de CECT13204, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13204. Preferiblemente, el mutante derivado de CECT13204 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13204 en condiciones iguales. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13205. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13205" y "eT73l" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13205, u obtenidas de CECT13205, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13205. Preferiblemente, el mutante derivado de CECT13205 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13205 en condiciones iguales. La presente invención también se refiere a una cepa de Saccharomyces cerevisiae depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma, en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas, que la cepa CECT13206. Esta cepa se depositó el 13 de mayo de 2022 en la Colección Española de Cultivos Tipo, Calle Catedrático Agustín Escardino, 9, CP46980, Paterna (Valencia) , España según las disposiciones del Tratado de Budapest. En la presente invención la cepa "CECT13206" y "eEC1118º" son términos intercambiables y se emplean indistintamente. Los mutantes derivados de esta cepa se refieren a cepas que se derivan de CECT13206, u obtenidas de CECT13206, y pueden tener mutaciones en comparación con Saccharomyces cerevisiae, preferiblemente, la cepa mutante tiene las mismas o mejores propiedades vinícolas que la cepa madre CECT13206. Preferiblemente, el mutante derivado de CECT13206 tiene al menos el 80% o más, preferiblemente al menos el 90% o más, más preferiblemente al menos el 95% o más o incluso hasta el 100% o más del 100% de las propiedades vinícolas optimizadas en comparación con la cepa CECT13206 en condiciones iguales. Las propiedades vinícolas optimizadas de las cepas CECT13204, CECT13205 y CECT13206 se refieren a 2 o más de las siguientes: - mayor producción de glicerol, - menor producción de ácido acético, y - menor producción de etanol en comparación con la cepa inicial de la cual proviene, cuando se realiza un proceso de vinificación de mosto de uva. En una realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol y menor producción de ácido acético en comparación con la cepa inicial. En otra realización particular, propiedades vinícolas optimizadas se refiere a cepas mejoradas con mayor producción de glicerol, menor producción de ácido acético y menor producción de etanol en comparación con la cepa inicial. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13204 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13204. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13205 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13205. Un objeto adicional de la invención se refiere a una cepa de Saccharomyces cerevisiae obtenida por el método anteriormente descrito depositada en la Colección Española de Cultivos Tipo con número 13206 o mutantes derivados de la misma en donde dichos mutantes tienen las mismas o mejores propiedades vinícolas optimizadas, que la cepa CECT13206. Un objeto adicional de la invención se refiere al uso de una o varias cepas definidas anteriormente y/o obtenidas según el método definido anteriormente para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. En una realización particular, es el uso de una o más de las cepas CECT13204, CECT13205 y CECT13206 para la producción de bebidas alcohólicas mediante la fermentación alcohólica de uno o varios sustratos vegetales. En una realización particular se puede usar para la vinificación del mosto de uva para obtener vino, champagne, cava, vermut, fermentación de malta para la obtención de cerveza, fermentación de manzana para obtener sidra, hidromiel, fermentación de uno o varios sustratos vegetales para dar lugar a aguardientes, a modo de ejemplo: whisky, ron, pacharán, brandy (coñac, armañac, brandy de jerez, pisco) , tequila, vodka, orujo o sake. Preferentemente para la vinificación del mosto de uva. En otra realización particular la variedad de uva se selecciona entre uvas tintas y/o uvas blancas. En otra realización particular la variedad de uva se selecciona de una o más del grupo de uvas tintas consistente en: Abouriou, Acolon, Agiorgitiko, Aglianico, Alexandrouli, Alfrocheiro preto, Alicante bouschet, Alicante bouschet, Alvarelháo, Ancellotta, Bábeascá neagrá, Barbera, Bastardo, Blauer portugieser, Blaufránkisch, Bobal, Bonarda, Bondola, Bovale, Brachetto, Bual, Cabernet franc, Cabernet sauvignon, Caíño tinto, Canaiolo, Cariñena, Carménére, Carnelian, Charbono, Cinsaut, Corvina, Croatina, Darkenusa, Dobricic, Dolcetto, Dornfelder, Durif, Feteascá neagrá, Freisa, Gamay, Garnacha, Graciano, Gropello, Grignolino, Hondarrabi beltza, Kadarka, Kratosija, Lagrein, Lambrusco, Listán negro, Malbec, Malvasía di Schierano, Malvasía negra, Mammolino, Mandilaria, Marattiko, Marzemino, Mavro, Mavrodafni, Mavrud, Mencía, Merlot, Millot, Misión, Molinara, Mónica, Montepulciano, Moscatel de Hamburgo, Monastrell, Mujuretuli, Nebbiolo, Négrette, Negroamaro, Nero d'Avola, Okuzgozu, Ojaleshi, Oseleta, Petit verdot, Picapoll negro, Prieto picudo, Pinot meunier, Pinot noir, Piruleta, Pinotage, Plavac mali, Poulsard, Quebranta, Refosco, Rondinella, Rotberger, Ruby cabernet, Rubired, Ruché, Rufete, Sagrantino, Sangiovese, Saperavi, Schiava, Syrah, Sousón, St. Laurent, Tannat, Tarrango, Tempranillo, Teroldego, Terret noir, Tinta barroca, Tinta cáo, Touriga franca, Touriga nacional, Valdiguié, Vranac, Xinómavro, Zinfandel, Zweigelt, Valdepeñas, En otra realización particular la variedad de uva se selecciona de una o más del grupo de uvas blancas consistente en: Alarije, Albalonga, Albana, Albariño, Albillo, Aledo, Aligoté, Altesse, Arinto, Arneis, Assyrtiko, Auxerrois blanc, Bogdanusa, Bacchus, Bical, Bouvier, Boal, Catarratto, Chardonnay, Centennia, Chasselas, Chenin blanc, Clairette, Colombard, Córtese, Courbu, Crouchen, Cserszegi füszeres, Doradillo, Erbaluce, Ehrenfelser, Ezerjó, Faber, Falanghina, Feteascá alba, Feteascá regalá, Fiano, Flora, Folle blanche, Freisamer, Fromenteau, Furmint, Garganega, Garnacha blanca, Garnacha gris, Gewürztraminer, Glera, Gloria, Godello, Goldriesling, Grollam noir, Grüner veltliner, Hárslevelü, Hondarrabi zuri, Humagne blanche, Huxelrebe, Irsai olivér, Izsáki sarfehér, Jacquére, Pardina, Juhfark, Kerner, Krstac, Len de l'el, Loureira, Macabeo, Madeleine angevine, Malvar, Malvasía, Petit manseng, Gros manseng, Maria gomes, Marsanne, Mauzac, Melón de Borgoña, Merseguera, Moscatel de Alejandría, Moscatel de grano menudo, Muscat ottonel, Moscato giallo, Moschofilero, Mtsvane, Sauvignon vert, Müller-thurgau, Neuburger, Ondenc, Ortega, Pare, Palomino, Parellada, Pecorino, Petite arvine, Pedro Giménez, Pedro ximénez, Pinot blanc, Pinot grigio, Piquepoul blanc, Rabigato, Reichensteiner, Rhoditis, Riesling, Rieslaner, Rkatsiteli, Rotgipfler, Roussanne, Sauvignon blanc, Sauvignon gris, Savagnin blanc, Savagnin rosé, Savatiano, Scheurebe, Schonburger, Sémillon, Septiner, Cerceal, Siegerrebe, Sylvaner, Smederevka, Zierfandler, Sultanina, Symphony, Taminga, Tempranillo blanco, Torrontés, Trebbiano, Treixadura, Gray riesling, Verdejo, Verdia, Verdicchio, Verduzzo friulano, Verduzzo trevigiano, Vermentino, Vernaccia, Viognier, Macabeo, Welschriesling, Würzer, Xarello, Xynisteri, Zéta, Zeusz, Moscatel, Cardinal, Napoleón, Corinto, Noah, Isabella, Ivy, Concord, Niagara, Gewurstraminer, Zalema, Albarín y Viura En una realización preferente la uva es de la variedad bobal, Breve descripción de las figuras Fig. 1. Tolerancia de las cepas evolucionadas a AEC. Goteos de diluciones seriadas de un factor de magnitud en cada paso realizadas en SD de las cepas parentales M2, T73 y EC1118 junto con mutantes seleccionados obtenidos a partir de evolución adaptativa eM2c. eT73l y eEC1118º. Gotas de 5 microlitros de cada dilución se depositan ordenadamente en una placa de medio mínimo (SD, izquierda) y SD con 35 mg/l 2-aminoetil-L-cisteina (2-AEC) , derecha. Fig. 2. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa M2 A) Curva de consumo de azúcares reductores de las cepas evolucionadas más de 150 generaciones a partir de M2, durante el proceso de fermentación en condiciones de vinificación en mosto de la variedad bobal. Cambios en la producción de etanol, glicerol y ácido acético en el mosto una vez fermentado respecto al mosto fermentado por la cepa sin evolucionar B) -D) respectivamente. Se muestran los valores promedios y las desviaciones típicas. Los experimentos se realizaron por triplicado. * p<0.05, test t-student, 2 colas. Fig. 3. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa T73. Condiciones como en la Figura 2. Fig. 4. Microvinificaciones de mutantes aislados tras evolución adaptativa de la cepa EC1118. Condiciones como en la Figura 2. Fig. 5. Análisis de la respuesta retrógrada. Análisis de la expresión de los genes marcadores CIT2 y DLD3 de respuesta retrógrada en mutantes seleccionados y las epas iniciales. M2 izquierda (cepa inicial, izda vs cepa mejorada, dcha) , EC1118, centro (cepa inicial, izda vs cepa mejorada, dcha) y T73 derecha (cepa inicial, izda vs cepa mejorada, dcha) . Las células se crecieron en fase exponencial en medio rico YPD. Normalización respecto del gen de la actina ACT1. Fig. 6. Subclonación de alelos mutantes A) Tolerancia a 2-AEC de la cepa vínica haploide C9 rtg2A transformada con los plásmidos centroméricos conteniendo los alelos wt y mutantes de RTG2 indicados. B) Tolerancia a 2-AEC de la cepa vínica haploide C9 lys20A lys21A transformada con los plásmidos centroméricos conteniendo los alelos wt y mutantes de LYS20 y LYS21 indicados. Se realizaron diluciones seriadas de un cultivo estacionario en medio SD y se depositaron gotas de 5 l en placas de SD y SD+AEC conteniendo geneticina para seleccionar las cepas transformadas. Fig. 7. Vinificaciones en bodega experimental Se muestra la evolución de la fermentación de la cepa mejorada eT73l en comparación de su cepa parental T73 siguiendo la evolución densitométrica de la vinificación en 50 litros de mosto tempranillo, así como la producción final de etanol, glicerol, ácido acético (acidez volátil) y la acidez total expresada como ácido tartárico. Se muestran los valores promedios y las desviaciones típicas. Los experimentos se realizaron por triplicado. * p<0.05, test tstudent, 2 colas. Ejemplos Materiales y métodos Evolución adaptativa en presencia del análogo tóxico de la lisina 2-AEC Las distintas cepas industriales de S. cerevisiae M2, T73 y EC1118 se usaron como parentales para tres experimentos de evolución dirigida independientes. A partir de una colonia individual de cada cepa se inoculó un precultivo de 5 mL de medio mínimo SD (Yeast Nitrogen Base 0.17%, 0.5% sulfato amónico, 2% glucosa) y se creció 24h a 30°C. A partir de estos precultivos se inocularon, a una DO (600nm) inicial de 0.1, matraces con 25 mL de SD suplementados con 35 mg/L o 174 M de 2-aminoetil-L-cisteína (AEC) obtenido en Sigma Aldrich (https://www.sigmaaldrich.com/ES/es/product/sigma/a2636) . Estos cultivos se crecieron en batch a 30°C en agitación (180 rpm) , se determinó la DO (600nm) final del cultivo cada 2-3 días y se reinocularon en medio fresco a una DO (600nm) inicial de 0.1. El experimento de evolución adaptativa se continuó hasta completar 29 pases (durante un periodo de unas 10 semanas) , con más de 150 generaciones. Se aislaron mutantes individuales se analizaron respecto a su tolerancia a AEC mediante goteos de diluciones seriadas en placas de medio selectivos. Determinación de las generaciones en el método de evolución dirigida La determinación del número de generaciones se realizó a partir de los datos obtenidos de la densidad óptica (600nm) de cada uno de los pases realizados. - RATIO = (DO600 final) / (DO600 inicial) - Generaciones = log2 (RATIO) - Generaciones acumuladas = sumatorio generaciones Ensayos de tolerancia a AEC Colonias individuales se crecieron a saturación en medio SD durante la noche. Se determinó la densidad óptica del cultivo a 600 nm para igualar los cultivos y se realizaron diluciones seriadas de un orden de magnitud (100 l de cultivo en 900 l de agua estéril) y se depositaron gotas de 5 l en placas de SD y SD+ AEC 35 mg/l. Las placas se incubaron durante dos días a 30° C. Microvinificaciones en mosto natural Para comprobar las mejoras en las propiedades vinícolas de las cepas se realizaron microvinificaciones en mosto. El mosto usado fue tinto de la variedad bobal de la cosecha del 2015. Con el objetivo de evitar la contaminación el mosto una vez descongelado, se añadió dimetil dicarbonato (DMDC) 500 g/L y se dejó actuar durante 24 h en frío. Los experimentos se realizaron a partir de precultivos en YPD líquido procedentes de colonias aisladas de los mutantes y cultivados durante 48 h en un agitador rotativo a 200 rpm. Los mostos se inocularon a una D.O.600 de 0.1. Las vinificaciones se llevaron a cabo en un volumen de 30 ml a 24 °C en agitación suave (50 rpm) en tubos cónicos de centrífuga desechables de 30 ml. Cada 2-3 días se tomaron alícuotas del sobrenadante y se siguió la fermentación siguiendo el consumo de azucares reductores, siguiendo el protocolo de Robyt y Whelan, (1972) con ciertas modificaciones. 100 l de una dilución 1:100 del sobrenadante procedente de la vinificación se mezcló con un volumen del reactivo DNS (ácido dinitro-3, 5-salicílico 0.01 g/ml, NaOH 16 mg/l, tartrato doble Na-K 0.3 g/ml) y se hirvió 5 min a 100 °C. Posteriormente se añadió a cada reacción 1 mL de H2O destilada y se procedió a medir la absorbancia a 540 nm. La concentración de azúcares se determinó mediante interpolación con una recta patrón preparada a partir de una disolución stock de glucosa de 2 g/L. Al final de la vinificación se midieron el resto de metabolitos. La determinación de etanol se realiza mediante cuantificación enzimática utilizando alcohol deshidrogenasa. Para ello, se añade 1 mL de tampón Gly/Tris conteniendo el coenzima oxidado de la reacción (Glicina 0.2 M, Tris-HCl pH 9.7, NAD+ 50 mM) a 200 L de una dilución 1:5000 del sobrenadante procedente del final de la vinificación. Se procede a medir la absorbancia inicial a 340 nm. A continuación, se añaden 20 L de alcohol deshidrogenasa (20 U/mL, aprox.4 mg/l) y se mide la absorbancia de nuevo después de 15 min de incubación. La concentración de etanol se determina por interpolación de la recta patrón preparada a partir de etanol 1.2 mM. El ácido acético y glicerol se determinaron utilizando kits de Megazyme según las instrucciones del fabricante midiéndose en un lector de placas multipocillo Varioskan. qPCR La cantidad de ARN total de levadura se obtuvo mediante rotura mecánica con perlas de vidrio y precipitación selectiva con LiCl, utilizando protocolos habituales en el área. El ARN fue retrotranscrito según las instrucciones del kit NZY First-Strand cDNA Synthesis Kit y se realizó la PCR con oligos de DLD3 y CIT2, usando el gen ACT1 como control en un Quantstudio 3 con el kit NZYSpeedy qPCR Green Master Mix. Los oligonucleótidos utilizados en la PCR para los genes ACT1, CIT2y DLD3 están descritos en el documento Anna N. Starovoytova, Maxim I. Sorokin, Svyatoslav S. Sokolov, Fedor F. Severin, Dmitr y A. Knorre. (2013) Mitochondrial signaling in Saccharomyces cerevisiae pseudohyphae formation induced by butanol, FEMS Yeast Research, 13, 367-374, https://doi.org/10.1111/1567-1364.12039, sección Real-Time PCR Secuenciación de genomas La secuenciación del genoma de los mutantes seleccionados fue llevada a cabo por la empresa Novogene empleando métodos habituales en el área. Resultados Obtención por evolución adaptativa en presencia de AEC de mutantes con un fenotipo compatible con la activación de la Respuesta Retrógrada Se crecieron las cepas M2, EC1118 y T73 en una serie continuada de cultivos en batch en 25 ml de medio de cultivo SD con 35 mg/l de AEC. Se realizaron reinoculaciones cada 2/3 días a partir del cultivo anterior en fase estacionaria para obtener un número elevado de generaciones, aislando colonias individuales a las 150 generaciones. Las colonias individuales se seleccionaron y se analizó su tolerancia a AEC mediante goteo en placa (Figura 1, donde se muestran un mutante representativo de cada fondo genético) . Se seleccionaron los mutantes más prometedores conforme a su tolerancia a 2AEC para analizar su comportamiento en vinificación en mosto natural. La Figura 2 muestra los mutantes procedentes de la cepa M2. Todos los mutantes presentaban una velocidad reducida en el consumo de azúcares (glucosa + fructosa en el caso del mosto de uva) (Fig. 2A) , pero todos completaban la vinificación. Esta velocidad reducida puede asociarse con la mejora del resto de cualidades del producto final, incremento de la cantidad de glicerol y disminución del etanol y del ácido acético entre otras. En cuanto a la producción de metabolitos (Figura 2B-D) , hay una tendencia a una menor producción de etanol por parte de las cepas mejoradas, aunque sólo es significativo en el caso del mutante eM2c donde se observa una reducción de hasta el 20% en la producción de etanol. En cuanto al glicerol (Figura 2C) , los mutantes producen más glicerol durante el proceso de vinificación del mosto de uva, particularmente la cepa eM2c. El efecto sobre el ácido acético es más acusado (Figura 2D) , y aproximadamente la mitad de los mutantes presentan una reducción acusada del ácido acético a menos de un cuarto del que produce la cepa parental. El genotipo de la cepa eM2c es RTG2 R30C/ RTG2 R30C. Realización del método de la invención en la cepa comercial de S. cerevisiae T73 El método de la invención se realizó con la cepa T73 de forma idéntica a como se realizó con la cepa M2, (Figura 3) . Se obtuvieron resultados muy similares: mutantes que completan la fermentación o vinificación de mosto de uva con un ligero retraso respecto a la cepa inicial (Figura 3A) . Todos los mutantes obtenidos de T73 producen más glicerol y menos acético y reducen el etanol al final de la fermentación. Por ejemplo, el mutante eT73l lo reduce en un 16%. El genotipo de la cepa mejorada eT73I es RTG2 G248E/RTG2 G248E, LYS21 R390G/LYS21 R390G. Estos resultados demuestran que el método de la invención es reproducible Realización del método de la invención en la cepa comercial de S. cerevisiae EC1118 El método de la invención se realizó con la cepa EC1118 de forma idéntica a como se realizó con las cepas M2 y T73, (Figura 4) . En EC1118 se aisló el mutante eEC1118º con una elevada producción de glicerol, menor producción de ácido acético eEC1118j tiene un comportamiento similar, pero en menor grado. Ambos mutantes muestran una tendencia en la disminución en la producción de etanol. Los dos mutantes presentan una ralentización del ritmo de fermentación, pero la completan. El genotipo de la cepa eEC1118º es RTG2/RTG2 R560I, LYS20/ LYS20 N379D, es decir, heterozigótico para ambos genes. Estos resultados confirman que el método de la invención es reproducible. Expresión génica Se analizó la expresión por qPCR de los dos genes típicos marcadores de la respuesta retrógrada, CIT2 y DLD3 de los mutantes eM2c, eT73l y eEC1118º junto a sus cepas parentales (Figura 5) . Todos presentaron una inducción de ambos genes respecto a la cepa parental en condiciones de crecimiento exponencial en medio rico, donde la expresión de ambos genes está reprimida, lo que indica una activación de la Respuesta Retrógrada atribuible a su genotipo. En conclusión, el método de la invención proporciona un proceso reproducible de obtención de mutantes tolerantes a AEC con propiedades vinícolas mejoradas que se comportan con un fenotipo compatible con la activación de la respuesta retrógrada y mejoran las características organolépticas del vino. Subclonación de genes de interés Se procedió a determinar si las mutaciones encontradas en las cepas mejoradas son las que causan el fenotipo de resistencia a AEC, mediante subclonación de los alelos mutantes y su análisis fenotípico. Respecto a RTG2, se clonó el alelo de eM2c, RTG2 R30C, y el de eT73l, RTG2 G248E en un plásmido centromérico de copia única pCUP1pNuiHA kanMX CEN. Dichos plásmidos otorgan tolerancia a AEC respecto al plásmido conteniendo la copia silvestre el gen RTG2, al transformar la cepa haploide vínica sin ninguna copia del gen C9 rtg2A (Figura 6A) . Los genes LYS21 y LYS20 son genes parálogos que codifican para la homocitrato sintasa, el primer paso de la biosíntesis de lisina. Fueron amplificados de los mutantes de interés y de sus cepas de origen e introducidos en el plásmido centromérico de copia única pCUP1pNuiHA kanMX CEN y transformado en una cepa vínica haploide C9 lys20A lys21A. Ensayos por goteo en placas con AEC demuestran que los alelos mutantes incrementan la tolerancia a dicho compuesto, demostrando por tanto que dicha mutación es la causante del fenotipo (Figura 6B) . Este hecho es muy claro para el alelo de LYS21 de eT73l, LYS21 R390G, y menos intenso, pero igualmente positivo para el alelo de LYS20 de eEC1118º LYS20 N379D. Experimentos en bodega Se realizaron fermentaciones experimentales con el mutante eT73l y su parental T73 en la bodega experimental del Vitec, Centro Tecnológico del Vino, Falset. El procedimiento es similar a las microvinificaciones, pero adaptado a un volumen mayor. Se utilizaron vinificaciones por triplicado en 50 kg de uva tempranillo. La cepa mutante posee una cinética de vinificación más lenta, medida como evolución de la densidad (Figura 7) , pero completa la fermentación. Al final de la vinificación ha visto reducido el grado alcohólico en 0.8% (v/v) (Esto es una disminución del 6% comparado con la cantidad de etanol de la cepa parental 14, 1%v/v vs 13.3%v/v) , además de reducir la acidez volátil (la medida del ácido acético) . El glicerol ha aumentado un 62% y también ha aumentado la acidez total medida como tartárico. De esta manera se confirma a gran escala los resultados observados en microvinificaciones. La cata de los vinos por parte de un panel experto indicó una ligera mejora en la valoración global del vino producido por la cepa eT73l respecto a T73, de manera que no supone una bajada en la calidad global del producto.
Publicaciones:
ES2957008 (08/01/2024) - A1 Solicitud de patente con informe sobre el estado de la técnica
Eventos:
En fecha 27/05/2022 se realizó Registro Instancia de Solicitud
En fecha 27/05/2022 se realizó Admisión a Trámite
En fecha 27/05/2022 se realizó 1001P_Comunicación Admisión a Trámite
En fecha 21/06/2022 se realizó Superado examen de oficio
En fecha 26/01/2023 se realizó Realizado IET
En fecha 02/02/2023 se realizó 1109P_Comunicación Traslado del IET
En fecha 08/01/2024 se realizó Publicación Solicitud
En fecha 08/01/2024 se realizó Publicación Folleto Solicitud con IET (A1)
En fecha 05/04/2024 se realizó PETEX_Petición de examen sustantivo
En fecha 05/04/2024 se realizó 5215P_Observaciones del solicitante al IET, Opinión Escrita y/o alegaciones a observaciones de terceros
En fecha 23/04/2024 se realizó Validación petición y/o pago de examen sustantivo conforme
Pagos:
27/05/2022 - Pago Tasas IET
Fuente de la información
Parte de la información aquí publicada es pública puesto que ha sido obtenida de la Oficina de Propiedad Industrial de los diferentes países el 29/04/2024 y por lo tanto puede ser que la información no esté actualizada.Parte de la información aquí mostrada ha sido calculada por nuestro sistema informático y puede no ser veraz.
Privacidad
Si considera que al información aquí publicada afecta a su privacidad y desea que eliminemos la información aquí publicada envíe un email a info@patentes-y-marcas.com o rellene el formulario que encontrará aquí.Información sobre el registro de patente nacional por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456
El registro de patente nacional por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456 fue solicitada el 27/05/2022. Se trata de un registro en España por lo que este registro no ofrece protección en el resto de países. El registro CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456 fue solicitada por UNIVERSITAT DE VALÈNCIA mediante los servicios del agente Sénida Remedios Cueto Priede. El registro [modality] por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456 está clasificado como C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865 según la clasificación internacional de patentes.
Otras invenciones solicitadas en la clasificación internacional de patentes C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865.
Es posible conocer invenciones similares al campo de la técnica se refiere. El registro de patente nacional por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456 está clasificado con la clasificación C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865 por lo que si se desea conocer más registros con la clasificación C12N 1/18,C12N 1/38,C12N 15/01,C12G 1/02,C12G 3/02,C12R 1/865 clicar aquí.Otras invenciones solicitadas a través del representante SÉNIDA REMEDIOS CUETO PRIEDE
Es posible conocer todas las invenciones solicitadas a través del agente SÉNIDA REMEDIOS CUETO PRIEDE entre las que se encuentra el registro patente nacional por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Si se desean conocer más invenciones solicitadas a través del agente SÉNIDA REMEDIOS CUETO PRIEDE clicar aquí.Patentes en España
Es posible conocer todas las invenciones publicadas en España entre las que se encuentra el registro patente nacional por CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN. Nuestro portal www.patentes-y-marcas.com ofrece acceso a las publicaciones de patentes en España. Conocer las patentes registradas en un país es importante para saber las posibilidades de fabricar, vender o explotar una invención en España.Patentes registradas en la clase C
Es posible conocer todas las patentes registradas en la clase C (QUIMICA; METALURGIA) entre las que se encuentra la patente CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12
Es posible conocer todas las patentes registradas en la clase C12 (BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUT) entre las que se encuentra la patente CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12N
Es posible conocer todas las patentes registradas en la clase C12N (MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN;CULTURE OU CONSERVATION DE MICRO-ORGANISM) entre las que se encuentra la patente CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12G
Es posible conocer todas las patentes registradas en la clase C12G (VINO; OTRAS BEBIDAS ALCOHOLICAS; SU PREPARACION ) entre las que se encuentra la patente CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.Patentes registradas en la clase C12R
Es posible conocer todas las patentes registradas en la clase C12R (SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C-C12Q, RELATIVO A LOS MICROORGANISMOS) entre las que se encuentra la patente CEPAS DE LEVADURA CON PROPIEDADES VINÍCOLAS OPTIMIZADAS Y SU MÉTODO DE OBTENCIÓN con el número P202230456. Conocer las patentes registradas en una clase es importante para saber las posibilidades de registrar una patente en esa misma clase.
¿Tienes alguna duda?
Escribe tu consulta y te responderemos rápida y gratuitamente.

Otras patentes similares

 P202230451
P202230451